Perforin/granzyme apoptosis pathway è la principale via di segnalazione usata dai linfociti citotossici per eliminare le cellule infettate da virus e/o trasformate. Studi su topi privati del gene indicano che la perforina, in combinazione con il granzima, potrebbe indurre l’apoptosi. È vitale per la funzione effettrice citotossica e ha un ruolo indispensabile, ma non definito, nell’apoptosi mediata dal granzima.
Perforina e granzima
La perforina è una proteina che forma pori ed è anche conosciuta come tossina dei granuli citoplasmatici. Il granzima è una famiglia di proteasi seriniche strutturalmente correlate, immagazzinate nei granuli citotossici dei linfociti citotossici (CL). Perforina e granzima inducono l’apoptosi delle cellule bersaglio in modo cooperativo (Figura 1). Il granzima è necessario per innescare l’apoptosi delle cellule bersaglio, ma dipende dall’essere adeguatamente trasportato dalla perforina. Sia la perforina che il granzima si legano alla superficie delle cellule bersaglio come parte di un singolo complesso macromolecolare associato alla serglicina, che diminuisce ulteriormente la probabilità di diffusione passiva dei granzimi.
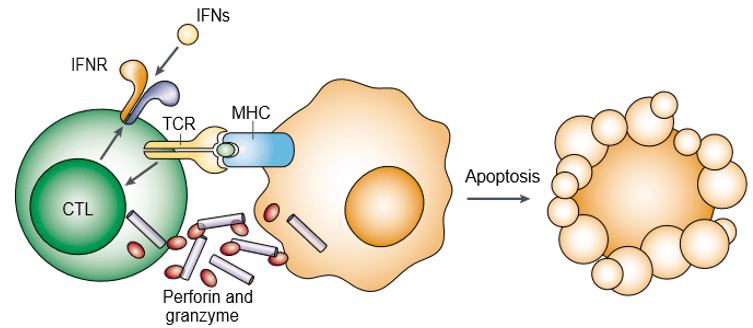
Figura 1. Nell’uomo ci sono i granzimi A, B, H, K e M, mentre nei topi ci sono i granzimi A, B, C, D, E, F, G, K, L, M e N. Il granzima A (GrA) e il granzima B (GrB) sono i granzimi più abbondanti e sono stati i più studiati. Le funzioni dei granzimi A e B nell’indurre l’apoptosi delle cellule bersaglio sono state ampiamente studiate in vitro, e sono meglio comprese rispetto al ruolo della perforina a livello molecolare.
Processo e regolazione della via dell’apoptosi del granzima/perforina
Una volta secreti dai linfociti citotossici, i granzimi entrano nelle cellule bersaglio, che è un passo vitale nella morte cellulare. Le principali proteine litiche impacchettate all’interno dei granuli sono diversi granzimi e la proteina perforina che forma i pori, che facilita l’internalizzazione dei granzimi da parte delle cellule.
Il granzima B innesca principalmente l’attivazione delle caspasi in modo indiretto, piuttosto che attraverso l’elaborazione diretta delle caspasi. Raggiunge questo obiettivo attivando direttamente i membri pro-apoptotici ‘BH3-only’ della famiglia BCL-2, come l’agonista della morte BH3-interacting domain (Bid). Bid insieme alle proteine pro-apoptotiche BCL-2 della famiglia Bax e/o Bak provocano la perdita di mediatori mitocondriali pro-apoptotici, come il citocromo c, nel citosol. Il rilascio del citocromo c attiva la pro caspasi-9, e legandosi al fattore di attivazione della proteasi apoptotica 1 (Apaf-1), la pro caspasi-9 diventa caspasi-9 matura, che continua a formare l’apoptosoma e attiva la caspasi-3 a valle. La caspasi-3 attivata è in grado di scindere substrati specifici come l’ICAD (inibitore della DNasi attivata dalla caspasi, CAD), permettendo al CAD di traslocare nel nucleo per frammentare il DNA. Oltre a Bid, il granzima B può inattivare Mcl-1 che è un membro della famiglia anti-apoptotica Bcl-2 per rilasciare la proteina pro-anti-apoptotica Bim della famiglia Bcl-2 sulla membrana mitocondriale esterna. E il granzima B può anche mediare l’effettore caspasi-3 e l’iniziatore caspasi-8 per regolare la via dell’apoptosi.
Al contrario del granzima B, il granzima M non dipende dal mitocondrio per regolare, ma il granzima M può attivare il granzima B tramite la scissione dell’inibitore della proteinasi 9 (PI-9) che è l’inibitore del granzima B. Il granzima M può anche scindere direttamente l’ICAD per scatenare il CAD come il granzima B.
Il granzima A induce la perdita del potenziale di membrana interna mitocondriale e il rilascio di specie reattive dell’ossigeno (ROS). Genera tacche di DNA a singolo filamento, piuttosto che frammenti di DNA oligonucleosomico. In risposta ai ROS, il complesso SET associato all’ER, che comprende SET, Ape1, pp32, HMG2, NM23-H1 e TREX1, si sposta nel nucleo, dove il granzima A taglia tre membri del complesso SET che sono coinvolti nella riparazione del DNA: HMG2, Ape1, e SET.
Perforin/Granzyme Apoptosis Pathway in Disease
Gli studi sui topi privati del gene indicano chiaramente che la via della perforina è coinvolta intimamente nella difesa contro i patogeni virali e le cellule trasformate. Ma, ruoli insospettati per la perforina come mediatore cruciale della sorveglianza immunitaria delle cellule spontaneamente trasformate e nella regolazione dell’omeostasi delle cellule B e della memoria delle cellule T sono stati dimostrati anche in vivo. Paradossalmente, la perforina è strumentale nella patogenesi di alcuni modelli di malattie autoimmuni, come il diabete insulino-dipendente nei topi diabetici non obesi (NOD), ma potrebbe sopprimere altre malattie autoimmuni, compresa l’encefalomielite autoimmune sperimentale (EAE).
Si stanno determinando le vie di apoptosi della perforina/granzima che regolano la polarizzazione dei granuli e l’esocitosi, e queste vie potrebbero essere interrotte dall’interazione delle cellule tumorali con alcuni linfociti citotossici. Le recenti scoperte che l’ingresso del granzima nelle cellule bersaglio coinvolge il legame a specifici recettori di membrana e che alcuni tumori sintetizzano inibitori della serina proteasi che possono neutralizzare i granzimi hanno indicato nuovi potenziali modi in cui i tumori potrebbero sfuggire all’attacco immunitario.
.