Paziente con una lesione subepiteliale gastrica
Martín Gómez Zuleta, MD (1)
(1) Unità di Gastroenterologia, Dipartimento di Medicina Interna, Università Nazionale della Colombia. Ospedale Tunal. Bogotà, Colombia..
Ricevuto: 05-10-10 Accettato: 25-11-10
Abstract
Anche se le lesioni subepiteliali si trovano raramente nel tratto gastrointestinale superiore, possono causare incertezza nell’approccio diagnostico e nella gestione. I risultati endosonografici sono descritti e le raccomandazioni attuali sono riviste alla luce di un caso per consentire un approccio razionale a queste lesioni.
Parole chiave
Tumori sottomucosi, ecografia endoscopica, GIST.
Caso clinico
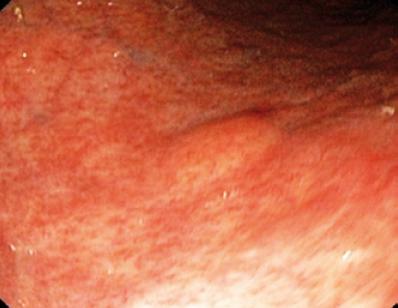
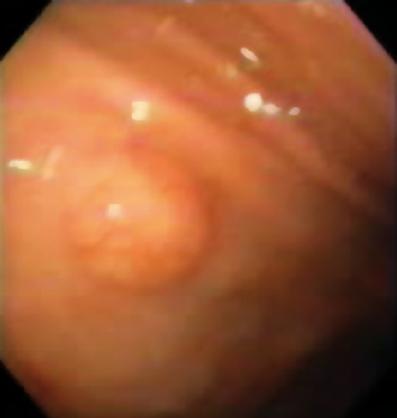
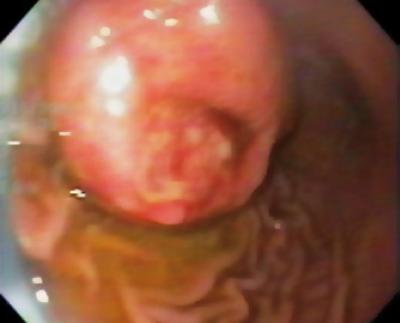
Un uomo di 50 anni con dispepsia è stato inviato per un’endoscopia superiore che ha trovato una lesione subepiteliale di 9 mm nel corpo gastrico (Figura 1). La biopsia della mucosa sovrastante era normale. Il paziente non aveva una storia medica precedente e il suo esame fisico era normale.
Figura 1. Lesione subepiteliale gastrica.
Approccio iniziale: Cosa potremmo fare allora?
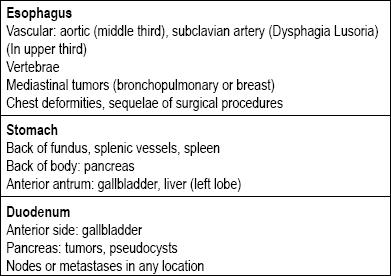
Una massa o sporgenza nel lume di un organo coperto da epitelio normale è chiamata lesione subepiteliale. Si tratta di lesioni poco comuni, che dovrebbero essere presenti in 1 su 300 endoscopie (1, 2). Le cause possono essere lesioni intrinseche benigne o maligne della parete del tratto gastrointestinale o compressione estrinseca causata da strutture adiacenti normali o patologiche (3).
Queste lesioni sono di solito trovate incidentalmente e spesso non hanno alcuna relazione con i sintomi, come nel caso del nostro paziente. Questo può indurre il medico a dubitare se deve seguire con indagini più specifiche ed eseguire ulteriori (4). A nostro avviso tutte queste lesioni dovrebbero essere valutate per chiarire la loro origine. Dovremmo sempre fare una biopsia della mucosa sovrastante (a meno che non si sospetti un’origine vascolare o cistica), perché molte di queste lesioni possono avere un’origine nella lamina propria o nella muscularis mucosa. In questi casi possono essere raggiunti con il forcipe e si può fare una diagnosi precisa. Se le biopsie sono normali, è qui che dobbiamo definire se dobbiamo interrompere o continuare lo studio.
Una volta eseguita l’endoscopia e individuata una lesione sottoepiteliale, possiamo immediatamente valutarla. Inizialmente dobbiamo descriverne le dimensioni, la forma, il colore e la mobilità, e se è pulsante o meno. Infine possiamo valutare la sua consistenza con una pinza da biopsia chiusa, che ci permette di rilevare se è cistica, solida o morbida, depressibile e a cuscino (una lesione che si sta lentamente riprendendo). Le lesioni a cuscino con aloni gialli sono altamente suggestive di lipomi. Se la lesione è una leggera irregolarità della mucosa, e ha una depressione centrale, è suggestiva di un pancreas ectopico. Di solito le cisti o le varici hanno una mucosa liscia e simmetrica. I GIST (tumori stromali gastrointestinali) possono essere leggermente ulcerati, ma sono sodi e mobili (9). È anche utile cambiare la posizione del paziente per escludere la possibilità di una lesione estrinseca, il cui aspetto endoscopico cambierà se il paziente cambia posizione, inala o se lo stomaco del paziente è pieno d’aria (10-12).
Qual è la diagnosi differenziale?
Ci sono molti tipi di lesioni nel tratto gastrointestinale che possono essere classificate come subepiteliali. Le loro cause di solito dipendono dal fatto che la lesione si trovi nell’esofago, nello stomaco, nel duodeno o nel retto. Il prossimo punto da considerare è se si tratta veramente di una lesione della parete, o se si tratta di una compressione estrinseca poiché ci sono strutture in tutto il tratto gastrointestinale che possono portare alla compressione (Tabella 1) (5-8).
Tabella 1. Cause primarie di compressioni extraluminali del tratto digestivo superiore.
Dovrebbero essere valutate tutte le lesioni con l’ecografia endoscopica (EUS)?
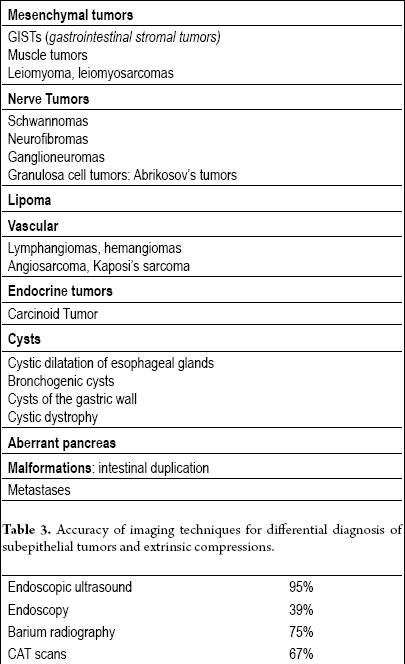
In realtà, tutte le lesioni subepiteliali (Tabella 2) devono essere valutate con ulteriori tecniche di imaging, ma se la lesione è meno di un centimetro di diametro (specialmente se è gialla), una valutazione non è necessaria perché c’è un’alta probabilità che sia un lipoma.
Tabella 2. Tumori subepiteliali del tratto gastrointestinale.
L’ecografia endoluminale o endoscopica (EUS) è la tecnica di scelta (13, 14). L’accuratezza dell’EUS per la differenziazione della compressione extraluminale da un tumore subepiteliale è superiore al 95%. Questo è molto meglio di altre tecniche di imaging come l’ecografia convenzionale o la TAC (15-17) (Tabella 3).
Tabella 3. Accuratezza delle tecniche di imaging per la diagnosi differenziale dei tumori subepiteliali e delle compressioni estrinseche.
Una volta stabilito che la lesione è intrinseca alla parete e non è una compressione estrinseca, dobbiamo valutare a quale strato della parete corrisponde. Normalmente, la parete dello stomaco si divide in mucosa, sottomucosa, muscularis propria e sierosa. Lo strato mucoso si divide in epitelio, membrana basale, lamina propria e mucosa muscolare. Con l’EUS e con l’attrezzatura radio la parete può essere divisa in 5 strati (18):
Il primo strato iperecoico corrisponde alla parte più superficiale della mucosa gastrica.
Il secondo strato ipoecoico corrisponde alla parte più profonda della mucosa che può essere correlata con la mucosa muscolare.
Il terzo strato iperecoico corrisponde allo strato sottomucoso.
Il quarto strato ipoecoico corrisponde al muscolo stesso.
Il quinto strato iperecoico corrisponde alla sierosa o avventizia.
Normalmente non ci sono lesioni negli strati uno e cinque (19), quindi si limitano a tre strati. Di solito sono ipoecogene, anecoiche o iperecogene.
Diagnosi con l’ecografia endoscopica
Descriveremo ogni presentazione secondo il suo strato.
Lo strato eco due
Corrisponde alla parte più profonda della mucosa o alla lamina propria e alla muscularis mucosa. Le lesioni che sorgono in questo strato sono rare e sono di solito ipoecogene.
Le lesioni ipoecogene: La maggior parte dei tumori che sorgono in questo strato sono muscolari, di solito leiomiomi. Possono avere calcificazioni e quelli grandi possono essere eterogenei e mostrare noduli a differenza delle piccole lesioni che sono omogenee. (20).
In questo strato, troviamo anche i tumori di Abrikosovs o cellule granulari. Sono di solito piccoli e, a differenza del leiomioma, deformano la sfera dell’endoscopio a causa della loro durezza (figure 2 e 3). Anche i carcinoidi possono avere origine in questo strato, di solito nel fondo o nel retto (Figura 4).
Figura 2. Lesione subepiteliale di colore giallo nell’esofago distale.
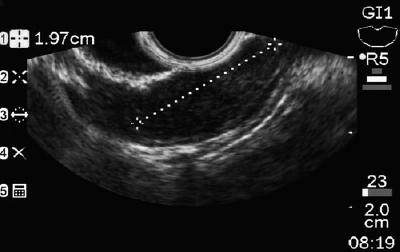
Figura 3. L’EUS mostra una lesione isoecoica nel terzo strato eco che deforma la sfera, suggerendo un tumore a cellule granulari di 2 cm
Figura 4. Lesione subepiteliale con un modello reticolare al centro che suggerisce un tumore neuroendocrino.
Lesioni anecoiche: Di solito possiamo vedere che le cisti di inclusione o di ritenzione possono avere origine in questo strato.
Lo strato eco tre
È una banda di tessuto che appare iperecoica nell’EUS. Numerosi tumori possono avere origine in questo strato.
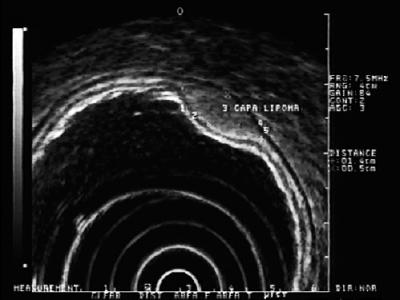
Lesioni iperecogene: Le lesioni più frequentemente trovate in questo strato sono i lipomi. Sono caratterizzati da lesioni omogenee iperecogene. Di solito, sono simili a cuscini quando vengono spinti con una pinza endoscopica (Figura 5) (9).
Figura 5. EUS: lesione iperecogena nello strato sottomucoso 3 compatibile con un lipoma.
I neurofibromi tendono ad essere iperecogeni. Hanno origine nella sottomucosa o nella muscularis propria.
Le lesioni ipoecogene in questo strato possono corrispondere a pancreati ectopici o aberranti. Queste lesioni sono di solito eterogenee e occasionalmente si possono vedere al centro strutture duttali anecoiche che possono corrispondere a dotti. In un’endoscopia si vede una lesione con un centro depresso (21).
Le lesioni ipoecogene possono anche corrispondere a tumori carcinoidi. Anche se non sono tumori subepiteliali perché sono neuroendocrini piuttosto che mesenchimali, possono essere localizzati nella parete digestiva e dare origine allo stesso tipo di noduli. Di solito sono piccoli (meno di un cm), ipoecogeni (ma più ecogeni che muscolari) e si stabiliscono nella mucosa. Lo studio istologico è di solito possibile da una biopsia (22, 23).
I linfomi gastrici possono anche essere presenti come lesioni ipoecogene o iperecogene della sottomucosa (24).
Le lesioni anecoiche osservate in questo strato sono probabilmente strutture vascolari o cisti (25).
Lo strato eco quattro
corrisponde allo strato muscolare. Quindi la maggior parte dei tumori di questo strato sono di origine muscolare.
Le lesioni iperecogene sono molto rare, ma possono essere legate a linfomi, tumori neurogenici o metastasi (26).
Le lesioni ipoecogene: La maggior parte dei tumori di questo strato sono ipoecoici, per lo più tumori stromali (GIST) quando sono situati nello stomaco. Tuttavia, se sono situati nell’esofago sono solitamente chiamati leiomiomi. Altre lesioni che possono avere questo aspetto sono le metastasi che hanno origine nei polmoni o nei seni e il tumore del glomo (27). Anche i linfomi possono compromettere questo strato, ma sono generalmente accompagnati da un impegno degli strati superiori.
GIST (tumore stromale gastrointestinale) è il nome della lesione sulla quale le nostre conoscenze sono molto migliorate negli ultimi anni (28-30). Questi tumori sembrano avere origine in cellule totipotenziali che sono anche i punti di origine delle cosiddette cellule interstiziali di Cajal. Possono essere differenziati in gruppi: prevalentemente muscolari, prevalentemente neurali o una combinazione dei due. La diagnosi è fatta dall’identificazione immunoistochimica della proteina CD-117 (conosciuta anche come proteina c-kit) che è un recettore di membrana con attività tirosin-chinasica (31).
L’importanza di queste lesioni è che il 30% può avere un comportamento maligno e dare origine a metastasi. Solo negli Stati Uniti, ogni anno vengono segnalati da 5.000 a 6.000 casi (32). La loro distribuzione nel tratto gastrointestinale è: stomaco (40-70%), intestino tenue (20-40%), colon e retto (5-15%) ed esofago (<5%) (33). Questo significa che se abbiamo una lesione ipoecogena del quarto strato nell’esofago, probabilmente è un leiomioma, ma se è nello stomaco, di solito è un GIST (Figura 6, 7 y 8). La maggior parte dei pazienti sono nella quinta o sesta decade di vita. Di solito hanno una lesione localizzata nel quarto strato o nella muscularis propria, sebbene possa essere localizzata anche nella muscularis mucosa (34). La maggior parte dei pazienti sono asintomatici fino a quando il tumore diventa abbastanza grande da ulcerarsi, sanguinare o metastatizzare.
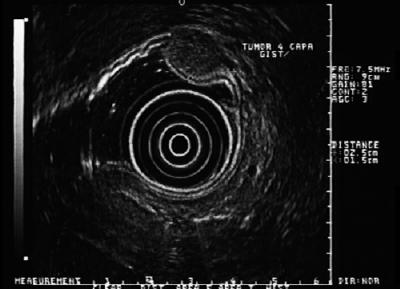
Figura 6. L’EUS mostra una lesione ipoecogena del quarto strato compatibile con GIST.
Figura 7. Lesione ulcerata suggestiva di GIST.
Figura 8. L’EUS della Figura 7 mostra una lesione ipoecogena del quarto strato eco altamente suggestiva di un GIST, più di 5cm.
Per questo motivo, se identifichiamo un GIST maggiore di 3 cm è un’indicazione alla chirurgia anche se è asintomatico (altri autori suggeriscono un limite di 4 cm). (35). Tuttavia, le lesioni di meno di 3 cm rappresentano una sfida per la gestione perché la maggior parte sono benigne. Tuttavia, va chiarito che tutti i GIST sono potenzialmente maligni, e sono stati riportati piccoli GIST che hanno metastatizzato, specialmente nel tratto gastrointestinale inferiore. Attualmente non siamo in grado di prevedere con l’ecografia endoscopica il potenziale maligno di un GIST. Tuttavia, sappiamo che le lesioni più grandi di 4 cm, con bordi irregolari e/o spazi cistici al loro interno, o con focolai ecogeni hanno un’alta probabilità di essere maligne (36).
D’altra parte l’aspirazione endoscopica ecoguidata con ago sottile (EUS-FNA) non solo può diagnosticare il GIST identificando il CD-117, ma anche la presenza della proteina Ki-67 che indica la proliferazione e suggerisce un comportamento maligno (37). È molto importante sottolineare che le lesioni da GIST sono molto pericolose. Dobbiamo seguirle continuamente, valutando le dimensioni del tumore e il tasso di proliferazione secondo i rischi stabiliti. Anche dopo una resezione completa, queste lesioni possono recidivare, soprattutto nel sito di origine, ma anche nel peritoneo o nel fegato. Dal 40% al 90% delle lesioni si ripresentano nonostante la resezione completa. Il 50% delle recidive coinvolge il fegato. I GIST hanno un rischio di recidiva 4 volte maggiore quando il sito primario è l’intestino rispetto a quando è nello stomaco (38).
Qual è la precisione dell’ecografia endoscopica?
Molti studi hanno dimostrato che l’EUS è molto accurata per determinare se una lesione è sulla parete o meno, e per stabilire da quale strato della parete proviene la lesione. Questo ci permette di scegliere il miglior approccio diagnostico. Uno studio ha determinato che lo strato di origine in 48 su 50 pazienti (96%) con conferma chirurgica (39). L’accordo interosservatore è molto buono, specialmente quando si identificano lesioni come i leiomiomi e le lesioni vascolari. È importante notare che l’aspetto sonografico delle lesioni non ci permette di determinare le loro cause con il 100% di certezza. Uno studio di Karaca et al. (40) su 22 pazienti sottoposti a EUS seguita da mucosectomia ha dimostrato che l’accuratezza dell’EUS era solo del 45%. Tuttavia, le lesioni erano per lo più più piccole di 20 mm, e la precisione dell’ecografia è salita al 66% per differenziare i tumori maligni da quelli benigni. Poiché i criteri ecografici possono essere imprecisi, sembra ragionevole che dovremmo, se possibile, cercare di ottenere una diagnosi specifica. Questo può essere ottenuto con l’EUS-FNA o la resezione della mucosa della lesione, come dimostrato in questo lavoro. Mekky et al. hanno studiato 141 pazienti sottoposti a EUS-FNA controllati chirurgicamente. Hanno trovato un’accuratezza del 95,6% per i loro risultati finali (41).
Monitoraggio, biopsia con puntura o resezione?
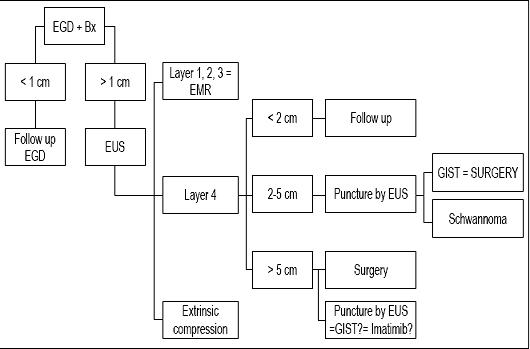
La decisione di monitorare, utilizzare o eseguire una resezione dipende da diversi fattori tra cui le dimensioni della lesione, il suo aspetto endoscopico, lo strato di origine e le sue caratteristiche ecogene. Se ci troviamo di fronte a una lesione subepiteliale di meno di 1 cm, non sono giustificati più esami, ma si dovrebbe eseguire un’endoscopia di controllo. Se la lesione è superiore a 1 cm, l’EUS è obbligatorio. Se la lesione è piccola e dipende dal primo, secondo o terzo strato eco, si può eseguire una resezione diagnostica della mucosa, che è anche terapeutica. Tuttavia, se la lesione si trova nel quarto strato ed è inferiore a 2cm, si raccomanda il monitoraggio con la sola endoscopia. Se misura tra 2cm e 5cm, l’EUS-FNA è l’ideale. Se si stabilisce che si tratta di una lesione benigna, un esame di controllo può essere eseguito dopo 6 mesi. Se non è cresciuta, non è necessario un ulteriore monitoraggio. Se è maligna, ha un potenziale maligno, o è più grande di 5 cm, si raccomanda il trattamento (42).
In conclusione, poiché il nostro paziente aveva una lesione più piccola di 1 cm, crediamo che la sua lesione meritasse solo un’endoscopia di follow-up (vedi algoritmo, Figura 9). Un nuovo esame di follow-up è stato proposto tra un anno. Se la lesione non è cresciuta, ulteriori controlli saranno programmati ogni 2 o 3 anni, ma se cresce proporremo un EUS-FNA e uno studio immunoistochimico.
Figura 9. Algoritmo di trattamento nelle lesioni subepiteliali. EGD: endoscopia superiore. Bx: Biopsia. EUS: ecografia endoscopica. EMR: resezione endoscopica della mucosa.
1. Polkowski M, Butruk E. Lesioni sottomucose. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Approccio endoscopico ai tumori stromali gastrointestinali. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Ciak A. EUS nei tumori sottomucosi. Gastrointest Endosc 2002; 56 (4 Suppl.): S43-8.
4. Polkowski M. Ecografia endoscopica e aspirazione dell’ago sottile guidata dall’ecografia per la diagnosi di tumori sottomucosi maligni. Endoscopia 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterologia 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuratezza dell’ecografia endoscopica nelle lesioni sottomucose gastrointestinali superiori: uno studio prospettico multicentrico. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Caratteristiche endosonografiche dei pancreas ectopici gastrici distinguibili dai tumori mesenchimali. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Caratteristiche endosonografiche dei tumori a cellule granulari esofagei. Endoscopia 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Ruolo dell’ecografia endoscopica nella gestione dei tumori sottomucosi dell’esofago e dello stomaco. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsia con ago sottile di cisti da duplicazione gastrica con guida ecografica endoscopica. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Resezione endoscopica della mucosa per le neoplasie gastriche. Tecniche di endoscopia gastrointestinale 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Resezione mucosa endoscopica. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Ecografia endoscopica nei tumori stromali gastrointestinali (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcellona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Uno studio sui tumori miogenici del tratto gastrointestinale superiore mediante ultrasonografia endoscopica con particolare riferimento alla diagnosi differenziale delle lesioni benigne e maligne. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Valutazione delle lesioni sottomucose del tratto gastrointestinale superiore da ultrasuoni endoscopici. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Accordo interosservatore per EUS nella valutazione e diagnosi di masse sottomucose. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Ecografia endoscopica nella diagnosi di tumore sottomucoso gastrico. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Correlati istologici di immagini ecografiche gastrointestinali. Gastroenterologia 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Valutazione prospettica di una sonda US con catetere over-the-wire. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ultrasonografia endoscopica per la valutazione dei tumori muscolari lisci nel tratto gastrointestinale superiore: un’esperienza con 42 casi. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ecografia endoscopica. Endoscopia 2003; 35: 127-35
23. Byrne MF, Jowell PS. Imaging gastrointestinale: ecografia endoscopica. Gastroenterologia 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Rendimento del campionamento del tessuto per le lesioni sottomucose valutate da EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ultrasonografia endoscopica per la stadiazione iniziale e il follow-up in pazienti con linfoma gastrico di basso grado del tessuto linfoide associato alla mucosa trattato medicalmente. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosi di cisti di duplicazione dell’intestino anteriore mediante ultrasonografia endoscopica. Gastroenterologia 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. differenziazione endosonografica di tumori a cellule stromali benigni e maligni. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Caratteristiche endosonografiche predittive dei tumori benigni e maligni delle cellule stromali gastrointestinali. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologia e criteri diagnostici dei tumori stromali gastrointestinali (GIST): Una revisione. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacia e sicurezza di imatinib mesilato nei tumori stromali gastrointestinali avanzati. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Tumori stromali gastrointestinali e altre lesioni mesenchimali dell’intestino. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Tumori stromali gastrointestinali: Da un approccio chirurgico a uno molecolare. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Gestione dei tumori stromali gastrointestinali maligni. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumori stromali gastrointestinali. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Misurazione delle lesioni tramite endoscopia: una panoramica. Endoscopia 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Presentazione clinica dei tumori stromali gastrointestinali e trattamento della malattia operabile. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Uno studio sui tumori miogenici del tratto gastrointestinale superiore mediante ultrasonografia endoscopica con particolare riferimento alla diagnosi differenziale delle lesioni benigne e maligne. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Valutazione prognostica del tumore stromale gastrointestinale. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumori stromali gastrici. Uno studio clinicopatologico di 77 casi con correlazione delle caratteristiche con comportamenti clinici non aggressivi e aggressivi. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. tumori sottomucosi e foli gastrici spessi. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuratezza di EUS nella valutazione delle piccole lesioni subepiteliali gastriche. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Utilità diagnostica di FNA guidato da EUS in pazienti con tumori sottomucosi gastrici. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Lesioni sottomucose. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Approccio endoscopico ai tumori stromali gastrointestinali. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Ciak A. EUS nei tumori sottomucosi. Gastrointest Endosc 2002; 56 (4 Suppl.): S43-8.
4. Polkowski M. Ecografia endoscopica e aspirazione con ago sottile guidata da ultrasuoni per la diagnosi di tumori sottomucosi maligni. Endoscopia 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterologia 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuratezza dell’ecografia endoscopica nelle lesioni sottomucose gastrointestinali superiori: uno studio prospettico multicentrico. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Caratteristiche endosonografiche dei pancreas ectopici gastrici distinguibili dai tumori mesenchimali. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Caratteristiche endosonografiche dei tumori a cellule granulari esofagei. Endoscopia 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Ruolo dell’ecografia endoscopica nella gestione dei tumori sottomucosi dell’esofago e dello stomaco. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsia con ago sottile di cisti da duplicazione gastrica con guida ecografica endoscopica. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Resezione endoscopica della mucosa per neoplasie gastriche. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Resezione mucosa endoscopica. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Ecografia endoscopica nei tumori stromali gastrointestinali (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcellona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Uno studio sui tumori miogenici del tratto gastrointestinale superiore mediante ultrasonografia endoscopica con particolare riferimento alla diagnosi differenziale delle lesioni benigne e maligne. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Valutazione delle lesioni sottomucose del tratto gastrointestinale superiore da ultrasuoni endoscopici. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Accordo interosservatore per EUS nella valutazione e diagnosi di masse sottomucose. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Ecografia endoscopica nella diagnosi di tumore sottomucoso gastrico. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Correlati istologici di immagini ecografiche gastrointestinali. Gastroenterologia 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Valutazione prospettica di una sonda US con catetere over-the-wire. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ultrasonografia endoscopica per la valutazione dei tumori muscolari lisci nel tratto gastrointestinale superiore: un’esperienza con 42 casi. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ecografia endoscopica. Endoscopia 2003; 35: 127-35
23. Byrne MF, Jowell PS. Imaging gastrointestinale: ecografia endoscopica. Gastroenterologia 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Rendimento di campionamento del tessuto per lesioni sottomucose valutate da EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ultrasonografia endoscopica per la stadiazione iniziale e il follow-up in pazienti con linfoma gastrico di basso grado del tessuto linfoide associato alla mucosa trattato medicalmente. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosi di cisti di duplicazione dell’intestino anteriore mediante ultrasonografia endoscopica. Gastroenterologia 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. differenziazione endosonografica di tumori a cellule stromali benigni e maligni. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Caratteristiche endosonografiche predittive dei tumori benigni e maligni delle cellule stromali gastrointestinali. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologia e criteri diagnostici dei tumori stromali gastrointestinali (GIST): Una revisione. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacia e sicurezza di imatinib mesilato nei tumori stromali gastrointestinali avanzati. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Tumori stromali gastrointestinali e altre lesioni mesenchimali dell’intestino. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Tumori stromali gastrointestinali: Da un approccio chirurgico a uno molecolare. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Gestione dei tumori stromali gastrointestinali maligni. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumori stromali gastrointestinali. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Misurazione delle lesioni tramite endoscopia: una panoramica. Endoscopia 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Presentazione clinica dei tumori stromali gastrointestinali e trattamento della malattia operabile. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Uno studio sui tumori miogenici del tratto gastrointestinale superiore mediante ultrasonografia endoscopica con particolare riferimento alla diagnosi differenziale delle lesioni benigne e maligne. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Valutazione prognostica del tumore stromale gastrointestinale. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumori stromali gastrici. Uno studio clinicopatologico di 77 casi con correlazione delle caratteristiche con comportamenti clinici non aggressivi e aggressivi. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. tumori sottomucosi e foli gastrici spessi. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuratezza di EUS nella valutazione delle piccole lesioni subepiteliali gastriche. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Utilità diagnostica di FNA guidato da EUS in pazienti con tumori sottomucosi gastrici. Gastrointest Endosc 2010; 71: 913-9.