Contenuti
- 1 Introduzione
- 2 Caratteristiche strutturali
- 3 Funzione
- 4 Rilevanza per la salute umana & Malattia
- 5 Collegamenti esterni
Introduzione
La lipasi gastrica umana (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) è la lipasi responsabile dell’avvio della digestione dei grassi alimentari nello stomaco. Questo enzima acido-stabile è secreto dalle cellule principali fundiche dello stomaco umano e catalizza il 10-20% dei processi lipolitici totali (cioè, quelli che coinvolgono la scomposizione dei grassi) negli adulti sani. HGL catalizza specificamente l’idrolisi del triacilglicerolo per produrre diacilglicerolo e un sottoprodotto carbossilato, un processo che facilita la successiva ripartizione del grasso da parte della lipasi pancreatica. In termini di implicazioni patologiche, ci sono prove che suggeriscono che la secrezione di HGL è alterata in individui con gastrite (la condizione gastrica più comune, in cui il rivestimento dello stomaco è infiammato). Inoltre, gli individui con funzione pancreatica compromessa (e quindi ridotti livelli di lipasi pancreatica) devono dipendere fortemente da HGL per digerire i grassi alimentari .
Highlights strutturali
HGL, un enzima idrolasi costituito da due subunità lunghe 379 aminoacidi, possiede una che contiene residui Ser-153, His-353, e Asp-324. Questa struttura è essenziale per la scomposizione dei lipidi, coordinata con un a Leu-67 e Gln-154 , che serve a stabilizzare lo stato di transizione. Strutturalmente, la lipasi gastrica umana mostra un complesso (fogli beta mostrati in giallo, eliche alfa mostrate in arancione, spirali mostrate in verde, e carboidrati risolti mostrati in viola). L’HGL ai residui 215-244 lascia il posto alle regioni idrofobiche (notate in rosso) che circondano il sito attivo e interfacciano il coperchio. Queste aree sono pensate per attirare i lipidi e promuovere il docking .
Funzione
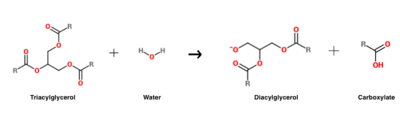
La reazione di idrolisi del triacilglicerolo che è catalizzata da HGL .
HGL funziona ad un pH ottimale di circa cinque, e catalizza principalmente l’idrolisi dei triacilgliceroli a catena corta.
Come un’esterasi con una serina cataliticamente attiva, HGL esibisce un meccanismo simile a quello della serina esterasi stabilito. La serina del sito attivo, situata all’interno del , è facilitata prima dalla vicina formazione di un ponte salino tra Asp-136 e His-152, che induce l’appropriazione di un protone da Ser-153. Il Ser-153, ora altamente nucleofilo, attacca il carbonio carbonilico del gruppo acetato in una molecola di triacilglicerolo. La specie tetraedrica è stabilizzata dal foro dell’ossianione. Tuttavia, non appena la specie si disassembla nell’acetato covalentemente legato e nella lipasi, la serina subisce una deacilazione in cui l’acqua agisce come nucleofilo. Questo passo finale ripristina la Ser-153 al suo stato protonato.
Rilevanza per la salute umana & Malattia
L’azione idrolitica di HGL è in qualche modo ancillare negli adulti sani, in cui HGL modula 10-20% della ripartizione dei grassi alimentari al massimo. Tuttavia, la presenza di HGL è cruciale nei neonati prematuri, che spesso mostrano una scarsa funzione pancreatica, così come gli adulti con insufficienza pancreatica patologica (ad esempio, pancreatite cronica). Questi individui non sono in grado di produrre quantità adeguate di lipasi pancreatica e devono quindi contare principalmente su HGL per la digestione dei grassi alimentari. In questi individui, HGL è responsabile per idrolizzare il 30-60% dei trigliceridi alimentari.
Tomasik et al. (2013) hanno studiato la regolazione ormonale della secrezione HGL in bambini e adolescenti con gastrite. L’attività HGL è stata confrontata in tre gruppi: un gruppo sperimentale composto da adolescenti con diagnosi di gastrite da Helicobacter pylori (n = 10), un altro gruppo sperimentale composto da adolescenti con una forma di gastrite non indotta da H. pylori (n = 10), e un gruppo di controllo di adolescenti sani (n = 14). L’attività del HGL, oltre alle concentrazioni plasmatiche di glucagon-like peptide-1, colecistochinina e peptide insulinotropo glucosio-dipendente, sono state osservate attraverso l’analisi di campioni di succo gastrico che erano stati raccolti tramite misurazioni endoscopiche da ogni paziente.
I pazienti la cui gastrite superficiale è stata indotta da agenti patogeni diversi da H. pylori hanno esibito livelli più bassi di attività HGL rispetto sia agli adolescenti sani (p < .005) che a quelli a cui è stata diagnosticata una gastrite da H. pylori (p < .005). Le concentrazioni plasmatiche medie del peptide insulinotropo glucosio-dipendente erano più basse nei pazienti sani (p < 0.005) che in quelli con gastrite non H. pylori (p < .003) e in quelli con gastrite H. pylori (p < 0.01). La regolazione della secrezione di HGL da parte del glucagon-like peptide-1 (GLP-1) e della colecistochinina (CCK) è stata quindi trovata alterata negli adolescenti con gastrite; a sostegno di questa scoperta, è stato suggerito nella letteratura esistente che GLP-1 e CCK inibiscono la secrezione di HGL. Inoltre, il peptide insulinotropo dipendente dal glucosio è risultato essere un potente attivatore dell’attività della lipasi gastrica umana in tutti i gruppi sperimentali e di controllo .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG