- Cosa rende una molecola polare?
- Guarda la formula strutturale del biossido di carbonio:
- Perché l’acqua è polare?
L’acqua è una molecola polare perché il suo ossigeno è fortemente elettronegativo e, come tale, tira la coppia di elettroni verso di sé (lontano dai due atomi di idrogeno), acquisendo così una carica leggermente negativa.
La polarità di una molecola dipende non solo dai suoi atomi costituenti, ma anche da come sono disposti intorno all’atomo centrale, cioè la disposizione spaziale di questi atomi. Per capirlo meglio, discutiamo l’argomento più in dettaglio.
Cosa rende polare una molecola?
La polarità di una molecola è legata allo spostamento degli elettroni in una particolare direzione. Questo, a sua volta, dipende dalla polarità dei legami presenti nella molecola, poiché anche questi legami contengono elettroni.
In una molecola, l’atomo con il maggior potere di attrarre elettroni verso di sé (cioè, è più elettronegativo dell’altro atomo) acquisirà una leggera carica negativa su se stesso, e il legame tra i due atomi diventerà polare.
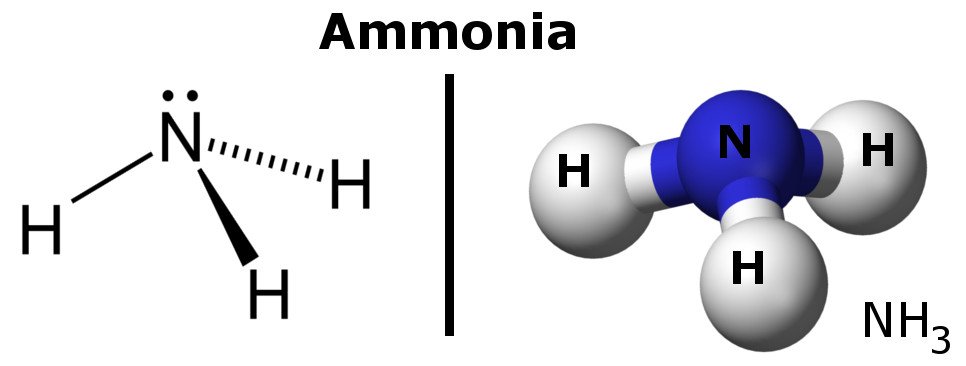
L’ammoniaca è una molecola polare perché ha regioni di leggere cariche negative e positive.
Tutto sommato, si potrebbe dire che la densità di elettroni di un legame polare si accumula verso un’estremità del legame, il che fa sì che questa estremità possieda una leggera carica negativa, mentre l’altra estremità ha una leggera carica positiva. Questo rende una molecola polare.
Parimenti, se una molecola non ha regioni di carica positiva e negativa, è considerata non polare.
Tuttavia, una cosa interessante da notare è che maggiore è la differenza di elettronegatività, più polare sarà il legame all’interno di una molecola. I composti carbonilici sono polari perché il carbonio carbonilico è leggermente positivo. Quindi, l’anidride carbonica, che contiene un carbonio positivo e due ossigeni parzialmente negativi, non dovrebbe essere polare?
Ebbene, l’anidride carbonica consiste di due atomi di ossigeno attaccati a un atomo di carbonio. Gli atomi di ossigeno sono molto più elettronegativi degli atomi di carbonio, e come tali, dovrebbero avere una carica parzialmente negativa, mentre l’atomo di carbonio dovrebbe essere leggermente carico positivamente. Tuttavia, è interessante notare che ciò non accade.
Guardate la formula strutturale dell’anidride carbonica:
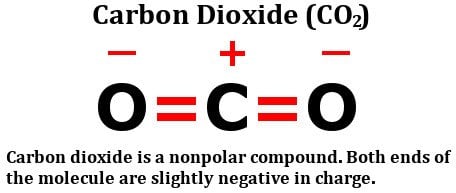
È composta da due atomi di ossigeno ugualmente elettronegativi, sì, ma guardate come questi atomi sono disposti attorno all’atomo di carbonio. Stanno entrambi ad un angolo perfetto di 180 gradi rispetto al carbonio. Di conseguenza, tirano la densità di elettroni dal carbonio con forza uguale in direzioni opposte. Il risultato netto è che la densità di elettroni sull’atomo di carbonio rimane inalterata, il che rende la molecola di biossido di carbonio non polare.
Il biossido di carbonio è un grande esempio di come la geometria di una molecola gioca un ruolo cruciale nel determinare se è polare o non polare. Ora, diamo un’occhiata a una molecola d’acqua:
Perché l’acqua è polare?
La formula chimica dell’acqua è H20, il che significa che contiene due atomi di idrogeno e uno di ossigeno. Gli atomi di idrogeno sono composti da un solo elettrone nel loro guscio, mentre l’atomo di ossigeno ha 6 elettroni di valenza.
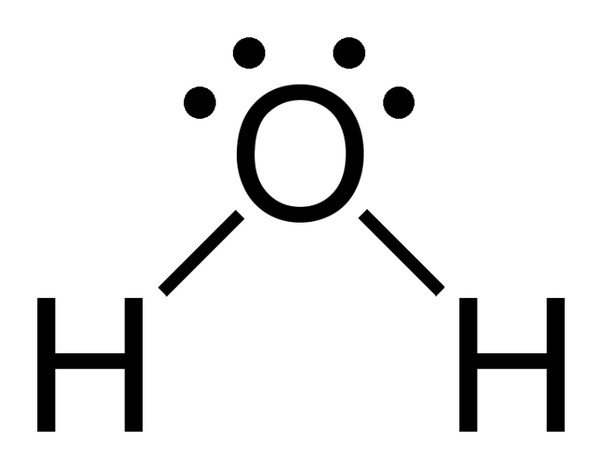
Nota le 2 coppie solitarie di elettroni sull’atomo di ossigeno in acqua.
Siccome l’ossigeno ha 6 elettroni nel suo guscio di valenza, condivide un elettrone con ogni atomo di idrogeno. In questo modo, rimane con 4 elettroni non legati nei suoi 2 orbitali. Queste coppie di elettroni legati e non legati si dispongono in forma tetraedrica intorno all’ossigeno, ed è per questo che i due legami sembrano avere una forma piegata.
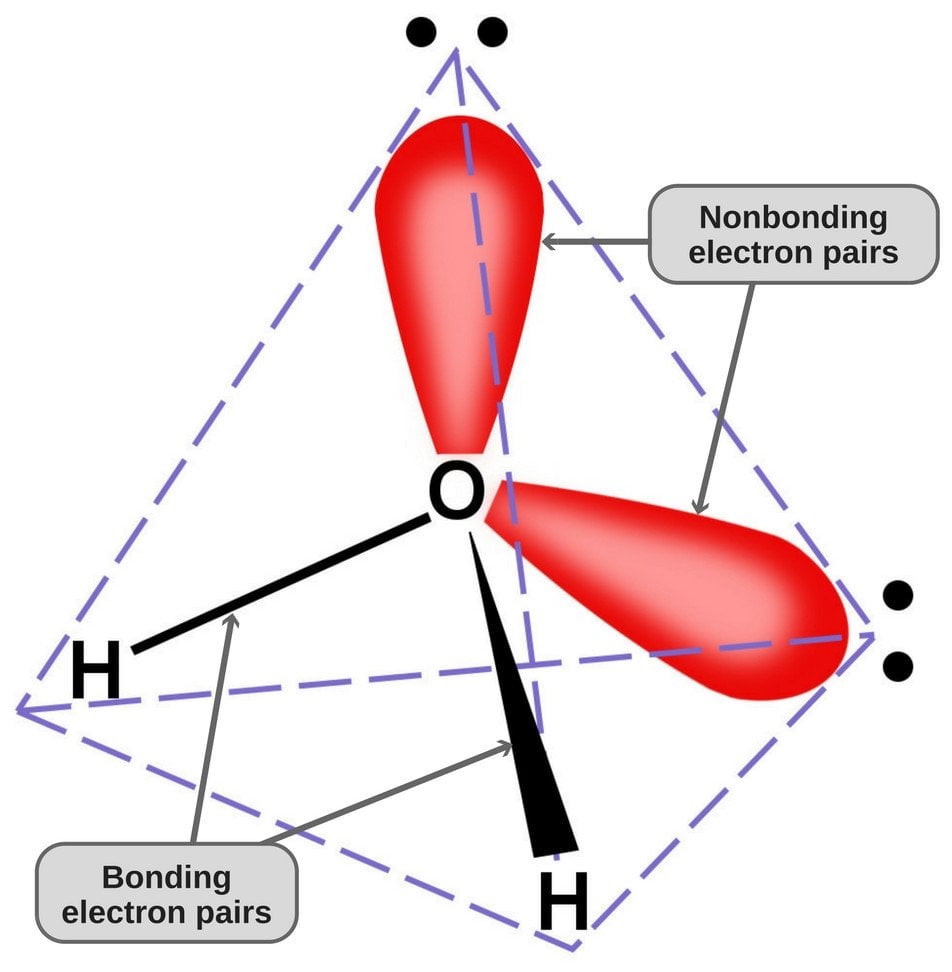
La geometria tetraedrica della molecola d’acqua.
Ora, entrambi gli atomi di ossigeno e idrogeno hanno elettronegatività diverse (il valore di elettronegatività dell’idrogeno è 2,1, mentre l’elettronegatività dell’ossigeno è 3,5); quindi, entrambi i legami sono polari. Poiché l’ossigeno è più elettronegativo dell’idrogeno, la densità di elettroni si sposta verso l’ossigeno in entrambi questi legami, rendendo così la regione intorno all’ossigeno più negativa delle aree intorno ai due atomi di idrogeno.
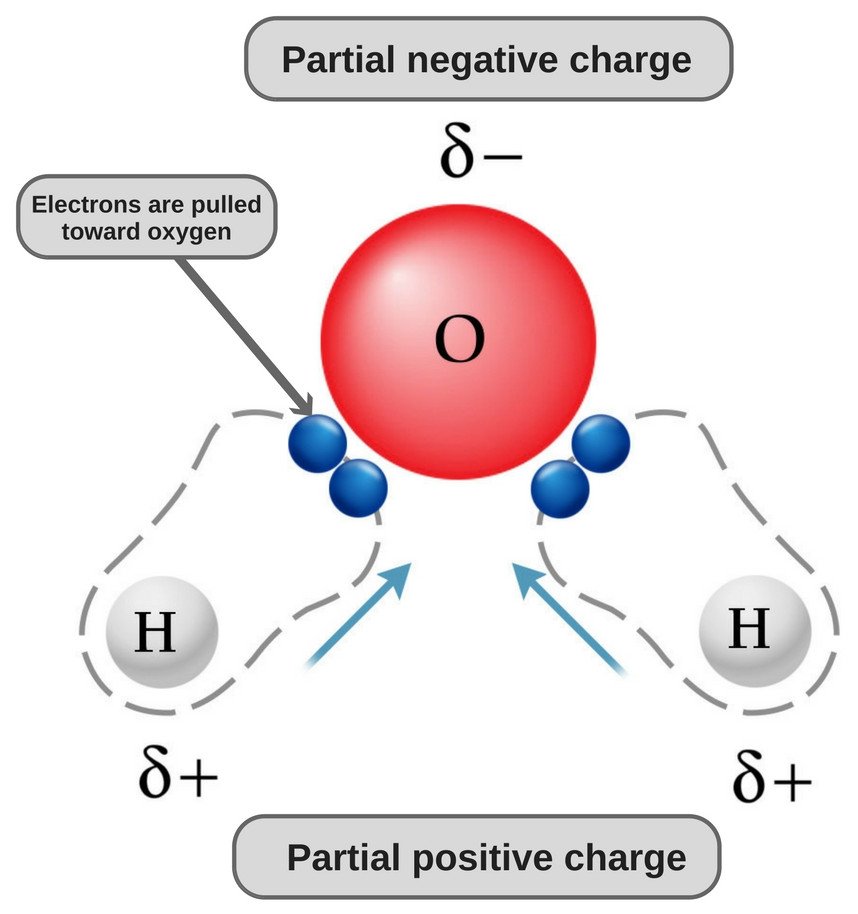
Ecco perché la molecola d’acqua diventa polare!