Valutazione | Biopsicologia | Comparativa |Cognitiva | Sviluppo | Linguaggio | Differenze individuali | Personalità | Filosofia | Sociale |
Metodi | Statistica |Clinica | Educativa | Industriale |Professionale articoli | Psicologia mondiale |
Biologico:Genetica del comportamento – Psicologia evolutiva – Neuroanatomia – Neurochimica – Neuroendocrinologia – Neuroscienze – Psiconeuroimmunologia – Psicologia fisiologica – Psicofarmacologia (Indice, Profilo)
| Cervello: Ipotalamo | ||
|---|---|---|
 |
||
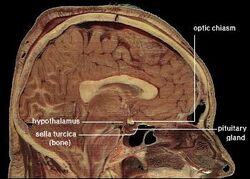
| Posizione dell’ipotalamo umano | ||
 |
||
| Dienchephalon | ||
| Latin | hypothalamus | |
| Gray’s | soggetto #189 812 | |
| Parte di | ||
| Componenti | ||
| Arteria | ||
| Vein | ||
| BrainInfo/UW | hier-358 | |
| MeSH | A08.186.211.730.385.357 | |
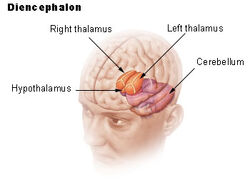
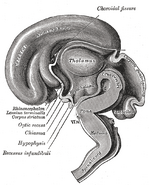
L’ipotalamo collega il sistema nervoso al sistema endocrino attraverso la ghiandola pituitaria (ipofisi). L’ipotalamo, (dal greco ὑποθαλαμος = sotto il talamo) è situato sotto il talamo, appena sopra il tronco cerebrale. Questa ghiandola occupa la maggior parte della regione ventrale del diencefalo. Si trova in tutti i cervelli dei mammiferi. Negli esseri umani, ha più o meno le dimensioni di una mandorla.
L’ipotalamo regola alcuni processi metabolici e altre attività del sistema nervoso autonomo. Sintetizza e secerne neuro-ormoni, spesso chiamati ormoni a rilascio ipotalamico, e questi a loro volta stimolano o inibiscono la secrezione di ormoni ipofisari.
L’ipotalamo controlla la temperatura del corpo, la fame, la sete, la fatica, la rabbia e i cicli circadiani.
- Ingressi
- Stimoli olfattivi
- Stimoli trasportati dal sangue
- Steroidi
- Input neurali
- Nuclei
- Uscite
- Proiezioni neurali
- Ormoni endocrini
- Controllo dell’assunzione di cibo
- Dimorfismo sessuale
- Risposte agli steroidi ovarici
- Steroidi gonadici nella vita neonatale dei ratti
- Androgeni nei primati
- Altre influenze sullo sviluppo ipotalamico
- Effetti dell’invecchiamento sull’ipotalamo
- Vedi anche
- Immagini aggiuntive
- Riferimenti & Bibliografia
- Documenti
- Materiale supplementare
- Documenti
Ingressi
L’ipotalamo è una regione molto complessa nel cervello degli esseri umani, e anche piccoli nuclei all’interno dell’ipotalamo sono coinvolti in molte funzioni diverse. Il nucleo paraventricolare per esempio contiene neuroni di ossitocina e vasopressina (chiamato anche ormone antidiuretico) che proiettano all’ipofisi posteriore, ma contiene anche neuroni che regolano la secrezione di ACTH e TSH (che proiettano all’ipofisi anteriore), riflessi gastrici, comportamento materno, pressione sanguigna, alimentazione, risposte immunitarie e temperatura.
L’ipotalamo coordina molti ritmi circadiani ormonali e comportamentali, modelli complessi di uscite neuroendocrine, complessi meccanismi omeostatici e molti comportamenti importanti. L’ipotalamo deve quindi rispondere a molti segnali diversi, alcuni dei quali sono generati esternamente e altri internamente. È quindi riccamente collegato con molte parti del SNC, tra cui la formazione reticolare del tronco cerebrale e le zone autonomiche, il proencefalo limbico (in particolare l’amigdala, il setto, la banda diagonale di Broca e i bulbi olfattivi, e la corteccia cerebrale).
L’ipotalamo risponde a:
- La luce: lunghezza del giorno e fotoperiodo per regolare i ritmi circadiani e stagionali
- Stimoli olfattivi, compresi i feromoni
- Steroidi, compresi gli steroidi gonadici e i corticosteroidi
- Informazioni trasmesse per via nasale, provenienti in particolare dal cuore, dallo stomaco, e dal tratto riproduttivo
- Input autonomici
- Stimoli ematici, tra cui leptina, grelina, angiotensina, insulina, ormoni ipofisari, citochine, concentrazioni plasmatiche di glucosio e osmolarità ecc
- Stress
- Microorganismi invasori aumentando la temperatura del corpo, resettando il termostato del corpo verso l’alto.
Stimoli olfattivi
Gli stimoli olfattivi sono importanti per la riproduzione e la funzione neuroendocrina in molte specie. Per esempio, se un topo gravido è esposto all’urina di un maschio “strano” durante un periodo critico dopo il coito, la gravidanza fallisce (effetto Bruce). Così, durante il coito, un topo femmina forma una precisa “memoria olfattiva” del suo partner che persiste per diversi giorni. Gli spunti feromonali aiutano la sincronizzazione dell’estro in molte specie; nelle donne, le mestruazioni sincronizzate possono anche derivare da spunti feromonali, sebbene il ruolo dei feromoni negli esseri umani sia messo in dubbio da alcuni.
Stimoli trasportati dal sangue
Gli ormoni peptidici hanno importanti influenze sull’ipotalamo, e per farlo devono superare la barriera emato-encefalica. L’ipotalamo è delimitato in parte da regioni cerebrali specializzate che mancano di un’efficace barriera emato-encefalica; l’endotelio capillare in questi siti è fenestrato per consentire il libero passaggio anche di grandi proteine e altre molecole. Alcuni di questi siti sono i siti di neurosecrezione – la neuroipofisi e l’eminenza mediana. Tuttavia altri sono siti in cui il cervello campiona la composizione del sangue. Due di questi siti, l’organo subfornico e l’OVLT (organum vasculosum della lamina terminalis) sono i cosiddetti organi circumventricolari, dove i neuroni sono in intimo contatto con il sangue e il CSF. Queste strutture sono densamente vascolarizzate e contengono neuroni osmorecettivi e sodio-ricettivi che controllano il bere, il rilascio di vasopressina, l’escrezione di sodio e l’appetito di sodio. Contengono anche neuroni con recettori per l’angiotensina, il fattore natriuretico atriale, l’endotelina e la relaxina, ognuno dei quali è importante nella regolazione dell’equilibrio di liquidi ed elettroliti. I neuroni dell’OVLT e dell’OFS proiettano al nucleo sopraottico e al nucleo paraventricolare, e anche alle aree ipotalamiche preottiche. Gli organi circumventricolari possono anche essere il sito d’azione delle interleuchine per suscitare sia la febbre che la secrezione di ACTH, attraverso effetti sui neuroni paraventricolari.
Non è chiaro come tutti i peptidi che influenzano l’attività ipotalamica ottengano l’accesso necessario. Nel caso della prolattina e della leptina, c’è la prova dell’assorbimento attivo nel plesso coroideo dal sangue al CSF. Alcuni ormoni ipofisari hanno un’influenza di retroazione negativa sulla secrezione ipotalamica; per esempio, l’ormone della crescita alimenta di nuovo l’ipotalamo, ma come entra nel cervello non è chiaro. Ci sono anche prove per azioni centrali di prolattina e TSH.
Steroidi
L’ipotalamo contiene neuroni che sono sensibili agli steroidi gonadici e glucocorticoidi – (gli ormoni steroidei della ghiandola surrenale, rilasciato in risposta a ACTH). Contiene anche neuroni specializzati sensibili al glucosio (nel nucleo arcuato e nell’ipotalamo ventromediale), che sono importanti per l’appetito. L’area preottica contiene neuroni termosensibili; questi sono importanti per la secrezione di TRH.
Input neurali
L’ipotalamo riceve molti input dal tronco encefalico; in particolare dal nucleo del tratto solitario, dal locus coeruleus e dal midollo ventrolaterale. La secrezione di ossitocina in risposta all’allattamento o alla stimolazione vagino-cervicale è mediata da alcune di queste vie; la secrezione di vasopressina in risposta a stimoli cardiovascolari provenienti da chemorecettori nel seno carotideo e nell’arco aortico, e da recettori di volume atriale a bassa pressione, è mediata da altri. Nel ratto, la stimolazione della vagina provoca anche la secrezione di prolattina, e questo provoca una pseudo-gravidanza dopo un accoppiamento sterile. Nel coniglio, il coito provoca un’ovulazione riflessa. Nella pecora, la stimolazione cervicale in presenza di alti livelli di estrogeni può indurre un comportamento materno in una pecora vergine. Questi effetti sono tutti mediati dall’ipotalamo, e l’informazione è trasportata principalmente dalle vie spinali che fanno da relè nel tronco encefalico. La stimolazione dei capezzoli stimola il rilascio di ossitocina e prolattina e sopprime il rilascio di LH e FSH.
Gli stimoli cardiovascolari sono trasportati dal nervo vago, ma il vago trasmette anche una varietà di informazioni viscerali, compresi per esempio i segnali derivanti dalla distensione gastrica per sopprimere l’alimentazione. Anche queste informazioni raggiungono l’ipotalamo tramite relè nel tronco encefalico.
Nuclei
I nuclei ipotalamici comprendono i seguenti:
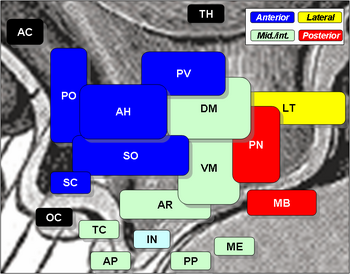
Nuclei ipotalamici
| Regione | Area | Nucleo | Funzione |
| Anteriore | Mediale | Nucleo preottico mediale |
|
| Nucleo sopraottico (SO) |
|
||
| Nucleo paraventricolare (PV) |
|
||
| Nucleo ipotalamico anteriore (AH) |
|
||
| Nucleo soprachiasmatico (SC) |
|
||
| Nucleo preottico laterale | Laterale | ||
| Nucleo laterale (LT) |
|
||
| Parte del nucleo sopraottico (SO) |
|
||
| Tuberale | Mediale | Nucleo ipotalamico dorsomediale (DM) |
|
| Nucleo ventromediale (VM) |
|
||
Nucleo arcuato (AR)
|
|||
| Laterale | Nucleo laterale (LT) |
|
|
| Nuclei tuberali laterali | |||
| Posteriore | Mediale | Nuclei mammillari (parte dei corpi mammillari) (MB) |
|
| Nucleo posteriore (PN) |
|
||
| Laterale | nucleo laterale (LT) |
Vedi anche: nucleo preottico ventrolaterale
Uscite
Le uscite dell’ipotalamo possono essere divise in due categorie: proiezioni neurali, e ormoni endocrini.
Proiezioni neurali
La maggior parte dei sistemi di fibre dell’ipotalamo corrono in due direzioni (bidirezionali).
- Le proiezioni alle aree caudali dell’ipotalamo passano attraverso il fascio mediale del prosencefalo, il tratto mammillotegmentale e il fascicolo longitudinale dorsale.
- Le proiezioni alle aree rostrali all’ipotalamo sono trasportate dal tratto mammillotalamico, dal fornice e dalla stria terminale.
Ormoni endocrini
L’ipotalamo influenza il sistema endocrino e regola il comportamento emotivo, come la rabbia e l’attività sessuale. La maggior parte degli ormoni ipotalamici generati sono distribuiti all’ipofisi attraverso il sistema portale ipofisario. L’ipotalamo mantiene l’omeostasi che include una regolazione della pressione sanguigna, della frequenza cardiaca e della temperatura.
I principali ormoni ipotalamici sono:
| Nome | Altri nomi | Abbreviazioni | Localizzazione | Funzione |
|---|---|---|---|---|
| Ormone di rilascio della corticotropina | Fattore di rilascio della corticoliberina | CRH, CRF | neuroni neuroendocrini parvocellulari nel nucleo paraventricolare | con la vasopressina, stimola l’ipofisi anteriore a secernere ACTH |
| Dopamina | Ormone inibitore della prolattina | DA, PIH | neuroni neuroendocrini del nucleo arcuato | inibisce la secrezione di prolattina dall’ipofisi anteriore |
| Ormone di rilascio delle gonadotropine | Ormone di rilascio degli ormoni luteinizzanti | GnRH, LHRH | neuroni neuroendocrini nei nuclei preottico mediale e arcuato | stimola l’ipofisi anteriore a secernere LH e FSH |
| Ormone di rilascio degli ormoni della crescita | Fattore di rilascio degli ormoni della crescita, somatocrinina | GHRH, GHRF, GRF | neuroni neuroendocrini del nucleo arcuato | stimola l’ipofisi anteriore a secernere l’ormone della crescita |
| Melatonina | Nucleo soprachiasmatico | |||
| Somatostatina | Ormone della crescita-ormone inibitore, Fattore inibitore del rilascio di somatotropina | SS, GHIH, SRIF | neuroni neuroendocrini del nucleo periventricolare | inibisce la secrezione dell’ormone della crescita dall’ipofisi anteriore |
| Ormone di rilascio della tirotropina | Fattore di rilascio della tirotropina, Thyroliberin, Protirelin | TRH, TRF | neuroni neuroendocrini parvocellulari nei nuclei ipotalamici paraventricolari e anteriori | stimola l’ipofisi anteriore a secernere TSH |
Vedi anche: Ipocretina
Controllo dell’assunzione di cibo
La parte laterale estrema del nucleo ventromediale dell’ipotalamo è responsabile del controllo dell’assunzione di cibo. La stimolazione di quest’area causa un aumento dell’assunzione di cibo. La lesione bilaterale di quest’area causa la completa cessazione dell’assunzione di cibo. Le parti mediali del nucleo hanno un effetto di controllo sulla parte laterale. La lesione bilaterale della parte mediale del nucleo ventromediale causa iperfagia e obesità dell’animale. Un’ulteriore lesione della parte laterale del nucleo ventromediale nello stesso animale produce la completa cessazione dell’assunzione di cibo.
Ci sono diverse ipotesi relative a questa regolazione:
- Ipotesi lipostatica – questa ipotesi sostiene che il tessuto adiposo produce un segnale umorale che è proporzionato alla quantità di grasso e agisce sull’ipotalamo per diminuire l’assunzione di cibo e aumentare la produzione energetica. È stato dimostrato che l’ormone leptina agisce sull’ipotalamo per diminuire l’assunzione di cibo e aumentare la produzione di energia.
- Ipotesi dei gastropeptidi – gli ormoni gastrointestinali come Grp, glucagoni, CCK e altri sostengono di inibire l’assunzione di cibo. Il cibo che entra nel tratto gastrointestinale innesca il rilascio di questi ormoni che agiscono sul cervello per produrre sazietà. Il cervello contiene sia recettori CCK-A che CCK-B.
- Ipotesi glucostatica – l’attività del centro della sazietà nei nuclei ventromediali è probabilmente regolata dall’utilizzazione del glucosio nei neuroni. È stato postulato che quando il loro utilizzo del glucosio è basso e di conseguenza quando la differenza di glucosio arterovenosa sangue attraverso di loro è basso, l’attività attraverso i neuroni diminuire. In queste condizioni, l’attività del centro di alimentazione è incontrollata e l’individuo si sente affamato. L’assunzione di cibo è rapidamente aumentata dalla somministrazione intraventricolare di 2-deossiglucosio, diminuendo così l’utilizzo del glucosio nelle cellule.
- Ipotesi termostatica – secondo questa ipotesi, una diminuzione della temperatura corporea al di sotto di un determinato set point stimola l’appetito, mentre un aumento sopra il set point inibisce l’appetito.
Dimorfismo sessuale
Diversi nuclei ipotalamici sono sessualmente dimorfici, cioè ci sono chiare differenze sia nella struttura che nella funzione tra maschi e femmine.
Alcune differenze sono evidenti anche nella neuroanatomia grossolana: la più notevole è il nucleo sessualmente dimorfo nell’area preottica, che è presente solo nei maschi. Tuttavia la maggior parte delle differenze sono sottili cambiamenti nella connettività e nella sensibilità chimica di particolari gruppi di neuroni.
L’importanza di questi cambiamenti può essere riconosciuta dalle differenze funzionali tra maschi e femmine. Per esempio, il modello di secrezione dell’ormone della crescita è sessualmente dimorfo, e questo è uno dei motivi per cui in molte specie, i maschi adulti sono molto più grandi delle femmine.
Risposte agli steroidi ovarici
Altri dimorfismi funzionali sorprendenti sono nelle risposte comportamentali agli steroidi ovarici dell’adulto. Maschi e femmine rispondono in modo diverso agli steroidi ovarici, in parte perché l’espressione dei neuroni sensibili agli estrogeni nell’ipotalamo è sessualmente dimorfica, cioè i recettori degli estrogeni sono espressi in diversi gruppi di neuroni.
Estrogeni e progesterone possono influenzare l’espressione genica in particolari neuroni o indurre cambiamenti nel potenziale di membrana cellulare e l’attivazione delle chinasi, portando a diverse funzioni cellulari non genomiche. Gli estrogeni e il progesterone si legano ai loro recettori ormonali nucleari cognati, che si spostano nel nucleo della cellula e interagiscono con regioni del DNA note come elementi di risposta ormonale (HRE) o si legano al sito di legame di un altro fattore di trascrizione. È stato dimostrato che il recettore degli estrogeni (ER) transattiva altri fattori di trascrizione in questo modo, nonostante l’assenza di un elemento di risposta estrogenica (ERE) nella regione prossimale del promotore del gene. Gli ER e i recettori del progesterone (PR) sono generalmente attivatori genici, con un aumento dell’mRNA e della successiva sintesi proteica in seguito all’esposizione agli ormoni.
Il cervello maschile e quello femminile differiscono nella distribuzione dei recettori degli estrogeni, e questa differenza è una conseguenza irreversibile dell’esposizione neonatale agli steroidi. I recettori degli estrogeni (e quelli del progesterone) si trovano principalmente nei neuroni dell’ipotalamo anteriore e mediobasale, in particolare:
- l’area preottica (dove si trovano i neuroni LHRH)
- il nucleo periventricolare (dove si trovano i neuroni della somatostatina)
- l’ipotalamo ventromediale (che è importante per il comportamento sessuale).
Steroidi gonadici nella vita neonatale dei ratti
Nella vita neonatale, gli steroidi gonadici influenzano lo sviluppo dell’ipotalamo neuroendocrino. Per esempio, determinano la capacità delle femmine di esibire un normale ciclo riproduttivo, e dei maschi e delle femmine di mostrare comportamenti riproduttivi appropriati nella vita adulta.
- Se un ratto femmina viene iniettato una volta con testosterone nei primi giorni di vita postnatale (durante il “periodo critico” di influenza degli steroidi sessuali), l’ipotalamo è irreversibilmente mascolinizzato; il ratto adulto sarà incapace di generare un aumento di LH in risposta agli estrogeni (una caratteristica delle femmine), ma sarà capace di esibire comportamenti sessuali maschili (montare una femmina sessualmente ricettiva).
- Al contrario, un ratto maschio castrato subito dopo la nascita sarà femminilizzato, e l’adulto mostrerà comportamenti sessuali femminili in risposta agli estrogeni (ricettività sessuale, lordosi}.
Androgeni nei primati
Nei primati, l’influenza dello sviluppo degli androgeni è meno chiara, e le conseguenze sono meno complete. Il ‘mascolinismo’ nelle ragazze potrebbe riflettere gli effetti degli androgeni sul cervello fetale, ma il sesso di allevamento durante i primi 2-3 anni è ritenuto da molti il più importante determinante dell’identità di genere, perché durante questa fase sia gli estrogeni che il testosterone avranno effetti permanenti su un cervello femminile o maschile, influenzando sia l’eterosessualità che l’omosessualità.
Il paradosso è che gli effetti mascolinizzanti del testosterone sono mediati dagli estrogeni. All’interno del cervello, il testosterone è aromatizzato in (estradiolo), che è il principale ormone attivo per le influenze sullo sviluppo. Il testicolo umano secerne alti livelli di testosterone da circa la settimana 8 della vita fetale fino a 5-6 mesi dopo la nascita (un simile aumento perinatale di testosterone è osservato in molte specie), un processo che sembra essere alla base del fenotipo maschile. Gli estrogeni dalla circolazione materna sono relativamente inefficaci, in parte a causa degli alti livelli circolanti di proteine leganti gli steroidi in gravidanza.
Altre influenze sullo sviluppo ipotalamico
Gli steroidi sessuali non sono le uniche influenze importanti sullo sviluppo ipotalamico; in particolare, lo stress pre-puberale nella prima vita determina la capacità dell’ipotalamo adulto di rispondere a un fattore di stress acuto. A differenza dei recettori degli steroidi gonadici, i recettori dei glucocorticoidi sono molto diffusi in tutto il cervello; nel nucleo paraventricolare, essi mediano il controllo di feedback negativo della sintesi e della secrezione di CRF, ma altrove il loro ruolo non è ben compreso.
Effetti dell’invecchiamento sull’ipotalamo
Studi su topi femmina hanno dimostrato che sia il nucleo sopraottico (SON) che il nucleo paraventricolare (PVN) perdono circa un terzo delle cellule immunoreattive IGF-1R con il normale invecchiamento. Inoltre, i vecchi topi a restrizione calorica (CR) hanno perso un numero maggiore di cellule non immunoreattive IGF-1R, pur mantenendo un numero simile di cellule immunoreattive IGF-1R rispetto ai topi Old-Al. Di conseguenza, i topi Old-CR mostrano una maggiore percentuale di cellule immunoreattive IGF-1R che riflettono una maggiore sensibilità ipotalamica a IGF-1 rispetto ai topi che invecchiano normalmente.
Vedi anche
- Asse HPA
- Sistema ipotalamo-ipofisario
- Sistema ipotalamo-ipofisi-surrene
- Lesioni dell’ipotalamo
- Fascio mediano del proencefalo
- Neuroendocrinologia
- Area preottica
Immagini aggiuntive
Aggiungi una foto a questa galleria
- http://www.cancer.gov/Templates/db_alpha.aspx?CdrID=46359
- http://www.sci.uidaho.edu/med532/hypothal.htm
- Diagramma dei nuclei (psycheducation.org)
- Diagramma dei nuclei (universe-review.ca)
- Diagramma dei nuclei (utdallas.edu)
- Se non diversamente specificato nella tabella, il riferimento è: Guyton Eight Edition
- Walter F., PhD. Boro. Fisiologia medica: A Cellular And Molecular Approaoch, Elsevier/Saunders. Pagina 840
- http://thalamus.wustl.edu/course/hypoANS.html
- http://www.vivo.colostate.edu/hbooks/pathphys/endocrine/hypopit/overview.html
- Theologides A (1976). Metaboliti intermedi che producono anoressia. Am J Clin Nutr 29 (5): 552-8.
- John Money, “Il concetto di disturbo dell’identità di genere nell’infanzia e nell’adolescenza dopo 39 anni”, Journal of Sex and Marital Therapy 20 (1994): 163-77.
- Romeo, Russell D, Rudy Bellani, Ilia N. Karatsoreos, Nara Chhua, Mary Vernov, Cheryl D. Conrad e Bruce S. McEwen (2005). Storia dello stress e lo sviluppo puberale interagiscono per modellare la plasticità dell’asse ipotalamo-ipofisi-surrene. Endocrinologia 147 (4): 1664-1674.
- Saeed O, Yaghmaie F, Garan SA, Gouw AM, Voelker MA, Sternberg H, Timiras PS. (2007). Insulin-like growth factor-1 cellule immunoreattive recettore sono selettivamente mantenuto nel ipotalamo paraventricolare di topi caloricamente ristretto. Int J Dev Neurosci 25 (1): 23-8.
- Yaghmaie F, Saeed O, Garan SA, Voelker MA, Gouw AM, Freitag W, Sternberg H, Timiras PS (2006). La perdita dipendente dall’età delle cellule immunoreattive del recettore del fattore di crescita insulino-simile-1 nell’ipotalamo sopraottico è ridotta nei topi caloricamente ristretti. Int J Dev Neurosci 24 (7): 431-6.
- F. Yaghmaie, O. Saeed, S.A. Garan, A.M. Gouw, P. Jafar, J. Kaur, S. Nijjar, P.S. Timiras, H. Sternberg, M.A. Voelker (2007). Monitoraggio dei cambiamenti nella sensibilità ipotalamica IGF-1 con l’invecchiamento e la restrizione calorica. Gerontologia sperimentale 42 (1-2): 148-149.
Riferimenti & Bibliografia
Documenti
- Arees, E.A. e Mayer, B, (1967) Connessioni anatomiche tra regioni mediali e laterali dell’ipotalamo interessati con l’assunzione di cibo, Scienza 157: 1574-5
- Grossman, S.P. (1960) Mangiare o bere elicitato dalla stimolazione diretta adrenergica o colinergica dell’ipotalamo, Scienza 132: 301-2.
- Hetherington, A.W. e Ranson, S.W. (1942) La relazione di varie lesioni ipotalamiche all’adiposità nel ratto, 76: 475-99.
Materiale supplementare
Documenti
- Google Scholar
- BrainMaps at UCDavis Hypothalamus
- Sistema endocrino e ipotalamo
- High-Resolution Cytoarchitectural Primate Brain Atlases
- L’ipotalamo e ipofisi a endotexts.org
- Diagramma dei nuclei (psycheducation.org)
- Diagramma dei nuclei (universe-review.ca)
- Diagramma dei nuclei (utdallas.edu)
|
v-d-e
Cervello umano: diencefalo (TA A14.1.08, GA 9.807) |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Epithalamus |
|
Superficie
|
||||||||||||||
| Talamo |
|
Superficie
|
Materia grigia/
nuclei |
|||||||||||||
| Ipotalamo |
|
|||||||||||||||
| Subtalamo |
Nucleo subtalamico – Zona incerta |
|||||||||||||||
| Sistema ventricolare: Terzo ventricolo |
recessi: (Recesso ottico, Recesso infundibolare, Recesso sovrapineale, Recesso pineale) Solco ipotalamico – Tela corioidea del terzo ventricolo Organo subfornico Aperture: Interventricolare/Monro Commissura posteriore |
|||||||||||||||
|
v-d-e
Anatomia umana, sistema endocrino: ghiandole endocrine |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Assi ipotalamico/ ipofisario |
|
|
|
|
||||||||||||
| Ghiandola pineale |
Pinealocita – Corpora arenacea |
|||||||||||||||
| Isole del pancreas |
Cellula alfa – Cellula beta – Cellula delta – Cellula PP – Cellula epsilon |
|||||||||||||||
Cervello umano: Sistema limbico
Amigdala – Giro cingolato – Giro fornicato – Ippocampo – Ipotalamo – Corpo mammillare – Nucleo accumbens – Corteccia orbitofrontale – Giro paraippocampale