Definizione del problema
L’iperparatiroidismo primario è la sovrapproduzione non regolata dell’ormone paratiroideo (PTH) con conseguente omeostasi anormale del calcio.
Frequenza
L’iperparatiroidismo primario è più comune nelle donne, l’incidenza è di 66 per 100.000 anni-persona nelle femmine e di 25 per 100.000 anni-persona nei maschi. In un grande studio di 3,5 milioni di iscritti a Kaiser Permanente della California meridionale, l’incidenza ha fluttuato nel tempo ma non è stata vista diminuire sostanzialmente. Al contrario, la prevalenza dell’iperparatiroidismo primario ha visto un aumento sostanziale in questa popolazione. L’età media alla diagnosi è rimasta tra 52 e 56 anni.
Eziologia
In circa l’85% dei casi, l’iperparatiroidismo primario è causato da un singolo adenoma. Nel 15% dei casi, sono coinvolte più ghiandole (cioè, o adenomi multipli o iperplasia). Raramente, l’iperparatiroidismo primario è causato da un carcinoma paratiroideo. L’eziologia degli adenomi o dell’iperplasia rimane sconosciuta nella maggior parte dei casi. I casi familiari possono verificarsi come parte delle sindromi da neoplasia endocrina multipla (MEN 1 o MEN 2a), della sindrome da tumore iperparatiroideo (HPT-JT) o dell’iperparatiroidismo familiare isolato (FIHPT). Anche l’ipercalcemia ipocalciurica familiare e l’iperparatiroidismo grave neonatale appartengono a questa categoria. La base genetica molecolare della MEN 1 è una mutazione inattivante del gene MEN1, situato sulla banda cromosomica 11q13. La MEN 2a è causata da una mutazione germinale del proto-oncogene Ret sul cromosoma 10. La mutazione germinale di HRPT2 localizzata sul braccio 1q del cromosoma è responsabile di HPT-JT, mentre FIHPT è geneticamente eterogeneo.
Patofisiologia
Nell’iperparatiroidismo primario dovuto ad adenomi, il normale feedback sulla produzione di ormone paratiroideo da parte del calcio extracellulare sembra essere perso, con conseguente cambiamento del set point. Tuttavia, questo non è il caso dell’iperparatiroidismo primario da iperplasia paratiroidea. Un aumento del numero di cellule è probabilmente la causa.
L’eccessivo riassorbimento cronico di calcio dall’osso causato da un eccesso di ormone paratiroideo può provocare osteopenia. In casi gravi, questo può risultare in osteite fibrosa cistica, che è caratterizzata da un riassorbimento subperiosteo delle falangi distali, assottigliamento delle clavicole distali, aspetto sale e pepe del cranio, e tumori marroni delle ossa lunghe. Questo non è comunemente visto ora. Inoltre, l’escrezione cronicamente aumentata di calcio nelle urine può predisporre alla formazione di calcoli renali.
Gli altri sintomi dell’iperparatiroidismo sono dovuti all’ipercalcemia stessa e non sono specifici dell’iperparatiroidismo. Questi possono includere debolezza muscolare, affaticamento, esaurimento dei volumi, nausea e vomito e, nei casi gravi, coma e morte. Le manifestazioni neuropsichiatriche sono particolarmente comuni e possono includere depressione, confusione o deficit sottili che spesso sono caratterizzati male e possono non essere notati dal paziente (o possono essere attribuiti all’invecchiamento). L’aumento del calcio può aumentare la secrezione di acido gastrico, e le persone con iperparatiroidismo possono avere una maggiore prevalenza di malattia dell’ulcera peptica. Rari casi di pancreatite sono stati anche attribuiti all’ipercalcemia.
Uno studio prospettico di coorte di Ejlsmark-Svensson et al ha riportato che nei pazienti con iperparatiroidismo primario, i punteggi del questionario sulla qualità della vita erano significativamente più bassi in associazione con ipercalcemia moderata-grave che in relazione a ipercalcemia lieve. Tuttavia, la qualità della vita non sembrava essere correlata alla presenza di manifestazioni d’organo dell’iperparatiroidismo primario, come l’osteoporosi, le calcificazioni renali e la compromissione della funzione renale. Questo suggerisce che l’ipercalcemia è il motore principale di una ridotta qualità di vita.
Presentazione clinica
Storia
La sindrome clinica dell’iperparatiroidismo primario può essere facilmente ricordata come “ossa, pietre, gemiti addominali e gemiti psichici”. Con l’introduzione della misurazione di routine del calcio nel sangue nei primi anni ’70, la presentazione clinica più comune dell’iperparatiroidismo primario è cambiata da una grave malattia ossea o calcoli renali all’ipercalcemia asintomatica.
Le manifestazioni scheletriche dell’iperparatiroidismo primario includono principalmente una perdita selettiva dell’osso corticale. Sono stati riportati anche dolore osseo e articolare, pseudogotta e condrocalcinosi. Nelle prime descrizioni cliniche dell’iperparatiroidismo primario, alcuni pazienti hanno sviluppato un tipo particolare di malattia ossea nota come osteite fibrosa cistica, caratterizzata da un aumento del riassorbimento osseo osteoclastico generalizzato. I cambiamenti radiografici del film piano associati con l’osteite fibrosa cistica includono il riassorbimento subperiostale nelle falangi e un ritrovamento noto come cranio sale e pepe. Questa presentazione è raramente vista oggi, tranne che in popolazioni poco servite dal punto di vista medico.
Le manifestazioni renali includono poliuria, calcoli renali, ipercalciuria e raramente nefrocalcinosi.
Le manifestazioni gastrointestinali includono vago dolore addominale, anoressia, nausea, vomito, stipsi, ulcera peptica e pancreatite acuta.
Le manifestazioni neuromuscolari e psicologiche includono affaticamento, debolezza muscolare, depressione, incapacità di concentrarsi e problemi di memoria o deficit sottili che spesso sono caratterizzati male e possono non essere notati dal paziente, una descrizione comune è la “nebbia del cervello”. Questi sintomi sono spesso attribuiti all’invecchiamento e ad alcuni pazienti viene diagnosticata la sindrome da fatica cronica o la fibromialgia.
Le manifestazioni cardiovascolari includono ipertensione, bradicardia, intervallo QT ridotto e ipertrofia ventricolare sinistra.
Fisico
I risultati dell’esame fisico sono solitamente non contribuenti. L’esame può rivelare debolezza muscolare e depressione. Una massa palpabile sul collo non è solitamente attesa con l’iperparatiroidismo, anche se in rari casi può indicare un cancro paratiroideo. Un nodulo tiroideo precedentemente non diagnosticato è molto più comunemente la fonte di un nodulo palpabile.
Considerazioni diagnostiche
Le cause di ipercalcemia che risultano in un livello di ormone paratiroideo concomitantemente elevato sono poche. Queste includono l’ipercalcemia familiare benigna (ipocalciurica) (FHH) (vedi Disturbi correlati), l’ipercalcemia indotta dal litio e l’iperparatiroidismo terziario. Una minoranza di pazienti (cioè il 10-15%) con iperparatiroidismo ha livelli di ormone paratiroideo che rientrano nel range di riferimento ma sono inappropriatamente alti in presenza di elevate concentrazioni di calcio nel siero. Un sottogruppo di pazienti ha livelli di calcio normali con ormone paratiroideo elevato, il cosiddetto iperparatiroidismo normocalcemico. Tuttavia, quando si considera questa diagnosi, devono essere escluse tutte le potenziali cause di iperparatiroidismo secondario (per esempio, bassa assunzione di calcio, disturbi gastrointestinali, insufficienza renale, carenza di vitamina D, ipercalciuria di origine renale). I pazienti con livelli di calcio normali e livelli elevati di ormone paratiroideo in assenza di una causa secondaria identificabile devono essere monitorati per la progressione verso l’ipercalcemia.
L’iperparatiroidismo secondario e terziario sono tipicamente diagnosticati in base al loro contesto clinico. L’ipercalcemia indotta dal cancro è associata ad un basso livello di ormone paratiroideo ma possibilmente ad un alto livello di peptide legato all’ormone paratiroideo.
Workup
Studi di laboratorio
Il calcio sierico totale e i livelli di albumina o di calcio ionizzato devono essere misurati. L’ipercalcemia deve essere documentata in più di un’occasione prima di intraprendere un workup diagnostico.
Il test del livello intatto dell’ormone paratiroideo è il nucleo della diagnosi. Un livello elevato di ormone paratiroideo intatto con un livello elevato di calcio sierico ionizzato è diagnostico di iperparatiroidismo primario. Una misurazione del calcio nelle 24 ore nelle urine è necessaria per escludere il FHH.
I vecchi test misuravano i frammenti della molecola dell’ormone paratiroideo, come la regione C-terminale o media dell’ormone paratiroideo. Questi test di prima generazione sono considerati obsoleti per la pratica clinica. I saggi dell’ormone paratiroideo di seconda generazione, chiamati globalmente saggi dell’ormone paratiroideo “intatto”, e i saggi dell’ormone paratiroideo di terza generazione chiamati saggi dell’ormone paratiroideo “intero” o “biointact” utilizzano due diversi anticorpi contro due diversi segmenti dell’ormone paratiroideo. I dosaggi dell’ormone paratiroideo di seconda e terza generazione stanno producendo dati molto più soddisfacenti dal punto di vista clinico rispetto ai dosaggi di prima generazione, ma hanno alcune limitazioni che continuano ad essere valutate in diversi studi.
Altri risultati di laboratorio nell’iperparatiroidismo primario includono lieve acidosi ipercloremica, ipofosfatemia e aumento da lieve a moderato del tasso di escrezione urinaria del calcio.
I livelli di vitamina D dovrebbero essere misurati nella valutazione dell’iperparatiroidismo primario. La carenza di vitamina D (un livello di 25-idrossivitamina D inferiore a 20 ng per millilitro) può causare iperparatiroidismo secondario, e la reintegrazione della carenza di vitamina D può contribuire a ridurre i livelli di ormone paratiroideo. Nella maggior parte degli studi, l’aumento delle scorte sieriche di 25-idrossivitamina D ad almeno 37,5 ng per millilitro è sufficiente per la soppressione dell’ormone paratiroideo e la prevenzione dell’iperparatiroidismo secondario nelle persone con funzione renale normale (anche se alcuni studi hanno suggerito di aumentare le scorte a 50 ng per millilitro).
Studi di imaging
Gli studi di imaging non sono utilizzati per fare la diagnosi di iperparatiroidismo primario (che si basa su dati di laboratorio) o per decidere se perseguire la terapia chirurgica (che si basa su criteri clinici). Gli studi di imaging sono utilizzati per guidare il chirurgo una volta decisa la terapia chirurgica. Se si deve tentare un’esplorazione paratiroidea limitata, è necessario uno studio di localizzazione. Altri usi degli studi di imaging nella valutazione iniziale di un paziente con iperparatiroidismo primario sono controversi (vedi Scelta del trattamento chirurgico, sotto).
Per molti pazienti, la raccomandazione rimane per l’esplorazione completa della paratiroide con resezione di tutte le ghiandole coinvolte. Molti chirurghi concordano sul fatto che gli studi di imaging non sono necessari quando si sceglie questo trattamento chirurgico. Tuttavia, nei pazienti che hanno iperparatiroidismo ricorrente o persistente dopo una precedente esplorazione chirurgica, un test di imaging per localizzare le ghiandole coinvolte è sicuramente indicato.
L’ultrasonografia del collo è una tecnica sicura e ampiamente utilizzata per la localizzazione delle ghiandole paratiroidi anormali. È capace di un alto grado di accuratezza, ma dipende dall’operatore e la sua accuratezza riportata è molto variabile nella letteratura. Un vantaggio dell’ecografia del collo è che può essere eseguita rapidamente dal medico al momento della valutazione iniziale. Gli studi sull’ecografia eseguita dal medico mostrano tassi di accuratezza che si confrontano favorevolmente con l’accuratezza dei tradizionali reparti di radiologia, in prossimità del 75-80%. L’ecografia, come la scansione della medicina nucleare, non è stata affidabile nel rilevare la malattia multigland.
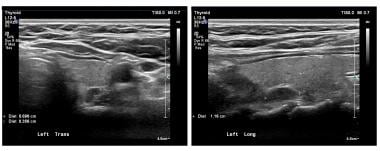 I pannelli mostrano una vista trasversale e longitudinale (sagittale) di un adenoma paratiroideo superiore sinistro su ultrasonografia. I segni del calibro designano l’adenoma. Gli adenomi sono tipicamente omogenei e ipoecogeni.
I pannelli mostrano una vista trasversale e longitudinale (sagittale) di un adenoma paratiroideo superiore sinistro su ultrasonografia. I segni del calibro designano l’adenoma. Gli adenomi sono tipicamente omogenei e ipoecogeni. La scansione di medicina nucleare con sestamibi radiomarcati è anche una tecnica ampiamente utilizzata. Il sestamibi è comunemente usato nell’imaging cardiaco ed è stato trovato serendipitosamente ad accumularsi negli adenomi paratiroidei. Questo radionuclide è concentrato nel tessuto tiroideo e paratiroideo, ma di solito viene lavato via dal tessuto tiroideo normale in meno di un’ora. Persiste nel tessuto paratiroideo anormale. Vedere l’immagine qui sotto.
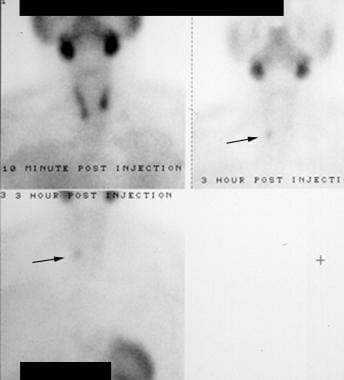 Iperparatiroidismo. Scansione con radionuclide Technetium-99m (99mTc) sestamibi. L’immagine iniziale (in alto a sinistra) mostra l’assorbimento nelle ghiandole salivari e nella tiroide. Le immagini successive (a destra e in basso) mostrano il washout dalla tiroide ma la persistenza nella regione del lobo tiroideo inferiore destro (frecce). Questo si è rivelato essere un adenoma paratiroideo destro.
Iperparatiroidismo. Scansione con radionuclide Technetium-99m (99mTc) sestamibi. L’immagine iniziale (in alto a sinistra) mostra l’assorbimento nelle ghiandole salivari e nella tiroide. Le immagini successive (a destra e in basso) mostrano il washout dalla tiroide ma la persistenza nella regione del lobo tiroideo inferiore destro (frecce). Questo si è rivelato essere un adenoma paratiroideo destro. Sulle immagini ritardate, una paratiroide anormale è vista come un focus persistente di attività. La sensibilità della scansione per l’individuazione di adenomi solitari è molto variabile in letteratura, ma generalmente è riportata come 60-90%. La principale debolezza di questo test è nella diagnosi della malattia multiglandolare. In questo caso, la sensibilità scende a circa il 50%. La maggior parte delle moderne scansioni con sestamibi vengono eseguite con la tomografia computerizzata a fotone singolo (SPECT). Questa tecnica (vedi l’immagine qui sotto) combina la rilevazione della radioattività con l’imaging dettagliato della scansione CT, permettendo una migliore sensibilità e una localizzazione anatomica più precisa rispetto all’imaging planare standard (come mostrato sopra).
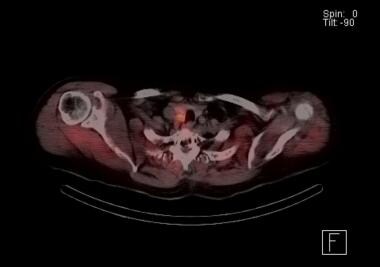 scansione paratiroidea Sestamibi con scansione SPECT. L’arancione indica l’accumulo di radionuclidi. I risultati indicano la presenza di un adenoma paratiroideo sul lato destro appena dietro il lobo tiroideo. All’esplorazione, questo paziente è stato trovato con doppio adenoma adiacente a destra.
scansione paratiroidea Sestamibi con scansione SPECT. L’arancione indica l’accumulo di radionuclidi. I risultati indicano la presenza di un adenoma paratiroideo sul lato destro appena dietro il lobo tiroideo. All’esplorazione, questo paziente è stato trovato con doppio adenoma adiacente a destra. Un grande vantaggio della scansione paratiroidea sestamibi è la capacità di rilevare le ghiandole paratiroidi ectopiche, in particolare nel mediastino.
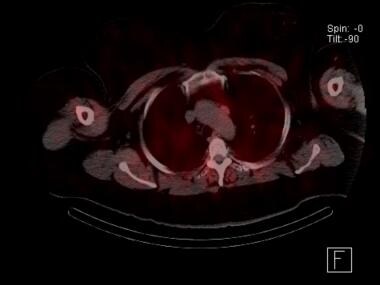 Scansione paratiroidea Sestamibi con scansione SPECT che mostra un adenoma paratiroideo mediastinico ectopico adiacente all’arco aortico. Questo paziente era stato sottoposto a un’esplorazione del collo fallita. Un’escissione robotica transtoracica è stata curativa.
Scansione paratiroidea Sestamibi con scansione SPECT che mostra un adenoma paratiroideo mediastinico ectopico adiacente all’arco aortico. Questo paziente era stato sottoposto a un’esplorazione del collo fallita. Un’escissione robotica transtoracica è stata curativa. L’uso della scansione CT quadridimensionale (4D) per la localizzazione delle paratiroidi è in aumento. Lo studio può essere fatto senza contrasto o con imaging dinamico con contrasto. Gli adenomi paratiroidei si esaltano molto con il contrasto a causa della loro elevata vascolarizzazione, e poi il contrasto viene rapidamente lavato via. Gli studi di TAC quadridimensionale hanno mostrato tassi di sensibilità fino all’88%. Il più grande studio retrospettivo disponibile al momento di questa scrittura ha riportato una sensibilità complessiva del 79%. Come altri studi di imaging, la scansione 4D-CT è meno sensibile nel rilevare la malattia multighiandolare (43-67% ) rispetto alla malattia a ghiandola singola (92-94% ). Alcuni studi hanno sostenuto che una TAC a due fasi è efficace quanto la modalità 4D nella localizzazione delle paratiroidi, anche nei casi di piccoli adenomi, di reintervento e di malattia multighiandolare, con una minore esposizione alle radiazioni per il paziente. ) Tuttavia, anche se la tecnica a due fasi riduce l’esposizione alle radiazioni, ciò avviene probabilmente al costo di una precisione ottimale.
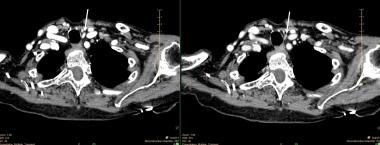 Un piccolo adenoma paratiroideo inferiore sinistro come dimostrato su una scansione 4D-CT. Il pannello di sinistra è una singola immagine dalla fase iniziale di contrasto che mostra un intenso miglioramento. Il pannello di destra mostra un rapido dilavamento del contrasto. Le frecce bianche indicano l’adenoma.
Un piccolo adenoma paratiroideo inferiore sinistro come dimostrato su una scansione 4D-CT. Il pannello di sinistra è una singola immagine dalla fase iniziale di contrasto che mostra un intenso miglioramento. Il pannello di destra mostra un rapido dilavamento del contrasto. Le frecce bianche indicano l’adenoma. La risonanza magnetica (MRI) non è stata comunemente utilizzata per la localizzazione delle paratiroidi nella maggior parte dei centri, e gli studi riguardanti questa modalità sono stati generalmente piccoli e hanno tutti utilizzato il contrasto. Nuove tecniche, concettualmente simili alla scansione 4D-CT, sono in fase di sviluppo che possono aumentare la sensibilità della MRI ed espandere la sua utilità.
L’assorbimetria radiografica a doppia energia è uno strumento utile per dimostrare il coinvolgimento scheletrico nell’iperparatiroidismo primario. Si noti che l’iperparatiroidismo colpisce preferenzialmente l’osso corticale del radio (terzo distale). Nei casi di iperparatiroidismo primario grave, le radiografie scheletriche mostrano cambiamenti patognomonici come la degranulazione sale e pepe nel cranio e il riassorbimento osseo subperiostale nelle falangi. Tuttavia, le radiografie semplici non sono generalmente utili per l’impiego di routine nella diagnosi e nel trattamento dell’iperparatiroidismo.
Uno studio di Thimmappa et al ha suggerito che gli studi di imaging possono essere utilizzati al posto dei dosaggi intraoperatori delle paratiroidi (discussi di seguito) per prevedere la guarigione nell’intervento chirurgico per l’iperparatiroidismo primario. I ricercatori hanno descritto il seguente protocollo:
-
Vengono eseguiti due studi di localizzazione preoperatoria, di cui uno con ultrasonografia eseguita dal chirurgo
-
Vengono valutati i livelli preoperatori di vitamina D, con integrazione fornita come indicato
Il rapporto ha sostenuto che in pazienti selezionati con forte corroborazione tra i due studi di localizzazione e risultati intraoperatori che sono coerenti con questi studi, i test paratiroidei intraoperatori possono non essere necessari, con lo studio trovando che i tassi di cura in pazienti in cui questo protocollo è stato impiegato uguale a quelli raggiunti utilizzando test paratiroidei.
Procedure
Il campionamento bilaterale della vena giugulare interna viene utilizzato per aiutare a localizzare gli adenomi paratiroidei ectopici, di solito nei casi di fallimento dell’esplorazione chirurgica quando le tecniche di imaging standard non sono state utili. Questa tecnica dovrebbe essere generalmente riservata a centri con specialisti e per pazienti altamente selezionati.
Trattamento
L’escissione chirurgica delle ghiandole paratiroidi anormali (vedi sotto per i dettagli del trattamento chirurgico) offre il solo trattamento permanente e curativo per l’iperparatiroidismo primario. C’è un accordo universale sul fatto che il trattamento chirurgico dovrebbe essere offerto a tutti i pazienti con malattia sintomatica. Gli autori vorrebbero notare, tuttavia, che i sintomi sono spesso ignorati sia dai medici che dai pazienti; l’affaticamento è un sintomo estremamente comune che viene spesso ignorato, soprattutto negli anziani, che comunemente lo attribuiscono all’invecchiamento o ad altre cause. Esistono alcune controversie sulla gestione ottimale dei pazienti asintomatici.
Le linee guida per la gestione dell’iperparatiroidismo primario asintomatico sono state aggiornate nel 2013 dal Fourth International Workshop on Asymptomatic Primary Hyperparathyroidism. Le indicazioni per la chirurgia includono le seguenti:
-
Calcio sierico >1 mg/dL sopra il limite superiore del range di riferimento
-
T-score di densità minerale ossea pari o inferiore a -2.5 (nelle donne in perimenopausa o in postmenopausa e negli uomini di 50 anni o più) alla colonna lombare, all’anca totale, al collo del femore, o raggio distale 1/3
-
Frattura vertebrale come evidenziato dalla radiografia o dalla valutazione della frattura vertebrale (VFA)
-
Creatinina clearance di < 60 cc/min
-
Venti-escrezione urinaria di calcio nelle ventiquattro ore >400 mg/giorno e aumento del rischio di calcoli come valutato attraverso l’analisi biochimica del rischio di calcoli.
-
Presenza di nefrolitiasi o nefrocalcinosi come determinato usando radiografia, ultrasonografia, o TAC
-
Età inferiore ai 50 anni
Alcuni clinici sostengono la terapia chirurgica in tutti i pazienti con iperparatiroidismo primario, modificata solo per quei pazienti che non sono in grado di tollerare la chirurgia. Essi sostengono che l’operazione è generalmente ben tollerata, che tale trattamento previene le complicazioni (ad esempio, l’osteoporosi), e che può invertire i sintomi che i pazienti spesso non si rendono conto di avere (ad esempio, fatica, depressione lieve). Inoltre, il monitoraggio dei pazienti asintomatici è costoso e ingombrante. Questo approccio più liberale è stato articolato da un gruppo di esperti convocato dall’American Association of Clinical Endocrinologists e dall’American Association of Endocrine Surgeons. Essi hanno concluso che “…la gestione operativa dovrebbe essere considerata e raccomandata per tutti i pazienti asintomatici con PHPT che hanno una ragionevole aspettativa di vita e adeguati fattori di rischio operativi e anestesiologici”. Questo approccio proattivo, come per tutte le paratiroidectomie, dovrebbe dipendere dalla disponibilità di un chirurgo esperto e ben addestrato.
Uno studio di Sharata et al sui fornitori di cure primarie negli Stati Uniti ha trovato che solo una minoranza degli intervistati ha mostrato una solida familiarità con le strategie di gestione dell’iperparatiroidismo primario. I ricercatori hanno scoperto che il 31% dei 109 clinici che hanno risposto al sondaggio aveva familiarità con l’intera gamma di criteri riguardanti l’intervento chirurgico nei pazienti asintomatici e che il 34% era in grado di identificare con precisione i test di sorveglianza corretti per i pazienti in osservazione. Tra i pazienti sotto osservazione, solo il 16% è stato sottoposto a studi di sorveglianza corretti.
Gestione dell’ipercalcemia grave nel contesto acuto
La riduzione del calcio sierico elevato può essere realizzata mediante l’uso di espansione del volume intravascolare con cloruro di sodio e diuretici dell’ansa come la furosemide, una volta ripristinato il volume intravascolare. Farmaci come la calcitonina e il bifosfonato IV sono stati usati come misura temporanea prima del trattamento chirurgico.
Cura non chirurgica e monitoraggio a lungo termine
I pazienti asintomatici che non si sottopongono a chirurgia richiedono un monitoraggio a lungo termine. Le raccomandazioni includono la valutazione di segni e sintomi manifesti di iperparatiroidismo ogni anno, test annuali del calcio e della creatinina nel siero e valutazione della densità minerale ossea (colonna vertebrale, anca e avambraccio) ogni 1-2 anni.
I pazienti con iperparatiroidismo primario devono mantenere un moderato apporto giornaliero di calcio elementare di 800-1000 mg e un apporto di vitamina D adeguato alla loro età e sesso. Il mantenimento di una buona idratazione, la partecipazione a un’attività fisica regolare e l’evitamento dell’immobilizzazione e di alcuni farmaci (come tiazidi, diuretici e litio) sono auspicabili.
Farmacoterapia
La terapia estrogenica nelle donne in postmenopausa ha dimostrato di causare una piccola riduzione del calcio sierico (0,5-1 mg/dL) senza un cambiamento dell’ormone paratiroideo. Gli estrogeni hanno anche effetti benefici sulla densità minerale ossea (BMD) della colonna lombare e del collo del femore. Tuttavia, a causa dei rischi associati alla sostituzione degli estrogeni, non dovrebbe essere usato al solo scopo di trattare l’iperparatiroidismo primario.
Modulatori selettivi del recettore degli estrogeni come il raloxifene hanno dimostrato di causare una diminuzione del calcio sierico della stessa entità osservata con gli estrogeni.
Bisfosfonati, in particolare alendronato, ha dimostrato di migliorare la BMD alla spina dorsale e all’anca in pazienti con iperparatiroidismo primario. Non sono stati riportati cambiamenti significativi nell’ormone paratiroideo, nel calcio o nel calcio urinario delle 24 ore. Il trattamento con un bifosfonato come l’alendronato può essere considerato in pazienti con iperparatiroidismo primario e bassa BMD che non possono, o non vogliono, sottoporsi a chirurgia.
I farmaci calcimetici attivano il recettore del calcio e inibiscono la funzione delle cellule paratiroidi. Il trattamento con cinacalcet ha portato alla riduzione senza normalizzazione dei livelli di ormone paratiroideo, alla riduzione e persino alla normalizzazione del calcio sierico, ma non è stato osservato alcun aumento della BMD.
Altri trattamenti
Iniezione di alcool per via percutanea, ablazione con energia a ultrasuoni e altre tecniche di ablazione percutanea della ghiandola paratiroidea sono state suggerite come trattamenti alternativi nei pazienti con iperparatiroidismo primario che non possono o non vogliono sottoporsi a intervento chirurgico. Anche se gli studi su queste tecniche continuano, il loro uso di routine non può ancora essere supportato.
Cura chirurgica
Il trattamento chirurgico dovrebbe essere offerto alla maggior parte dei pazienti con iperparatiroidismo primario. L’approccio operativo storico criterio-standard è l’esplorazione completa del collo con l’identificazione di tutte le ghiandole paratiroidi e la rimozione di tutte le ghiandole anormali. Circa l’85% dei casi di iperparatiroidismo primario è causato da un singolo adenoma. Pertanto, la maggior parte dei pazienti che si sottopongono all’esplorazione completa del collo per valutare tutte le paratiroidi subiscono una dissezione non necessaria. Piuttosto che esplorare tutte le ghiandole paratiroidi, si è evoluta una tecnica più recente, la paratiroidectomia diretta. Questa tecnica si basa su studi di imaging preoperatorio per localizzare la ghiandola anormale. Il chirurgo quindi rimuove solo quella ghiandola, senza visualizzare le altre ghiandole.
Con le moderne tecniche di imaging, una paratiroide anomala può essere rilevata preoperatoriamente nel 70-80% dei casi. Tuttavia, nessuno studio di imaging attuale è affidabile per rilevare più ghiandole anormali. Pertanto, è necessario un metodo aggiuntivo per confermare che non sono presenti altre ghiandole anormali dopo l’escissione della lesione visualizzata. A questo scopo, la maggior parte dei centri utilizza il dosaggio intraoperatorio dell’ormone paratiroideo. Poiché l’emivita plasmatica dell’ormone paratiroideo è di soli 4 minuti circa, il livello scende rapidamente dopo la resezione della fonte. Se il livello non scende dopo la resezione della ghiandola anomala identificata, la procedura viene prolungata per consentire un’ulteriore esplorazione. Tuttavia, il dosaggio intraoperatorio dell’ormone paratiroideo è solitamente disponibile solo nei centri che eseguono un elevato volume di paratiroidectomie.
Alcuni autori hanno sostenuto la paratiroidectomia radioguidata, rilevando il sestamibi marcato nella ghiandola anomala utilizzando una sonda portatile. La maggior parte dei centri ha abbandonato questa tecnica perché se la ghiandola si marchia bene con il sestamibi, consentendo un adeguato imaging preoperatorio, l’uso della sonda portatile intraoperatoria non è necessario nella maggior parte dei casi.
Greene et al hanno esaminato le tendenze nell’uso da parte dei chirurghi dell’esplorazione bilaterale o limitata per la paratiroidectomia tra il 1998 e il 2008. Interrogando 256 chirurghi (membri dell’American Association of Endocrine Surgeons e dell’American College of Surgeons), che insieme rappresentavano il 46% delle operazioni paratiroidee negli Stati Uniti, i ricercatori hanno scoperto che nel 2008, il 10% dei chirurghi utilizzava l’esplorazione bilaterale del collo, il 68% l’esplorazione limitata e il 22% entrambe queste tecniche di esplorazione nella loro pratica. Nel 1998, le statistiche per i chirurghi che utilizzavano l’esplorazione bilaterale, limitata o entrambi i tipi di esplorazione erano rispettivamente il 74%, l’11% e il 15%. Lo studio ha indicato che i medici che hanno maggiori probabilità di utilizzare l’esplorazione limitata sono i chirurghi endocrini, i chirurghi con una pratica ad alto volume e i chirurghi i cui mentori hanno utilizzato l’esplorazione limitata.
Gli autori hanno anche scoperto che nel 2008, la metà dei chirurghi generali intervistati non ha mai monitorato l’ormone paratiroideo intraoperatorio (sia utilizzando l’esplorazione bilaterale o limitata), mentre lo stesso vale per meno del 10% dei chirurghi endocrini. Inoltre, c’era una grande variazione “tra sottoinsiemi di chirurghi nei volumi operativi, nelle indicazioni per l’esplorazione bilaterale del collo, nell’assistenza, nell’esperienza con e sestamibi, e nella percezione dei tassi di cura e di complicazione”. Greene e i suoi coautori hanno concluso che a causa delle molte differenze che esistono nella gestione chirurgica dell’iperparatiroidismo, potrebbe essere necessario definire delle linee guida di best-practice.
Per le malattie familiari, come la MEN 1, la paratiroidectomia totale viene eseguita insieme alla timectomia cervicale e all’autotrapianto all’avambraccio. Si raccomanda anche la crioconservazione di parte del tessuto paratiroideo.
La paratiroidectomia è solitamente ben tollerata. I rischi principali sono la lesione dei nervi laringei ricorrenti e l’ipoparatiroidismo dovuto alla resezione o alla devascolarizzazione di tutte le ghiandole paratiroidi. Anche se l’anestesia locale è stata utilizzata con successo per questa procedura, soprattutto negli approcci diretti durante i quali un singolo adenoma viene localizzato preoperatoriamente, l’anestesia generale è utilizzata più comunemente. Nei pazienti in cui l’ipercalcemia (e, quindi, la disidratazione) è stata grave, un’attenzione particolare deve essere rivolta al ripristino perioperatorio dell’equilibrio dei liquidi. La mobilità del collo deve essere valutata per garantire il corretto posizionamento in sala operatoria.
Tecnica di esplorazione completa del collo con identificazione di tutte le ghiandole paratiroidi
L’aspetto più critico per garantire il successo di questa operazione è l’identificazione di tutte e 4 le ghiandole paratiroidi e la rimozione di tutte le ghiandole anomale. In caso di iperplasia a 4 ghiandole, viene eseguita una paratiroidectomia a 3,5 ghiandole (subtotale). Vengono lasciati circa 50-70 mg di tessuto dall’aspetto più normale. Una sutura non assorbibile viene lasciata come etichetta per identificare la ghiandola in caso di necessità di un nuovo intervento.
Il paziente viene messo in posizione a sdraio con il collo esteso su un rullo trasversale della spalla. Questa posizione permette la completa esposizione delle strutture anteriori del collo e migliora il drenaggio venoso.
Un’incisione trasversale bassa posta all’interno di una piega cutanea fornisce il miglior risultato estetico. La lunghezza dell’incisione deve essere adeguata per consentire l’esplorazione completa di tutte le sedi potenziali delle ghiandole paratiroidi; tuttavia, data l’elasticità dei lembi di pelle del collo, un’incisione da 2 a 5 cm di solito consente l’identificazione sicura delle strutture importanti.
Dopo aver ottenuto l’emostasi dell’incisione della pelle, lembi subplatismatici sono sviluppati superiormente alla tacca della cartilagine tiroidea e inferiormente alla parte piatta del manubrio. I muscoli sternoioideo e sternotiroideo (cinghia) sono separati sulla linea mediana per esporre la tiroide. Se gli studi di localizzazione preoperatoria suggeriscono un adenoma paratiroideo, quel lato viene affrontato per primo.
Frequentemente, una vena tiroidea media può richiedere una legatura per garantire un’adeguata mobilizzazione del lobo tiroideo. Il lobo tiroideo viene sollevato dall’arteria carotide comune e retratto medialmente. L’arteria tiroidea inferiore viene identificata dopo una dissezione smussata e tagliente del tessuto areolare anteriormente e medialmente all’arteria carotide comune e posteromedialmente al lobo tiroideo. Il nervo laringeo ricorrente è identificato dopo, inferiore e laterale al lobo inferiore della ghiandola tiroidea.
L’intersezione dell’arteria tiroidea inferiore e il nervo laringeo ricorrente è un punto di riferimento importante perché la maggior parte delle ghiandole paratiroidi, superiore e inferiore, si trovano entro 2 cm di questa zona. Le ghiandole paratiroidi superiori si trovano dorsalmente ai due terzi superiori del lobo tiroideo e posteriormente al nervo laringeo ricorrente. Le ghiandole inferiori, che sono meno coerenti nella localizzazione, si trovano di solito inferiori all’arteria tiroidea inferiore e ventrali al nervo laringeo ricorrente. Di solito si trovano entro 1 cm dal lobo inferiore della tiroide.
Occasione, non tutte le ghiandole paratiroidi possono essere identificate. In questi casi, si riesaminano prima le sedi abituali perché la maggior parte delle ghiandole paratiroidi si trova in aree tipiche. Se le ghiandole paratiroidi non vengono identificate in quelle sedi, allora si esegue una ricerca sistematica, prendendo in considerazione il percorso di discesa delle ghiandole paratiroidi superiori e inferiori.
Le ghiandole inferiori possono trovarsi nel legamento tireotomico. Possono essere difficili da identificare, soprattutto dopo la divisione della vena tiroidea inferiore, una manovra che permette alla ghiandola di ritrarsi nel mediastino superiore. Un’altra sede per le ghiandole paratiroidi inferiori ectopiche è il timo. Se una ghiandola inferiore non può essere localizzata, una timectomia cervicale può essere eseguita, elevando tanto tessuto timico superiormente dal mediastino quanto può essere fatto in modo sicuro.
Ghiandole paratiroidi superiori sono solitamente dorsali ai due terzi superiori della ghiandola tiroidea. Occasionalmente, queste ghiandole sono adiacenti ai vasi tiroidei superiori. Altre posizioni includono la guaina carotidea o posteriore all’esofago o alla faringe (retroesofagea). Infine, entrambe le ghiandole paratiroidi superiori e inferiori possono essere situate in modo aberrante all’interno della capsula della ghiandola tiroidea. Alcuni chirurghi eseguono una lobectomia tiroidea sul lato della ghiandola anomala mancante dopo aver effettuato una ricerca esaustiva nelle sedi sopra citate. La sternotomia mediana non dovrebbe generalmente essere eseguita durante l’esplorazione iniziale del collo per l’iperparatiroidismo.
Le ghiandole anormalmente ingrossate vengono escisse dopo la conferma delle dimensioni normali delle altre ghiandole. Durante l’escissione, è importante evitare la rottura capsulare della ghiandola anormale perché questo può essere associato all’impianto di cellule paratiroidi nel sito operativo e alla successiva paratiromatosi. Le paratiroidi possono essere identificate da chirurghi molto esperti in base all’aspetto e alla posizione. Se necessario, l’identificazione delle ghiandole paratiroidi deve essere confermata istologicamente dall’esame delle sezioni congelate. Nei casi di paratiroidectomia totale con autotrapianto, il tessuto paratiroideo dovrebbe essere crioconservato per un futuro autotrapianto nel caso in cui il trapianto iniziale non funzioni adeguatamente.
Tecnica per la paratiroidectomia diretta
In molti aspetti, la tecnica operativa è simile a quella descritta sopra per un’esplorazione completa della paratiroide. Le differenze sono annotate qui di seguito.
Un’adeguata imaging della ghiandola anormale prima dell’intervento è essenziale. Inoltre, devono essere confermate le disposizioni per la misurazione intraoperatoria dell’ormone paratiroideo. Deve essere stabilita una linea per il campionamento del sangue venoso periferico. Spesso, la vena safena distale fornisce l’accesso più conveniente.
Alcuni chirurghi modificano la posizione dell’incisione in base alla posizione preoperatoria dell’adenoma. Questo autore preferisce una piccola incisione (cioè, ~2 cm) nella posizione standard per un’incisione del colletto. Questa incisione può essere facilmente estesa nel caso in cui sia necessaria un’esplorazione estesa.
Un livello di ormone paratiroideo di base viene prelevato immediatamente prima dell’incisione cutanea. Dopo l’identificazione e la dissezione dell’adenoma, viene tracciato un livello pre-incisione. La manipolazione della ghiandola causa occasionalmente aumenti significativi, a volte di più di 10 volte, del livello dell’ormone paratiroideo. Dopo l’escissione della ghiandola, i livelli dell’ormone paratiroideo vengono prelevati a 5 minuti e 10 minuti dopo l’escissione. I criteri per un’escissione adeguata sono un calo del 50% dell’ormone paratiroideo dal livello di base al livello di 10 minuti post-escissione o un calo del 50% dell’ormone paratiroideo dal livello pre-escissione a 10 minuti e un livello post-escissione inferiore al livello di base.
L’incisione può essere chiusa mentre si elaborano gli ultimi livelli di ormone paratiroideo, ma il paziente deve rimanere sotto anestesia e il campo sterile deve essere mantenuto fino a quando i risultati del dosaggio dell’ormone paratiroideo sono noti.
Se una paratiroidectomia diretta viene eseguita con successo, la maggior parte di questi pazienti può essere tranquillamente dimessa il giorno dell’intervento.
Complicazioni e cure postoperatorie
Per un’esplorazione completa della paratiroide, l’ipoparatiroidismo postoperatorio e l’ipocalcemia sono preoccupanti, ma sono estremamente rari dopo una paratiroidectomia diretta e un’esplorazione limitata del collo. L’ipocalcemia è più comune dopo l’esplorazione bilaterale delle paratiroidi, soprattutto quando viene eseguita una paratiroidectomia subtotale. Il nadir del calcio sierico si verifica solitamente 24-72 ore dopo l’intervento. Molti pazienti diventano ipocalcemici, ma pochi diventano sintomatici. D’altra parte, anche quando è stata fatta un’esplorazione limitata, sintomi lievi di ipocalcemia possono verificarsi nei primi giorni dopo la paratiroidectomia in assenza di ipocalcemia verificabile. Per questo motivo, alcuni medici somministrano abitualmente supplementi di calcio per via orale dopo l’intervento.
L’ipocalcemia dopo l’intervento chirurgico delle paratiroidi può essere dovuta alla sindrome dell’osso affamato, in cui il calcio e il fosforo si depositano rapidamente nell’osso. Questo è caratterizzato da ipoparatiroidismo e ipocalcemia transitoria, ma occasionalmente grave, fino a quando le ghiandole normali riacquistano sensibilità.
Se l’ipoparatiroidismo persiste, è necessaria un’integrazione orale con calcio e vitamina D. Il citrato di calcio o il carbonato di calcio possono essere iniziati a 400-600 mg di calcio elementare quattro volte al giorno. Alcuni pazienti richiedono molto di più. Il calcitriolo viene iniziato a 0,5 mcg due volte al giorno e aumentato come richiesto. I pazienti in cui viene eseguita la paratiroidectomia totale e l’autotrapianto possono richiedere un’integrazione temporanea di calcio.
Se un nervo laringeo ricorrente è transettato durante la paratiroidectomia, è indicata una riparazione immediata. Se il nervo ricorrente non è noto per essere danneggiato intraoperatoriamente, ma la disfunzione è suggerita perché il paziente ha sviluppato una nuova raucedine, la gestione in attesa è scelta inizialmente poiché la maggior parte dei pazienti recupera la funzione del nervo in poche settimane o mesi. La laringoscopia è indicata per documentare sia la disfunzione che il recupero della funzione.
Una potenziale emergenza pericolosa per la vita nel periodo post-operatorio è lo sviluppo di un ematoma in espansione nello spazio pretracheale. Questa complicazione deve essere riconosciuta e trattata immediatamente aprendo la ferita ed evacuando l’ematoma. Se non trattato, l’edema laringeo può progredire rapidamente, causando l’ostruzione delle vie aeree. Inoltre, l’edema può impedire l’intubazione endotracheale, e l’apertura della ferita deve precedere qualsiasi tentativo di intubazione.
La maggior parte dei piccoli ematomi non richiede trattamento. Occasionalmente può formarsi una raccolta di fluido subplatisma, e questi sono di solito trattati adeguatamente con una singola aspirazione. In alcuni casi, può essere necessario ripetere l’aspirazione. Raramente, può essere necessario posizionare un drenaggio per le raccolte di fluido ricorrenti.
Risultati del trattamento
I tassi di guarigione dopo la chirurgia per l’iperparatiroidismo primario sono molto alti in mani esperte, circa il 97-98%. Una cura è generalmente definita come la normalizzazione del calcio sierico. I livelli di ormone paratiroideo, tuttavia, possono essere elevati dopo l’intervento nel 20-40% dei pazienti. Se il calcio sierico rimane nel range di riferimento, questo stato elevato di solito non suggerisce una malattia persistente, ma può indicare un rischio maggiore di recidiva. Molti pazienti con iperparatiroidismo primario hanno carenza di vitamina D, e la sostituzione può correggere l’elevata concentrazione di ormone paratiroideo. C’è anche qualche debole evidenza che l’integrazione di calcio può diminuire un aumento isolato dell’ormone paratiroideo dopo la paratiroidectomia.
La qualità della vita ha dimostrato ripetutamente di essere migliorata dopo la paratiroidectomia. In particolare, la qualità della vita è stata anche trovata per subire un miglioramento misurabile in pazienti “asintomatici”, che sottolinea il fatto che alcuni sintomi lievi possono passare inosservati da pazienti e clinici.
Follow-up
I pazienti vengono visitati 1-2 settimane dopo l’intervento e si ottengono i livelli di calcio, 25-idrossivitamina D e ormone paratiroideo. La carenza di vitamina D è particolarmente comune nei pazienti con iperparatiroidismo. Molti medici aggiungono abitualmente un’integrazione di calcio e vitamina D dopo l’intervento per aiutare a ripristinare la perdita ossea e integrare la scarsa assunzione di cibo.
L’analisi ha dimostrato che il tasso di recidiva dopo una paratiroidectomia riuscita è di circa il 10-15% con un follow-up a lungo termine, che è molto più alto di quanto si pensasse storicamente. Si raccomanda quindi un follow-up a lungo termine, con determinazioni annuali del calcio e dell’ormone paratiroideo.
.