Interleuchina 12 (IL-12) è una citochina pro-infiammatoria con un peso molecolare di 70 kDa composta da due subunità, IL-12p35 (35 kDa) e IL-12p40 (40 kDa). La struttura eterodimerica unica è condivisa con tre membri della famiglia, cioè IL-23 (p19/p40), IL-27 (p28/Ebi3) e IL-35 (p35/Ebi3).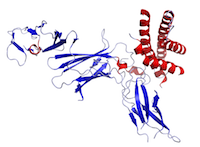
IL-12, chiamata anche IL-12p70, è stata scoperta indipendentemente nel 1989 da Kobayashi M. et al. (chiamata fattore stimolante delle cellule killer naturali) e nel 1990 da Stern A.S. et al. (definito fattore di maturazione dei linfociti citotossici).
Figura Questa è una struttura di IL-12 creata utilizzando i dati di Protein Data Bank (PDB: 1F45) e resa con PyMOL.
IL-12 induce la differenziazione delle cellule T CD4+ naive in cellule Th1 e attiva le cellule NK. Dopo l’attivazione, le cellule NK producono IFN-γ e IL-2 ma anche IL-12, indicando un meccanismo di feedback positivo. IL-12 protegge le cellule CD4+ Th1 dalla morte apoptotica indotta dall’antigene e si è scoperto che ha effetti sinergici con IL-18 nello sviluppo delle cellule Th1. Inoltre, IL-12 gioca un ruolo nel traffico e nella migrazione delle cellule T inducendo molecole di adesione funzionali come l’espressione dei ligandi P ed E-selectin sulle cellule Th1 ma non sulle cellule Th2. Pertanto, le cellule Th1 sono selettivamente reclutate nei siti che promuovono una risposta immunitaria Th1. Funzionalmente, queste cellule aiutano a eliminare gli agenti patogeni intracellulari; in contrasto con le cellule Th2 che sono responsabili dell’immunità umorale che protegge dagli invasori extracellulari. L’equilibrio tra IL-12, che favorisce le risposte Th1, e IL-4, che favorisce le risposte Th2, determina la preferenza precoce espressa nella risposta immunitaria.
IL-12p35 condividono una sostanziale omologia di sequenza con la citochina IL-6 mentre la catena p40 è strutturalmente omologa al dominio extracellulare della catena α del recettore IL-6 (IL-6R). Questo suggerisce che la struttura di IL-12 si è evoluta da una citochina primordiale della famiglia IL-6 e da uno dei suoi recettori. Anche se i trascritti di IL-12p35 si trovano in molti tipi di cellule, l’IL-12p35 libero non viene secreto senza la subunità IL-12p40. Quest’ultima subunità è prodotta prevalentemente da monociti attivati, macrofagi, neutrofili e cellule dendritiche. Le attività biologiche di IL-12p70 sono mediate dal legame con un complesso recettoriale di membrana (IL-12R) composto da due subunità: IL-12R-β1 e IL-12R-β2. Mentre la subunità IL-12R-β1 è costitutivamente espressa, l’espressione di IL-12R-β2 sulle cellule Th1 è upregolata da IFN-γ e si correla con la reattività a IL-12. Dopo il legame di IL-12, la via di segnalazione JAK-STAT viene attivata, con STAT4 che è il mediatore predominante delle risposte delle cellule T.
.