È importante conoscere la struttura di Lewis di una molecola per capire le sue proprietà fisiche, ibridazione e forma della molecola. Oggi esamineremo la struttura di Lewis di I3- o anche conosciuto come ione trioduro, poiché ha una carica negativa. Ci sono tre molecole di iodio in questa molecola e quindi il nome del composto è Triodide. Per capire la struttura di Lewis della molecola, dovremmo conoscere gli elettroni di valenza della molecola di iodio.
Struttura di Lewis
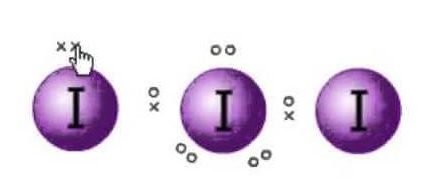
La struttura di Lewis è la rappresentazione degli elettroni delle molecole. Ci sono coppie solitarie ed elettroni di valenza che aiutano a determinare l’ibridazione e la forma della molecola. Poiché ci sono molecole di iodio, una molecola di iodio sarà al centro. Inoltre, lo iodio è nel settimo gruppo della tavola periodica e ha sette elettroni di valenza nella sua orbita esterna.

Abbiamo qui tre molecole di iodio che insieme a un elettrone extra gli danno una carica negativa. Quindi il numero totale di elettroni di valenza sono: 7×3 + 1= 22.
Ci sono 22 elettroni di valenza in totale in questa molecola. Ora c’è una regola dell’ottetto che ogni atomo segue. Secondo questa regola, ogni atomo dovrebbe avere otto elettroni nella sua orbita esterna. Se ci sono 8 elettroni nel guscio esterno dell’atomo centrale, ci sono altri due atomi che devono completare il loro ottetto. Poiché tutti gli atomi avranno bisogno di otto elettroni nel loro guscio esterno per completare l’ottetto, un elettrone dell’atomo di iodio centrale sarà preso da entrambi gli atomi di iodio vicini. Ciò significa 8-1-1=6.
Come gli elettroni saranno presi da entrambi gli atomi.
Così ora gli elettroni di valenza sull’atomo centrale di iodio saranno sei. Questi sei elettroni formeranno le coppie solitarie di elettroni che non si legano. Come forma la coppia di elettroni ora, ci saranno tre coppie solitarie e due coppie di legame degli elettroni, poiché ogni atomo di iodio ha un legame con l’atomo centrale che condivide un elettrone ciascuno, in totale ci sono 3 coppie solitarie e 2 coppie di legame sull’atomo centrale.
Ibridizzazione
Per conoscere l’ibridazione di qualsiasi molecola, c’è una semplice formula che può essere usata. Questa formula è usata per trovare il numero di ibridazione che aiuta a conoscere l’ibridazione della molecola.
I numeri di ibridazione e l’ibridazione che determina sono indicati come segue:
- 2: ibridazione sp
- 3: ibridazione sp2
- 4: ibridazione sp3
- 5: ibridazione
La formula per trovare il numero è,
Numero di ibridazione: Numero di elettroni di valenza + monovalente + (carica negativa) – (carica positiva)/2
Gli elettroni di valenza degli atomi di iodio sono 7 perché ci sono sette elettroni nel guscio più esterno. Il numero dell’atomo monovalente è due perché due dei tre iodio sono monovalenti. Ora quando veniamo alla carica dello ione I3- ha una carica negativa quindi il valore di questa carica negativa sarà 1.
Ora mettiamo tutti i valori secondo la formula,
7+1+2/2
=10/2
=5
Quindi il numero di ibridazione è 5 che significa che la sua ibridazione è sp3d.
Un altro modo di trovare l’ibridazione di una data molecola è con l’aiuto delle coppie solitarie e degli elettroni di valenza. Il numero di coppie solitarie in questa molecola è 3, e il numero di atomi che condividono gli elettroni di valenza è 2.
Quindi, 3+2=5 che determina anche l’ibridazione sp3d.
La forma dello ione I3-

La forma della molecola I3- è lineare. Ci sono tre atomi di iodio di cui uno ha una carica negativa extra. A causa di questo elettrone in più ci sono 3 coppie di elettroni solitari e 2 coppie di legami che rendono il suo numero sterico 5. Dato che ci sono tre coppie solitarie sull’atomo di ioduro centrale, queste coppie cercano di respingersi a vicenda il più possibile. Quindi, per essere lontani ad una distanza maggiore, le coppie prendono le posizioni equatoriali, e gli altri due atomi di Iodio sono a 180 gradi l’uno dall’altro. Così la forma complessiva dello ione I3- è lineare.
Polarità
Quindi ecco la parte difficile di questo ione, prima di tutto come una carica su di esso possiamo chiamarlo come uno ione poliatomico invece di chiamarlo molecola. Gli ioni sono le cariche che vediamo sulle molecole. Dato che I3- ha un elettrone, questo ione ha complessivamente una carica negativa. Le molecole hanno polarità perché hanno entrambe le cariche che sono un’estremità parzialmente carica positivamente e l’estremità parzialmente carica negativamente. C’è un momento di dipolo sulle molecole che dipende dalla separazione delle cariche sulla molecola. Se la distanza tra le due cariche è maggiore, anche il momento di dipolo sarà maggiore.
Ma quando parliamo dello ione I3- è uno ione caricato negativamente. Anche quando disegniamo la sua struttura di Lewis non vediamo alcun momento di dipolo o i legami polari in esso come la carica complessiva stessa è negativa sullo ione. Quindi non è né polare né non polare. Tuttavia, se si deve descrivere lo ione, si può usare la frase “come una molecola polare” perché I3- è solubile in acqua.
In conclusione, per riassumere tutto questo articolo, I3- è uno ione poliatomico che ha 22 elettroni di valenza, 3 coppie solitarie, 2 coppie di legami e ibridazione sp3d. È di forma lineare e non ha polarità.