- Abstract
- Parole chiave
- Introduzione
- Metodi precoci per la produzione di pigmenti
- Metodo dell’acido solforico
- Metodo di clorazione
- Separazione del ferro
- Processo del forno elettrico
- Viabilità idrometallurgica
- Metodo ad alta pressione
- Processo atmosferico
- Ossidrolisi
- Ossidrolisi a letto fluido
- Ossidrolisi a spruzzo
- Produzione di titanio
Abstract
L’ilmenite di basso grado può essere lisciviata con HCl concentrato a pressione atmosferica e a 80oC. Dopo la filtrazione per separare la materia insolubile, la soluzione contenente TiO2+ e Fe2+ viene riscaldata per precipitare l’idrossido di titanio e recuperare l’HCl. L’idrossido di titanio viene poi calcinato per ottenere un rutilo sintetico contenente il 95+% di TiO2, mentre il FeCl2 viene sottoposto a ossidrolisi o fluidizzato per recuperare HCl e Fe2O3. Il processo può essere applicato naturalmente all’ilmenite di alto grado. Esso bypassa il processo del forno elettrico che si applica solo all’ilmenite di alto grado ed è superiore al processo dell’acido solforico che è altamente inquinante. Il prodotto di questo processo può essere usato per preparare il pigmento bianco e il titanio metallico.
Parole chiave
Lisciviazione HCl, processo Magpei, rutilo sintetico, ossidrolisi, forno elettrico, clorazione, processo con acido solforico
Introduzione
I principali minerali di titanio sono rutilo, TiO2 e ilmenite, FeTiO3 (Figura 1 e 2). Il rutilo è facile da trasformare in metallo di titanio o pigmento TiO2 con il metodo della clorazione, mentre l’ilmenite è più complicato a causa del suo alto contenuto di ferro. Poiché le riserve mondiali di titanio sono al 90% sotto forma di ilmenite e solo al 10% sotto forma di rutilo, il trattamento dell’ilmenite è evidentemente una questione importante in metallurgia.

Figura 1: Campione da museo di rutilo, ~ 90 % TiO2

Figura 2: Campione da museo di ilmenite, FeTiO3 (59.4 % TiO2)
I depositi di ilmenite possono essere massicci come nella provincia del Quebec (Figura 3) o come sabbie nere (Figura 4) associate a magnetite, monazite e altri minerali preziosi che vengono separati con metodi fisici (Figura 5). Nella prima separazione magnetica si usa un magnete debole per separare la magnetite mentre nella seconda separazione magnetica si usa un magnete ad alta intensità per separare l’ilmenite.

Figura 3: Un campione di ilmenite massiccia del Quebec

Figura 4: Sabbie nere di spiaggia come in India
Metodi precoci per la produzione di pigmenti
Metodo dell’acido solforico
Nel 1916, la Titanium Pigment Corporation di Niagara Falls, New York e la Titan Company di Norvegia iniziarono simultaneamente la produzione commerciale di questo nuovo pigmento bianco. Allora, i principali pigmenti bianchi usati nelle vernici erano la biacca, il bianco di zinco e il litopone. In questo metodo l’ilmenite veniva trattata con H2SO4 concentrato a 110-120°C per formare solfati ferrosi e titanilici:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
La reazione viene condotta in grandi vasche di cemento rivestite con mattoni resistenti all’acido (Figura 6), riscaldate con iniezione diretta di vapore ad alta pressione o in un mulino a pug (Figura 7) . La massa solidificata prodotta nel reattore alla fine della reazione è stata poi scaricata dal reattore per dissoluzione in acqua o acido diluito. Dopo aver rimosso il residuo insolubile per filtrazione, la soluzione contenente 120-130 g/L di TiO2 e 250-300 g/L di FeSO4 è stata concentrata sotto vuoto a 10°C per cristallizzare FeSO4-7H2O che è stato poi centrifugato. L’ossido di titanio viene poi precipitato dalla soluzione per diluizione e semina con conseguente formazione di H2SO4 diluito per lo smaltimento (figure 8 e 9). Tuttavia, il più grande produttore di pigmento a Salvador, in Brasile, usa ancora questa tecnologia perché smaltisce i prodotti di scarto nell’oceano che vengono rimossi dalla marea.

Figura 5: Beneficenza delle sabbie nere per recuperare i suoi componenti di valore

Figura 6: Grandi serbatoi di cemento rivestiti con mattoni resistenti agli acidi
Figura 7: Mulino a pug riscaldato

Figura 8: Produzione di pigmento TiO2 con il processo dell’acido solforico

Figura 9: Bianco di titanio, ~ 100% TiO2
Metodo di clorazione
DuPont negli USA produce il pigmento dal 1950 per clorazione diretta del minerale di ilmenite, separazione dei prodotti per distillazione frazionata, poi ossidazione di TiCl4 (figura 10):

Figura 10: Processo semplificato Du Pont per la produzione di pigmenti dall’ilmenite
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Il problema di questo processo è il recupero del cloro dal cloruro ferrico o la commercializzazione delle grandi quantità di questo co-prodotto.
Separazione del ferro
A causa dei problemi di inquinamento associati allo smaltimento di acido solforico diluito e FeSO4, il ferro nel minerale viene separato in una fase iniziale. Questo si ottiene in due modi: tramite forno elettrico e tramite vie idrometallurgiche.
Processo del forno elettrico
Il metodo del forno elettrico è stato sviluppato negli anni 50. Il minerale veniva mescolato con una certa quantità di antracite che era appena sufficiente a ridurre la componente di ossido di ferro del minerale, poi caricato in un forno elettrico a 1 650°C dove l’ossido di ferro viene ridotto a metallo mentre il titanio viene separato come scoria (Figura 11). Le reazioni che avvengono durante la riduzione sono le seguenti:

Figura 11: Processo del forno elettrico per la separazione del ferro
FeTiO3 + C → Fe + CO + TiO2(scorie)
Fe2O3 + 3C → 2Fe + 3CO
Questo metodo è usato dalla Rio Tinto QIT nel suo impianto di Sorel vicino a Montreal e a Richards Bay in Sud Africa. È anche usato in Unione Sovietica a Zaporozhye (Ucraina) e in Giappone.
Le scorie di titanio sono principalmente titanato di ferro e magnesio, (Fe,Mg)Ti4O10, e una piccola quantità di silicati; le analisi tipiche sono 72-85% di TiO2 totale. Una piccola quantità di TiO2 è ridotta a Ti2O3. La riduzione degli ossidi di ferro non viene portata a termine, per cui un po’ di ossido di ferro viene lasciato nelle scorie per diminuirne il punto di fusione. Punto di fusione di TiO2 1840°C e ilmenite 1435°C.
La scoria è alta in titanio e bassa in ferro (Figura 12) ed è quindi preferibile alla ilmenite nella produzione di pigmento TiO2 o di metallo di titanio. Tuttavia, le scorie prodotte in Quebec non sono adatte alla clorazione a causa del loro alto livello di impurità – circa il 16,6% rispetto al 6% circa delle altre scorie. Queste impurità non solo consumano quantità inutili di cloro, ma creano anche un problema di smaltimento. Inoltre, alcune di queste impurità, ad es, calcio e magnesio interferiscono con il processo di clorazione stesso che viene condotto a 800°C formando una fase fusa (CaCl2 m.p. 770°C, MgCl2 m.p. 708°C).

Figura 12: Scorie di titanio macinate, FeTi4O10 (70-80% TiO2)
Per queste ragioni, le scorie di titanio sono state usate solo per fare il pigmento tramite il processo con acido solforico. Le scorie sono state trattate nello stesso modo dell’ilmenite con l’eccezione che non era necessaria alcuna separazione del solfato ferroso perché la maggior parte del ferro era già stata separata per riduzione nella fase precedente (Figura 13). Il processo di trattamento delle scorie con acido solforico, tuttavia, soffriva ancora del problema dello smaltimento dell’acido di scarto e di conseguenza fu abbandonato negli anni ’80 e sostituito da una nuova tecnologia basata sulla valorizzazione delle scorie al 94,5% di TiO2 mediante lisciviazione della maggior parte delle impurità con HCl sotto pressione per renderle adatte alla clorurazione.

Figura 13: Lisciviazione di scorie di titanio per la produzione di pigmento TiO2, ora obsoleta
Viabilità idrometallurgica
La via idrometallurgica è stata sviluppata negli anni ’60 e prevedeva la lisciviazione del ferro dall’ilmenite, ottenendo un residuo ricco di titanio (90-95% TiO2) noto come “rutilo sintetico”. In un caso, il processo Altair, si è ottenuto un TiO2 di grado pigmento. Tutti questi processi utilizzano un processo di ossidrolisi per il trattamento del cloruro ferroso per ottenere HCl per il riciclo e Fe2O3 come sottoprodotto.
Metodo ad alta pressione
In questo metodo, l’ilmenite di alta qualità viene decomposta in autoclave con il 20% di HCl a 120°C e 200 kPa; il ferro viene solubilizzato come cloruro ferroso lasciando un solido contenente circa il 95% di TiO2 che ha l’analisi chimica del rutilo per cui viene chiamato rutilo sintetico (Figura 14):

Figura 14: Rutilo sintetico
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
L’ilmenite di bassa qualità non può essere trattata con questo metodo poiché tutti i silicati e la materia insolubile contaminano il prodotto. Il rutilo sintetico viene poi trattato con cloro per preparare TiCl4 da cui si ottengono TiO2 o titanio metallico senza problemi di inquinamento. Il processo è usato negli Stati Uniti, in Inghilterra, Giappone, Taiwan e Australia. L’ossidrolisi potrebbe essere condotta in una varietà di modi come descritto di seguito.
Processo atmosferico
Nel 2014 è stato scoperto dalla Magpie Incorporation in Canada che l’ilmenite di basso grado può essere dissolta a 80°C con HCl concentrato a pressione atmosferica. Dopo la filtrazione per rimuovere la materia insolubile, la soluzione viene distillata per recuperare l’HCl e per idrolizzare lo ione titanile in TiO2. Dopo la filtrazione, il residuo viene calcinato per produrre rutilo sintetico (Figura 16):

Figura 15: Produzione di rutilo sintetico da ilmenite

Figura 16: Produzione del 98+% di TiO2 da una ilmenite di basso grado
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
È evidente che la nuova tecnologia di lisciviazione a pressione ambiente è superiore alla vecchia fusione in forno elettrico con autoclave.
Ossidrolisi
La soluzione di cloruro ferroso viene rigenerata in HCl e Fe2O3 per ossidrolisi:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
È la stessa tecnologia usata per il trattamento della soluzione sottaceto. Si usano due metodi
Ossidrolisi a letto fluido
In un reattore a letto fluido la soluzione di cloruro ferroso è introdotta su un grande letto di ossido ferrico caldo dove il riscaldamento è fornito dai gas di combustione caldi fluidizzanti (Figura 17). Mentre il gas di combustione scorre attraverso il letto di ossido ben agitato, raggiunge rapidamente l’equilibrio termico con il letto. La soluzione viene alimentata sopra il letto di ossidi. L’alimentazione liquida bagna lo strato esterno delle particelle di ossido caldo e viene rapidamente evaporata per formare uno strato a cipolla di nuovo ossido solido sopra l’ossido esistente, producendo così particelle omogenee dense.

Figura 17: Reattore a letto fluido per l’ossidrolisi del cloruro ferroso
Ossidrolisi a spruzzo
In questo tipo di torre di ossidrolisi, la soluzione di cloruro ferroso è spruzzata in un recipiente cilindrico vuoto, mentre l’energia necessaria è fornita dal flusso ascendente di gas caldi generati nei bruciatori inferiori (Figura 18). I tostatori spray hanno grandi diametri per mantenere basse le velocità del gas. Se la velocità del gas è alta, troppe particelle vengono elutriate con l’off-gas, e la qualità del prodotto e l’efficienza del tostatore calano. L’off-gas e gli ossidi lasciano il tostatore in controcorrente a circa 400°C – 500°C. Il tempo di permanenza delle particelle spruzzate nella zona di reazione ad alta temperatura è molto breve; quindi, per atomizzazione si devono creare goccioline di liquido molto piccole, che possono essere riscaldate rapidamente. Il rapido riscaldamento porta alla formazione di una crosta di ossido solido sulla superficie di ogni gocciolina. Man mano che la massa della goccia si riscalda, il contenuto d’acqua si vaporizza e sfonda la crosta di ossido. Pertanto, l’ossido arrostito a spruzzo è composto da sfere cave molto fini e “soffici”.

Figura 18: Rigenerazione di HCl da una soluzione di cloruro ferroso per ossidrolisi in torrefattore a spruzzo
Produzione di titanio
Il titanio metallico è prodotto per clorazione di rutilo, rutilo sintetico, o scoria di titanio poi riduzione in un reattore metallotermico di TiCl4 da magnesio a titanio (figure 19 e 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
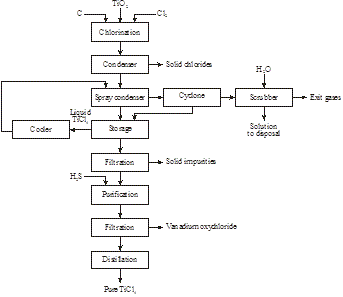
Figura19: Produzione di TiCl4 da rutilo, rutilo sintetico o scorie di titanio

Figura 20: Produzione di titanio da TiCl4
TiCl4 + Mg → Ti + MgCl2
Il cloruro di magnesio è poi elettrolizzato per recuperare il magnesio e il cloro da riciclare. La figura 21 mostra il reattore metallotermico rimosso dal forno dopo la riduzione da cui viene recuperata la spugna di titanio (figura 22).

Figura 21: Reattore metallotermico rimosso dal forno

Figura 22: Spugna di titanio (in alto) e MgCl2 (in basso) rimossi dal reattore
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) “Titanium”, pp. 1129-1179 in Handbook of Extractive Metallurgy edited by F. Habashi, published by WILEY-VCH, Weinheim, Germany.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) Un nuovo processo per aggiornare l’ilmenite al rutilo sintetico Conferenza dei metallurgisti, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Ristampato in Metall 69: 27-30
- Habashi F (1993) Duecento anni di titanio. Il trattamento dei minerali di titanio per la produzione di pigmenti e metalli. Arab Min J 11: 74-84