- Introduzione
- Materiali e metodi
- Partecipanti
- Risonanza magnetica
- Acquisizione ed elaborazione dei dati
- Estrazione dell’atlante
- Analisi statistica
- Risultati
- I pazienti con SCA3 hanno rivelato lesioni significative nelle regioni tipiche delle lesioni infratentoriali
- I pazienti con SCA3 hanno rivelato lesioni cerebrali lateralizzate sovratentoriali
- Discussione
- Conclusioni
- Data Availability Statement
- Ethics Statement
- Contributi degli autori
- Finanziamento
- Conflitto di interessi
- Riconoscimenti
- Materiale supplementare
Introduzione
L’atassia spinocerebellare tipo 3 (SCA3) è un disordine neurodegenerativo ereditario causato dall’espansione CAG nella regione codificante del cromosoma 14q32.1 (1, 2). Clinicamente, i pazienti con SCA3 presentano una sindrome cerebellare, parkinsonismo, andatura atassica, disartria, dismetria, nistagmo, neuropatia periferica, manifestazioni piramidali ed extrapiramidali (3-5). I pazienti con SCA3 soffrono anche di disturbi emotivi, come la depressione e l’ansia (6, 7). Queste disfunzioni di ordine superiore della SCA3 suggeriscono l’ulteriore coinvolgimento di strutture extracerebellari piuttosto che il modello convenzionale “olivopontocerebellare” di neurodegenerazione (8-12). Inoltre, il disturbo SCA3 è stato descritto come sindrome cognitiva affettiva cerebellare (CCAS) (6, 8).
Studi hanno utilizzato la tomografia a emissione di positroni (PET) e la tomografia computerizzata a emissione di fotoni singoli per identificare anomalie subcliniche nella corteccia cerebrale (13, 14). Tuttavia, questi studi hanno riportato l’interruzione della via cerebrocerebellare non può spiegare completamente il deterioramento cognitivo e affettivo nei pazienti con SCA3. Per esempio, i deficit visuospaziali nei pazienti con SCA3 sono marcatamente associati al lobo parietale e sono meno collegati al cervelletto. Pochi studi si sono concentrati sul ruolo delle regioni sopratentoriali nella SCA3. La quantificazione della degenerazione nelle regioni sopratentoriali può essere cruciale per valutare la disfunzione nei pazienti con SCA3. Negli studi di neuroimaging, misurare l’atrofia corticale regionale è fondamentale per valutare la sua associazione con il deterioramento cognitivo e la disfunzione emotiva.
Il tensore di diffusione (DTI) può facilitare la visualizzazione e la caratterizzazione della materia bianca (WM), e DTI è anche un metodo efficiente per lo studio della SCA3 (15). SCA3 era stato verificato come una malattia neurodegenerativa atrofia dominante WM (16). Studi precedenti hanno mostrato che i pazienti con SCA3 dimostrano diminuzioni di anisotropia frazionale (FA) nelle aree del cervelletto e del tronco cerebrale, ma aumenti di diffusività radiale (RD) nel cervelletto, tronco cerebrale, talamo e lobi frontali e temporali (17). Un altro studio DTI ha identificato la riduzione diffusa di FA nel bilaterale cerebral-frontale, -parietale, -temporale, e -occipitale WM; cerebellare WM; il talamo, e il tronco cerebrale in pazienti con SCA3 (16). Inoltre, gli aumenti di diffusività media (MD) sono stati rilevati in un modello simile, ampiamente sovrapposto in bilaterale cerebral-frontale, -parietale, -temporale e -occipitale WM; cerebellare WM; il talamo e il tronco cerebrale (16).
In questo studio, abbiamo valutato l’atrofia in regioni relativamente focali e spiegato il coinvolgimento sopratentoriale in SCA3. Questo studio ha utilizzato il metodo della dimensione frattale (FD), che ha il vantaggio di produrre risultati con una variazione minima (18), per quantificare i cambiamenti morfologici corticali e misurare l’atrofia corticale regionale delle regioni sopratentoriali. Nel presente studio, abbiamo misurato i valori 3D-FD dei 97 segmenti della materia grigia dall’intero cervello per ogni partecipante. Abbiamo inoltre confrontare questi risultati di lesioni della materia grigia con l’analisi DTI delle lesioni della materia bianca in SCA3 del nostro recente studio. Abbiamo anticipato che le regioni di lesioni GM valutate in questo studio sono correlate alle regioni di lesioni WM dallo studio DTI, e il risultato può verificare l’associazione tra compromissione motoria e atrofia delle regioni sopratentoriale nei pazienti con SCA3.
Materiali e metodi
Partecipanti
Un totale di 48 pazienti con SCA3 e 50 individui sani abbinati per sesso ed età, come gruppo di controllo, hanno partecipato a questo studio. Questo studio è stato condotto in conformità con la Dichiarazione di Helsinki ed è stato approvato dall’Institutional Review Board del Taipei Veterans General Hospital. Tutti i partecipanti hanno fornito il consenso informato scritto prima di partecipare a questo studio. Tutti i partecipanti sono stati reclutati dal Dipartimento di Radiologia del Taipei Veterans General Hospital. Il SARA (scala per la valutazione e la valutazione dell’atassia) è stato applicato per la valutazione clinica dell’atassia dei pazienti con SCA3 (19). I sintomi del progresso della malattia di Parkinson nella SCA3 sono stati misurati usando la stadiazione modificata di Hoehn e Yahr (20). Il punteggio SARA, che era una valutazione della gravità dei sintomi dell’atassia da 0 a 40, è stato usato come riferimento per indicare la progressione della gravità clinica rispetto alla degenerazione cerebellare. È stata acquisita da ogni paziente un’età d’esordio auto dichiarata, l’età in cui i pazienti hanno mostrato il primo segno di qualsiasi sintomo atassico (21). La lunghezza della ripetizione CAG di ogni paziente SCA3 è stata determinata dalla reazione a catena della polimerasi, come descritto in precedenza (22). La tabella 1 presenta i dati demografici, clinici e di imaging MR di entrambi i gruppi. I pazienti con SCA3 hanno soddisfatto i criteri di inclusione se avevano atassia progressiva e altrimenti inspiegabile e sono risultati positivi al genotipo SCA3. La durata della malattia nei pazienti con SCA3 era 8.89 ± 6.432 anni. Quelli del gruppo di controllo non avevano malattie del sistema nervoso centrale e non hanno mostrato alcuna anomalia neurologica durante il periodo di studio. Un esperto neuroradiologo ha esaminato le immagini T1- e T2-pesate del gruppo di controllo per garantire l’assenza di segni scoperti di un’altra malattia neurologica o anomalie inaspettate.
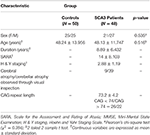
Tabella 1. Dati demografici, clinici e immagini RM del gruppo di controllo e del gruppo di pazienti.
Risonanza magnetica
Acquisizione ed elaborazione dei dati
Immagini RM assiali del cervello umano che coprono l’intero cervello e il cervelletto sono state acquisite utilizzando uno scanner Siemens Vision 1.5-T (Erlangen, Germania). I partecipanti sono stati scansionati con una bobina circolare polarizzata per ottenere immagini ponderate T1 (TR = 14.4 ms; TE = 5.5 ms; dimensione della matrice: 256 × 256; 1.5 mm fette assiali; FOV = 256 × 256 mm2; dimensione del voxel, 1.0 × 1.0 × 1.5 mm3, numero di fetta = 128). Le immagini T1 pesate acquisite di ogni partecipante sono state riformattate in un’immagine assiale e convertite in un formato di analisi dal software MRIcro (Chris Rorden, Università di Nottingham, UK; www.sph.sc.edu/comd/rorden/mricro.html). Figura 1 illustra il diagramma di flusso di elaborazione dei dati e analisi statistica. Per migliorare la precisione di estrazione del tessuto cerebrale, una funzione automatizzata skull-stripping è stato applicato ai volumi di immagine utilizzando lo strumento di estrazione del cervello nel software MRIcro (Figura 1B). I processi successivi sono stati eseguiti utilizzando DiffeoMap (Li, X.; Jiang, H.; e Mori, S.; Johns Hopkins University, www.MriStudio.org). In questa procedura, un 12-parametro trasformazione affine (23) è stato utilizzato per normalizzare ogni T1-weighted immagine verso il modello JHU_MNI_SS_T_ss T1.
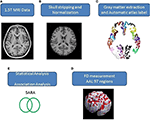
Figura 1. (A-E) Procedura del processo di immagine e analisi statistica.
Estrazione dell’atlante
I processi di dati di immagine sono stati eseguiti utilizzando il toolbox SPM8 (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, Londra, UK, http://www.fil.ion.ucl.ac.uk/spm/) e il toolbox IBASPM (Individual Brain Atlases utilizzando Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), sia eseguito utilizzando il software MATLAB 2010 (Mathworks, Natick, MA, USA).
La procedura prevede tre passaggi dopo la normalizzazione: (1) segmentazione dell’immagine normalizzata in materia grigia, materia bianca e liquido spinale cerebrale nello spazio nativo, (2) parcellizzazione della materia grigia in 116 regioni basate sull’etichettatura anatomica del Montreal Neurological Institute (MNI) atlante anatomico (24), e (3) trasformazione delle immagini di materia grigia nello spazio MNI e l’allineamento anatomico di ogni voxel di materia grigia alle 116 strutture automatiche etichetta anatomica utilizzando IBASPM (24), cerebro sinistro: 45 regioni, cerebro destro: 45 regioni, cervelletto: 26 regioni; (Figura 1C). Le 26 regioni del cervelletto sono state fuse in sette regioni secondo le loro strutture anatomiche, e i volumi delle 97 strutture cerebrali etichettate (45 per ogni emisfero cerebrale e sette per il cervelletto, Tabella supplementare 1) sono stati estratti per ogni persona (Figura 1C).
Il metodo FD è stato originariamente proposto da Mandelbrot per la quantificazione della complessità legata alla forma degli oggetti in un singolo valore numerico (25). Il metodo FD è usato per la misurazione topologica della complessità; un valore FD più alto rappresenta una maggiore complessità topologica del tessuto in studio (18, 26). Molti neurologi hanno dimostrato che il valore FD può servire come misura quantitativa per descrivere accuratamente la complessità morfologica del ripiegamento cerebrale (18, 26, 27). Poiché l’analisi FD si basa su una scala logaritmica, anche un piccolo aumento del valore FD può corrispondere a un notevole aumento della complessità (18). Questo studio ha adottato il metodo 3D box-counting per misurare i valori 3D-FD dei 97 segmenti di materia grigia dal cervello intero per ogni partecipante (Figura 1D). Uno studio correlato dettaglia l’algoritmo per il metodo box-counting (18).
Analisi statistica
Le differenze legate al sesso e all’età tra i gruppi sono state misurate utilizzando il test chi-quadro di Pearson (χ2 = 0.384, p = 0.535) e il t-test a 2 code a 2 campioni (p = 0.516), separatamente. La regressione lineare è stata applicata per rimuovere gli effetti dell’età e del sesso. Abbiamo adottato un t-test a 2 code per determinare se esisteva una differenza significativa tra i gruppi di controllo e di pazienti per quanto riguarda i valori 3D-FD di ogni regione corticale. La significatività dei risultati si è basata sul tasso di falsa scoperta (FDR-corretto p = 0,05) (28). L’entità dell’associazione tra il valore 3D-FD delle singole regioni cerebrali e le caratteristiche cliniche, come la durata della malattia e SARA, è stata determinata attraverso la misura r di Pearson (Figura 1E). Queste analisi sono state condotte utilizzando la Statistics Toolbox in MATLAB 2010.
Risultati
I pazienti con SCA3 hanno rivelato lesioni significative nelle regioni tipiche delle lesioni infratentoriali
I neuroradiologi esperti hanno riportato i risultati della risonanza magnetica per i pazienti con SCA3 (Tabella 1). La Figura 2 illustra il confronto dei valori 3D-FD in ogni lobo tra il gruppo sano e il gruppo SCA3. Globalmente, i pazienti con SCA3 esibito significativamente diminuito 3D-FD valori in ogni lobo, e il cervelletto è stato associato con la più sostanziale riduzione del valore 3D-FD (Figura 2). I valori 3D-FD della corteccia cerebellare di SCA3 hanno mostrato una correlazione significativa con i loro punteggi SARA (r = -0.3346; p = 0.023). Abbiamo ulteriormente parcellizzato la corteccia cerebrale e cerebellare in 97 regioni e quantificato l’atrofia in ogni regione parcellare. I pazienti con SCA3 avevano regioni tipiche lesioni infratentoriale, compresi i nuclei pontini, corteccia cerebellare, e olive inferiori. I dettagli dei valori 3D-FD significativamente diminuiti delle regioni di atrofia tra il gruppo sano e il gruppo SCA3 sono riassunti nella tabella 2.
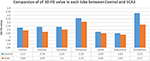
Figura 2. Confronto dei valori 3D-FD in ogni lobo tra il gruppo sano e il gruppo SCA3. Il valore 3D-FD in ogni lobo di SCA3 mostrato significativamente inferiore al gruppo di controllo. Il p-value di differenza significativa di cervelletto, lobo frontale, lobo parietale e lobo occipitale sono più piccoli di 0.01, e per altri lobi sono più piccoli di 0.05.
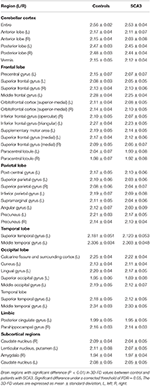
Tabella 2. Regioni atrofizzate significative nei pazienti con SCA3 (p < 0.05).
I pazienti con SCA3 hanno rivelato lesioni cerebrali lateralizzate sovratentoriali
Oltre alle lesioni infratentoriali, lesioni nelle regioni sovratentoriali sono state osservate anche in tutti i pazienti con SCA3. Hanno mostrato lesioni diffuse in 39 regioni cerebrali parcellari (p < 0,05), tra cui il lobo frontale, lobo parietale, lobo occipitale e lobo temporale. Hanno rivelato atrofia lateralizzata, e prevalentemente nell’emisfero sinistro (destra/sinistra: 12/27). Soprattutto nei lobi occipitali e temporali, i pazienti con SCA3 hanno rivelato valori 3D-FD significativamente diminuiti solo nell’emisfero sinistro. Le regioni atrofizzate significative nelle regioni frontali erano la corteccia premotoria (giro precentrale sinistro, giro frontale superiore bilaterale e giro frontale medio sinistro), corteccia motoria supplementare (area motoria supplementare sinistra) e corteccia motoria primaria (giro precentrale sinistro) (Figura 3).
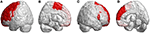
Figura 3. Regioni all’interno del lobo frontale che indicano valori 3D-FD più bassi nei pazienti con SCA3 rispetto ai controlli. (A) vista esterna sinistra, (B) vista interna sinistra, (C) vista esterna destra e (D) vista interna destra. I pazienti con SCA3had valori 3D-FD significativamente diminuito nelle regioni frontali, tra cui la corteccia premotoria (giro precentrale sinistro, bilaterale giro frontale superiore, e sinistra-medio giro frontale), corteccia motoria supplementare (area motoria supplementare sinistra), e corteccia motoria primaria (giro precentrale sinistro). Altre regioni atrofizzate sono state osservate nel giro frontale inferiore sinistro (opercolare), giro frontale inferiore sinistro (triangolare), corteccia orbitofrontale bilaterale (superiore-1 mediale), giro frontale superiore bilaterale (mediale), e lobulo paracentrale bilaterale nei pazienti con SCA3. Tutte le regioni significativamente diminuite 3D-FD valori sono illustrati in rosso.
Altre regioni atrofizzate erano nel giro frontale inferiore sinistro (opercolare), giro frontale inferiore sinistro (triangolare), corteccia orbitofrontale bilaterale (superiore-mediale), giro frontale superiore bilaterale (mediale), e lobulo paracentrale bilaterale. Nel lobo parietale, valori FD diminuiti sono stati rilevati nel giro postcentrale sinistro, giro sopramarginale sinistro, giro angolare sinistro, giro parietale superiore bilaterale e precuneo bilaterale di pazienti con SCA3 (Figura 4).
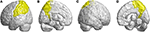
Figura 4. Regioni all’interno del lobo parietale che indicano una diminuzione del valore 3D-FD in pazienti con SCA3 rispetto ai controlli. (A) vista esterna sinistra, (B) vista interna sinistra, (C) vista esterna destra e (D) vista interna destra. Rispetto ai controlli, i pazienti con SCA3had valori 3D-FD significativamente più bassi nel giro postcentrale sinistro, giro sopramarginale sinistro, giro angolare sinistro, giro parietale superiore bilaterale, e precuneo bilaterale del lobo parietale. Tutte le regioni significativamente diminuito 3D-FD valori sono illustrati in giallo.
Nel lobo occipitale, SCA3 pazienti rivelato valori FD significativamente più bassi nella fessura calcarina e la corteccia circostante, cuneus, giro linguale, e il superiore e medio giro occipitale nell’emisfero sinistro (Figura 5A, colore blu). Nel lobo temporale, le regioni con valori FD diminuiti erano in sinistra-superiore temporale e sinistra-medio giro temporale dei pazienti con SCA3 (Figura 5A, colore viola). I valori 3D-FD nel giro cingolato sinistro-posteriore della regione limbica erano anche significativamente diminuito nei pazienti con SCA3 (Figure 5B,D, colore verde). Regioni di atrofia significativa sono stati osservati nei gangli della base, tra cui il nucleo caudato bilaterale e putamen sinistra, nei pazienti con SCA3 (Figure 5B,D, colore blu acqua). Nel lobo occipitale destro-esterno, non sono state osservate regioni atrofizzate significative nei pazienti con SCA3 (Figura 5C).
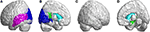
Figura 5. Regioni all’interno del lobo occipitale, lobo temporale e lobo sottocorticale che indicano valori 3D-FD significativamente inferiori nei pazienti con SCA3 rispetto ai controlli. (A) vista esterna sinistra, (B) vista interna sinistra, (C) vista esterna destra e (D) vista interna destra. Le regioni blu mostrano valori 3D-FD significativamente più bassi nel lobo occipitale, compresa la fessura calcarina e la corteccia circostante, cuneus, e giro linguale e il giro occipitale superiore e medio nell’emisfero sinistro. Le regioni viola denotano valori 3D-FD più bassi nel giro temporale superiore sinistro e nel giro temporale medio sinistro. Le regioni blu acqua rappresentano valori 3D-FD più bassi nelle regioni sottocorticali, tra cui il caudato bilaterale e il putamen sinistro. Le regioni verdi rappresentano valori 3D-FD significativamente più bassi nel giro cingolato posteriore sinistro e nel giro paraippocampale del sistema limbico.
Nella Figura 6, abbiamo trovato molte regioni cerebrali atrofizzate incluso cervelletto, cerebellare-talamocorticale, e gangli della base-alamocorticale circuiti di collegamento che implicano i pazienti con SCA3 rivelato cerebellare-talamocorticale e gangli della base-alamocorticale danneggiato in questi percorsi.

Figura 6. SCA3 è coinvolto in entrambi i percorsi cerebellare-talamocorticale e ganglia basale-talamocorticale. (A) vista esterna sinistra, (B) vista interna sinistra, (C) vista esterna destra e (D) vista interna destra. Nel ciclo cerebellare-talamocorticale, i pazienti con SCA3 mostrano valori 3D-FD significativamente più bassi nella corteccia cerebellare, premotoria e motoria supplementare. I valori 3D-FD diminuiti nella corteccia cerebellare e in altre regioni cerebrali legate al motore nei pazienti con SCA3 forniscono una spiegazione per la presenza di sintomi clinici. Nel ciclo ganglia basale-talamocorticale, i pazienti con SCA3 mostrano valori 3D-FD significativamente più bassi nella corteccia frontale, corteccia motoria primaria, putamen e caudato. Questi risultati rivelano cambiamenti morfologici nel ciclo ganglia basale-talamocorticale in pazienti con SCA3.
Discussione
Clinicamente, i pazienti con SCA3 mostrano la sindrome cerebellare e parkinsonismo (3-5). Le regioni atrofizzate della corteccia infratentoriale e sopratentoriale elencate nella tabella 2, e hanno mostrato una vasta gamma di aree sovrapposte come in due regioni funzionali, vale a dire la corteccia legata al cervelletto (CB-related) (29) e la corteccia legata ai gangli della base (BG-related) (30). La corteccia CB-correlata include il cervelletto, prefrontale, cortecce sensorimotorie, corteccia prefrontale e lobo temporale, e la corteccia BG-correlata include corteccia motoria primaria, area motoria supplementare, corteccia premotoria e gangli della base. I nostri risultati hanno rivelato coerente con precedenti studi di neuroimaging convenzionale che il cervelletto è la regione più colpita e atrofizzata in pazienti con SCA3 (4, 31, 32). Inoltre, il valore 3D-FD nella corteccia cerebellare dei pazienti con SCA3 aveva una correlazione significativamente negativa con i punteggi SARA (r = -0.3346; p = 0.023) come Rezende et al. aveva mai segnalato (33).
Nelle regioni infratentoriale, i pazienti con SCA3 avevano una significativa diminuzione dei valori 3D-FD in putamen e caudato. Studi neuropatologici hanno dimostrato la perdita neuronale nel putamen e nel caudato, che può portare all’atrofia dei gangli della base in associazione al parkinsonismo (34). Le caratteristiche parkinsoniane sono il fenotipo prevalente della mutazione SCA3 e sono solitamente accompagnate da sintomi dei gangli della base (35-37). Negli studi necroscopici, il coinvolgimento dei gangli della base è comune nei pazienti con SCA3. L’imaging funzionale con studi PET ha anche dimostrato un precoce declino funzionale del caudato e del putamen in pazienti con SCA3. Inoltre, i pazienti con SCA3 avevano un volume significativamente più piccolo dei gangli della base (35). Tuttavia, gli studi correlati si sono concentrati solo sui gangli della base e regioni infratentoriale. In Figura 6, abbiamo verificato che SCA3 può non solo avere le lesioni dei gangli della base, ma anche il cerebellare-talamocorticale e gangli della base-tra le vie talamocorticali danni.
I pazienti con SCA3 mostrano significativamente diminuito 3D-FD valori della corteccia premotoria e corteccia motoria supplementare nel loro ciclo cerebellare-talamocorticale. La corteccia premotoria e l’area motoria supplementare sono associate al controllo del movimento, come la forza muscolare e la direzione di raggiungimento. I danni in queste regioni possono indurre atassia dell’andatura, della posizione e degli arti, oltre alla decomposizione del movimento (38, 39). I ridotti valori 3D-FD della corteccia cerebellare e di altre regioni cerebrali legate al motore nei pazienti con SCA3 possono spiegare la presenza di sintomi clinici. Inoltre, nel ciclo ganglia basale-talamocorticale, i pazienti con SCA3 mostrano valori 3D-FD significativamente diminuiti nella corteccia frontale e motoria primaria. La corteccia motoria primaria è anche una destinazione importante per l’output dei gangli della base (40). Disturbi del ciclo gangli della base-alamocorticale possono anche contribuire alla disfunzione motoria parkinsoniana (41). I risultati di questo studio sottolineano i cambiamenti morfologici nel ciclo ganglia basale-talamocorticale in pazienti con SCA3, che i precedenti studi di neuroimaging non sono riusciti ad affrontare.
Di recente, abbiamo usato tensore di diffusione (DTI) per misurare la diffusione molecolare dell’acqua della materia bianca (WM) alterazione in SCA3 (15). Abbiamo trovato SCA3 rivelato diffuse lesioni della materia bianca nel bilaterale cerebral-frontale, -parietale, -temporale, e -occipitale WM; cerebellare WM; il talamo, e il tronco cerebrale. Identicamente, in questo studio abbiamo osservato la SCA3 ha mostrato quasi nelle stesse regioni parcellate di queste lesioni WM che hanno rivelato lesioni GM. Questi risultati attuali confermano il coinvolgimento delle regioni sopratentoriale in pazienti con SCA3. Braga et al. hanno riportato risultati simili, dimostrando che SCA3 causa CCAS attraverso la compromissione delle funzioni esecutive, fluidità verbale, ragionamento astratto, e la memoria di lavoro (8). In studi neuropatologici, è stato rivelato che la CCAS deriva dall’interruzione del circuito cerebellare, che è associato alle cortecce prefrontale, parietale superiore, temporale superiore e limbica (42, 43). Gli studi hanno confermato il ruolo del cervelletto nella funzione cognitiva; tuttavia, le funzioni cognitive, affettive e visuospaziali sono direttamente associate alla degenerazione corticale. Le aree significativamente atrofizzate delle regioni sopratentoriali nei pazienti con SCA3 erano più estese delle regioni associate a CCAS. L’atrofia della corteccia sopratentoriale può essere il fattore primario associato alla disfunzione delle regioni legate all’atassia e al parkinsonismo. Questi risultati suggeriscono che la SCA3 non dovrebbe più essere considerata una malattia limitata al cervelletto e alle sue connessioni; piuttosto, dovrebbe essere considerata una patologia che colpisce tutto il cervello.
Tuttavia, questo studio aveva ancora alcuni limiti. Le principali limitazioni di questo studio sono la mancanza di valutazioni cognitive specifiche e di parametri clinici per valutare la CCAS nella SCA. Ulteriori indagini sono garantite per quanto riguarda la correlazione tra i risultati attuali e i dati clinici, come i dati di risonanza magnetica funzionale. Questo può contribuire a fornire un metodo più preciso per valutare l’associazione tra cognitivo con coinvolgimento motorio e atrofia regionale in pazienti con SCA3.
Conclusioni
In questo studio, abbiamo usato il metodo 3D-FD per quantificare le variazioni morfologiche regionali in pazienti con SCA3 e valutare l’associazione tra atrofia sopratentoriale e coinvolgimento motorio in pazienti con SCA3. I nostri risultati hanno trovato una significativa degenerazione della corteccia cerebrale in regioni specifiche, che forse sono legate al cervelletto o ai gangli della base. I nostri risultati potrebbero essere correlati ai sintomi comuni della SCA3, come atassia, parkinsonismo, disartria e dismetria. La SCA3 non dovrebbe più essere considerata una malattia limitata al cervelletto e alle sue connessioni; piuttosto, dovrebbe essere considerata una patologia che colpisce tutto il cervello.
Data Availability Statement
Tutti i set di dati generati per questo studio sono inclusi nell’articolo/Supplementary Material.
Ethics Statement
Gli studi che coinvolgono partecipanti umani sono stati rivisti e approvati dall’Institutional Review Board del Taipei Veterans General Hospital. I pazienti/partecipanti hanno fornito il loro consenso informato scritto per partecipare a questo studio.
Contributi degli autori
P-SW e Y-TW hanno organizzato il progetto di ricerca, rivisto e criticato il manoscritto. T-YW ha scritto il manoscritto. H-MW ha avuto accesso ai dati della ricerca. B-WS ha organizzato la ricerca ed eseguito la raccolta dei dati. C-WJ ha eseguito l’analisi statistica, ha scritto e rivisto il manoscritto.
Finanziamento
Questo studio è stato finanziato dal Ministero della Scienza e della Tecnologia, Taiwan (MOST108-2634-F-010-002); National Health Research Institutes, Taiwan (NHRI-EX106-10526EI); National Yang-Ming University e Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori desiderano ringraziare tutti gli individui che hanno partecipato a questo studio e ringraziano Wallace Academic Editing per l’editing di questo manoscritto.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. Espansioni CAG in un nuovo gene per la malattia di Machado-Joseph al cromosoma 14q32.1. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: caratteristiche neurologiche, patogenesi e modelli animali. Cerebellum. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Progressi clinici e molecolari nelle atassie cerebellari autosomiche dominanti: dal genotipo al fenotipo e fisiopatologia. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autosomal dominant cerebellar ataxias: caratteristiche cliniche, genetica e patogenesi. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. disfunzione cognitiva progressiva in atassia spinocerebellare tipo 3. Movimento Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Sindrome cognitiva affettiva cerebellare nella malattia di Machado Joseph: caratteristiche cliniche fondamentali. Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. esecutivo e disfunzione emotiva nella malattia di Machado-Joseph. Movimento Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Disfunzione cognitiva in atassia spinocerebellare tipo 3: topografie e modelli variabili. Movimento Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. danno neuronale diffuso e disfunzione cognitiva in atassia spinocerebellare tipo 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Risposta a: disfunzione cognitiva in atassia spinocerebellare tipo 3: topografie e modelli variabili. Movimento Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Base anatomica delle interazioni cognitivo-emotive nella corteccia prefrontale dei primati. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. atrofia neocorticale nella malattia di Machado-Joseph: uno studio longitudinale di neuroimaging. J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Soong BW, Liu RS. Tomografia a emissione di positroni in portatori asintomatici del gene della malattia di Machado-Joseph. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamina trasportatore tomografia a emissione di positroni nelle atassie spinocerebellari tipo 1, 2, 3 e 6. Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Risonanza magnetica del tensore di diffusione per differenziare l’atrofia cerebellare del sistema multiplo tipo e l’atassia spinocerebellare tipo 3. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. Danno della materia bianca è legato alla gravità dell’atassia in SCA3. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. Una valutazione multimodale del danno microstrutturale della materia bianca nell’atassia spinocerebellare di tipo 3. Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Analisi della dimensione frattale per quantificare il cambiamento morfologico cerebellare di atrofia del sistema multiplo di tipo cerebellare (MSA-C). NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Scala per la valutazione e il rating di atassia. Sviluppo di una nuova scala clinica. Neurologia. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Hoehn MM, Yahr MD. Parkinsonismo: insorgenza, progressione e mortalità. Neurologia. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Risultati neurologici nella malattia di Machado-Joseph: relazione con la durata della malattia, sottotipi e (CAG)n. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Analisi di frequenza delle atassie cerebellari autosomiche dominanti in pazienti taiwanesi e caratterizzazione clinica e molecolare di atassia spinocerebellare tipo 6. Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Registrazione automatica delle immagini: I. Metodi generali e convalida intrasoggetto, intramodalità. J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Automatizzato etichettatura anatomica delle attivazioni in SPM utilizzando una parcellizzazione anatomica macroscopica del cervello MNI MRI singolo soggetto. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Frattali: Forma, Caso e Dimensione. San Francisco, CA: Freeman (1977). p. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Dimensione frattale e cambiamenti della materia bianca nella sclerosi multipla. NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Dimensione frattale della superficie corticale cerebrale in schizofrenia e disturbo ossessivo-compulsivo. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Controllo del tasso di falsa scoperta: un approccio pratico e potente ai test multipli. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Indagine anatomica delle proiezioni alla base pontis dalle cortecce di associazione parietali posteriori nella scimmia rhesus. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Amplificazione selettiva utilizzando un modello di contrazione dei gangli basali. Pont A Mousson: NeuroComp (2006). p. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomal dominant cerebellar ataxia di tipo I caratteristiche cliniche e MRI in famiglie con SCA1, SCA2 e SCA3. Cervello. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Risonanza magnetica nelle atassie spinocerebellari. Cerebellum. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Coinvolgimento della corteccia cerebrale nella malattia di Machado-Joseph. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. Il fenotipo parkinsoniano di atassia spinocerebellare tipo 3 in una famiglia taiwanese. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Atassia cerebellare autosomica dominante di tipo I. Volumetria basata su MRI delle strutture della fossa posteriore e dei gangli della base nei tipi 1, 2 e 3 di atassia spinocerebellare. Cervello. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. Intrafamiliare variabilità del fenotipo Parkinson in SCAs: nuovi casi a causa di espansioni SCA2 e SCA3. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Fenotipo parkinsoniano nella malattia di Machado-Joseph (MJD/SCA3): un rapporto di due casi. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Principi di scienza neurale. New York, NY: McGraw-Hill (1991). p. 626-46.
Google Scholar
39. Asbury AK, McKhann GM. Malattie del sistema nervoso: Neurobiologia clinica. Philadelphia, PA: W.B. Saunders (1992). p. 319-341.
40. Hoover JE, Strick PL. Canali di uscita multipli nei gangli della base. Scienza. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Analisi quantitativa della perdita dopaminergica in relazione ai territori funzionali nelle scimmie trattate con MPTP. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Atassia spinocerebellare tipo 3 (SCA3): neurodegenerazione talamica si verifica indipendentemente da inclusioni intranucleari neuronali talamiche ataxin-3 immunopositive. Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Affetto coerente del sistema somatosensoriale centrale in atassia spinocerebellare tipo 2 e tipo 3 e il suo significato per i sintomi clinici e terapia riabilitativa. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar