- Introduzione
- Materiali e metodi
- Apparecchiature e sistemi di controllo
- Il sistema TPD
- Preparazione del campione
- Procedura sperimentale
- Evacuazione
- Analisi del gas residuo
- Raffreddamento
- Adsorbimento
- Desorbimento
- Molecole adsorbite
- Risultati e discussione
- Impronta del desorbimento/decomposizione della cellulosa
- TPD-Spectra
- Desorbimento dell’n-decano
- Desorbimento del metanolo deuterato
- Conclusioni
- Contributi degli autori
- Conflict of Interest Statement
- Acknowledgments
- Materiale supplementare
Introduzione
La discussione sui benefici rispetto al costo ambientale dei materiali da imballaggio è costante. In quest’epoca di sempre maggiore consapevolezza ambientale, i clienti spesso premiano l'”essere verdi” e la carta occupa saldamente un posto in prima linea nella questione.
Tuttavia, per essere utilizzata come materiale da imballaggio per alimenti, la carta deve soddisfare una serie di requisiti. Da un lato le molecole di aroma devono rimanere all’interno del cibo e dall’altro lato la confezione è messa per proteggere il cibo da influenze ambientali come l’ossigeno o le molecole organiche che potrebbero innescare la maturazione o produrre sapori marci. Essendo la carta un materiale poroso, una caratteristica chiave è il trasporto delle molecole attraverso la struttura porosa per ottenere una visione e un controllo sulle questioni sopra menzionate. Una delle domande a cui rispondere in questo contesto è la misura in cui le molecole si adsorbono sulle pareti dei pori. Questo rende gli studi di adsorbimento delle molecole sulle superfici cellulosiche ancora più essenziali.
La ricerca in letteratura rivela un numero sostanziale di studi sui materiali cellulosici allo stato umido per rimuovere gli inquinanti dall’acqua (vedi ad esempio, Voisin et al., 2017). Inoltre, l’adsorbimento di polielettroliti su polpe è stato studiato intensamente (vedi ad esempio Li et al., 2003; Neumann et al., 2018). L’adsorbimento di molecole più piccole ha attirato meno attenzione, come è stato dimostrato in una recente revisione (Lombardo e Thielemans, 2019). L’adsorbimento di composti aromatici sulla cellulosa è stato studiato da Perez et al. (2004). L’adsorbimento del benzofenone è stato studiato da Mazeau e Vergelati (2002) e quello del rosso Congo da Mazeau e Wyszomirski (2012). L’adsorbimento di naftalina e pirene è stato studiato da Tozuka et al. (1998, 2002). L’adsorbimento dell’urea è stato studiato da Chen et al. (2017), per citare solo alcuni esempi. Tuttavia, questi articoli non sono rilevanti per il campo dell’imballaggio alimentare. Stiamo quindi studiando specificamente l’adsorbimento di piccole molecole dalla fase gassosa su superfici cellulosiche. In questo contesto, l’assorbimento dinamico del vapore è stato ampiamente studiato (vedi ad esempio Xie et al., 2011). Di solito questi studi si svolgono in condizioni di equilibrio. Quando l’adsorbimento di piccole molecole avviene in imballaggi di carta, è improbabile che si applichino condizioni di equilibrio. Noi proponiamo piuttosto di studiare l’adsorbimento di piccole molecole in condizioni di alto vuoto lontano dall’equilibrio. Sfortunatamente, tali misure sono impossibili utilizzando campioni di carta, poiché la carta non può essere riscaldata direttamente in una camera a vuoto. Questo è il motivo per cui dobbiamo impiegare un sistema modello, nel nostro caso film sottili di cellulosa. Nonostante il fatto che tali film sottili di cellulosa sono prodotti dalla cellulosa II invece che dalla cellulosa I, che si trova nella carta, è stato dimostrato che questi film sono un utile sistema modello sostitutivo della carta (Rohm et al., 2014). Pellicole sottili di cellulosa sono state anche utilizzate in precedenza come substrati per l’adsorbimento dell’acqua (vedi ad esempio, Niinivaara et al., 2015, 2016; Hakalahti et al., 2017) e l’adsorbimento dello zucchero (Hoja et al, 2014).
In questo studio presentiamo i primi studi di adsorbimento ad alto vuoto e spettroscopia di desorbimento programmato in temperatura di n-decano e metanolo deuterato su film sottili di cellulosa.
Materiali e metodi
Apparecchiature e sistemi di controllo
– Pompa rotativa a palette:
Leybold TRIVAC D 25 B
– Pompa molecolare turbo & sistema di controllo:
Oerlikon Leybold Vacuum, Turbovac tipo TMP151 & Turbo.Drive TD20 classic
– Spettrometro di massa quadrupolo & software di controllo:
Balzers Prisma tipo QME 200 (CF DN40) & Quadstar 32-Bit
– Alimentazione:
Sistema di alimentazione DC HP 6261B
– Sistema di controllo della temperatura
Controllo PID (Proporzionale-Integrale-Derivativo) in National Instruments LabVIEW 7.0
– Sistema di controllo di Bayard-Alpert gauge &:
Leybold AG IE 414 (CF DN40) & IONIVAC IM 520
– Valvola ad angolo manuale
Balzers EVA 025 H (KF DN25)
– Valvola di immissione del gas
Valvola di dosaggio del gas sotto vuoto Pfeiffer EVN 116 (KF DN16)
– Connettore metallo-vetro condannato:
GMA-KF16-KGD-152-TD13 (KF DN16).
Il sistema TPD
La camera del vuoto principale è un incrocio a sei vie in acciaio inossidabile. Il sistema di pompaggio consiste in una pompa turbo molecolare, attaccata al lato inferiore della camera principale (vedi Figura 1), seguita da una pompa rotativa a palette non mostrata in Figura 1. Lo spettrometro di massa quadrupolo e il misuratore di Bayard-Alpert sono montati sul lato sinistro e sul lato destro della camera. La valvola di ingresso del gas è attaccata al lato posteriore e collegata a un contenitore di vetro che contiene le molecole organiche liquide (vedi Figura 1 vista posteriore).
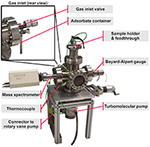
Figura 1. TPD-System, panoramica.
Il lato superiore dell’incrocio a sei vie è esteso da un adattatore a una copertura flangiata CF DN63, che è fissata da una catena di morsetti CF rapida che fornisce un cambio di campione più veloce. Il coperchio della flangia offre due passaggi elettrici e uno per la termocoppia, così come un foro nel corpo di rame del dito di raffreddamento. Il dito di raffreddamento, un pezzo di rame cilindrico cavo, è montato sul lato interno di questa copertura flangiata, che si estende fino al centro della camera, fondendosi in un pezzo finale appiattito, in seguito denominato “portacampione” (Figura 2). Due banchi portacampioni sono attaccati a questa piattaforma isolati da distanziatori in ossido di alluminio, che forniscono isolamento elettrico e conduzione del calore.

Figura 2. Il supporto del campione del sistema TPD, vista dall’alto e vista laterale.
Il substrato del campione stesso è una piastra di acciaio inossidabile di 1 × 1 cm con due fili Ta per il riscaldamento a resistenza e una termocoppia di tipo K, saldata a punti sulla sua parte posteriore. Il substrato è montato bloccando i fili di riscaldamento nei banchi portacampione, che sono collegati al passante elettrico da cavi di rame.
Nella sezione centrale, il dito di raffreddamento tiene anche due mini connettori di termocoppia in ossido di alluminio, che sono collegati insieme. Mentre il mini connettore superiore è permanentemente collegato al passante della termocoppia del coperchio della flangia, il connettore inferiore funge da morsetto per i fili della termocoppia provenienti dalla parte posteriore del campione (vedi Figura 2).
Al fine di aumentare il flusso di gas alla superficie del campione, un tubo di ingresso del gas, che è collegato alla valvola di ingresso del gas (vedi Figura 3), punta alla superficie del campione con un angolo di circa 35° e termina ad una distanza di circa 3 cm dalla superficie del campione. Lo spettrometro di massa è posizionato esattamente di fronte alla superficie del campione alla stessa distanza.

Figura 3. Geometria interna della camera a vuoto.
Preparazione del campione
Il campione viene preparato con la stessa procedura standard proposta da Kontturi et al. (2003) e Rohm et al. (2014), con il substrato rivestito da un sottile film di cellulosa. La cellulosa in questione è la trimetilsililcellulosa (TMSC) con un grado di sostituzione di circa 2,8 (Thüringisches Institut für Textil-und Kunstoff-Forschung e.V. (TITK), Germania) e sciolta in toluene con una concentrazione di circa 1 mg/ml. La soluzione risultante viene colata a gocce sulla superficie metallica lucida del campione e asciugata all’aria. Successivamente, una goccia di HCl al 10% viene posta in una piastra di Petri e il campione viene messo proprio accanto alla goccia di HCl. Il piatto, compresa la configurazione del campione, viene poi coperto con un foglio di alluminio e lasciato reagire per 15 minuti.
Secondo Konturri e Djak questa procedura porta a un film di cellulosa completamente rigenerato con uno spessore di circa 50 nm (Kontturi et al., 2003; Djak et al., 2011). Le misurazioni FTIR dei film non hanno trovato alcuna vibrazione indotta dal trimetilsilicio nei film di cellulosa pura. La massa 73 tuttavia è stata trovata nel desorbimento termico che potrebbe corrispondere al frammento trimetilsilico. La quantità di TMSC residuo si trova quindi al di sotto del limite di rilevamento FTIR (~1 × 1013 molecole) e al di sopra del limite di rilevamento della spettroscopia di massa. Lo spessore del film di diversi altri campioni è stato misurato anche tramite AFM. In seguito questi campioni AFM non sono stati più utilizzati per gli esperimenti di desorbimento per evitare l’influenza dei graffi causati dalle misure di spessore AFM sul comportamento di desorbimento.
I film sono completamente amorfi; per questo non ci aspettiamo di vedere una struttura porosa in essi. Durante le indagini AFM di tali film (Ganser et al., 2014, 2016; Rohm et al., 2014) non è stata trovata alcuna indicazione di pori. Questo indica che la densità dovrebbe essere vicina a quella della cellulosa rigenerata. Tuttavia, la porosità e la densità delle pellicole non sono state misurate all’interno di questo studio.
Procedura sperimentale
Evacuazione
Il campione è montato nei banchi portacampioni e la termocoppia è collegata (vedi sopra). Il portacampione viene inserito nella camera a vuoto e viene avviato il monitoraggio della temperatura. Il coperchio della flangia viene fissato con la catena rapida CF clamp e la camera a vuoto viene evacuata alla pressione di base di circa 5 × 10-9 mbar. A causa dei filamenti dello spettrometro di massa e del misuratore di Bayard-Alpert, la temperatura del campione all’interno della camera a vuoto è di 55°C mentre viene eseguita l’evacuazione.
Analisi del gas residuo
Si esegue un’analisi del gas residuo registrando uno spettro di massa da massa 1 a massa 100 (un tale spettro di massa è mostrato nelle informazioni di supporto (SI Figura 1) per la valutazione delle condizioni di partenza e della qualità del vuoto.
Raffreddamento
Azoto liquido (N2(l)) viene ora riempito ripetutamente nel dito di raffreddamento. Una volta raggiunta la temperatura di base preimpostata del campione (-80°C), essa viene mantenuta da un moderato riscaldamento a resistenza controllato da PID (Proporzionale-Integrale-Derivativo) e da un ulteriore raffreddamento con N2(l) secondo necessità.
Adsorbimento
La valvola di ingresso del gas viene ora aperta con attenzione. A causa della pressione del vapore a temperatura ambiente delle molecole organiche all’interno del contenitore dell’adsorbato, il vapore viene dosato nella camera del vuoto. Il campione viene mantenuto a -80°C durante l’adsorbimento. La valvola viene regolata fino a quando l’afflusso delle molecole organiche gassose e il pompaggio della pompa turbo molecolare si livellano a una pressione di stato costante di 5 × 10-6 mbar. Questa pressione viene poi mantenuta per un tempo di adsorbimento specificato di 6 minuti. Dopo questo tempo la valvola di ingresso del gas viene chiusa rapidamente, e la pressione della camera ritorna alla pressione di base.
Desorbimento
Ci vuole circa 1 min per raggiungere la pressione di base e il processo di desorbimento termico viene avviato da -80°C. Il regolatore PID riscalda il campione con una velocità di riscaldamento di 1°C/s fino al limite superiore di temperatura di 600°C. Durante il desorbimento i segnali di intensità delle masse preimpostate sono continuamente registrati in relazione al tempo dallo spettrometro di massa. Allo stesso tempo la temperatura del campione viene registrata in funzione del tempo. Ogni intensità di massa viene poi reimpostata in funzione della temperatura. Questo rappresenta un setup abbastanza tipico per le misure TPD (vedi ad esempio, Hohenegger et al., 1998).
Siccome solo un numero limitato di intensità di massa può essere registrato in una riga, ogni massa rappresenta un frammento caratteristico di una molecola partecipante: massa 57 per n-decano, massa 34 per metanolo deuterato (D3COD), massa 44 per CO2, e massa 18 per H2O. Mentre le prime due masse sono caratteristiche della specie adsorbita, le ultime due masse sono caratteristiche del desorbimento della cellulosa.
Molecole adsorbite
Le molecole di aroma sono di solito molecole organiche con una pressione di vapore piuttosto alta. Si possono incontrare sia molecole di aroma polari che non polari. Per avere una prima idea del comportamento di adsorbimento di tali molecole su un film sottile di cellulosa, abbiamo usato n-decano come molecola non polare e metanolo deuterato (D3COD) come molecola polare. Entrambe le molecole sono state ottenute in grado p.a. da Sigma Aldrich (metanolo deuterato ≥99%, purezza isotopica ≥99.8 atom % D, n-decano ≥99.5 %) e sono stati puliti in situ attraverso diversi cicli di congelamento e scongelamento. La massa molecolare di n-decano è 142 amu e la pressione di vapore a 30 ° C è 3,17 hPa, che si è rivelato sufficiente per l’adsorbimento. Poiché lo spettrometro di massa quadrupolare utilizzato ha una massa massima di 100 amu, abbiamo dovuto cercare la massa 57 per l’n-decano. Alla fine, questo è stato anche il picco più alto nello spettro di massa dell’n-decano. La massa 57 è anche di intensità piuttosto bassa nello spettro di massa del film di cellulosa desorbente. Lo spettro di massa di n-decano può essere trovato nelle informazioni di supporto (SI Figura 2). Lo spettro di massa del n-decano è rimasto invariato nel tempo e non mostra alcuna evidenza di contaminazione con idrocarburi inferiori. Tuttavia, tracce di contaminazione da nonano e ottano non possono essere completamente escluse.
La massa molecolare del metanolo deuterato è 36 amu. Il picco più alto nello spettro di massa del metanolo deuterato è a 34 amu. Nelle nostre misure TPD abbiamo usato questa massa come indicatore in quanto non interferisce con lo spettro di massa del film di cellulosa desorbente né con l’n-decano. Lo spettro di massa del metanolo deuterato durante l’esposizione può essere trovato nelle informazioni di supporto (SI Figura 3) pure. La pressione di vapore del metanolo deuterato a 20°C è 129 hPa.
Risultati e discussione
Le molecole esposte non solo adsorbono sulla pellicola di cellulosa, perché l’adsorbimento avviene attraverso la fase gassosa. Pertanto, è stata condotta una serie di esperimenti in cieco per garantire che gli effetti riscontrati derivino solo dalle pellicole di cellulosa. Nel regime cieco sono stati testati i film di substrato pulito con e senza adsorbimento di n-decano e metanolo deuterato. Questi tre esperimenti mostrano chiaramente picchi di desorbimento diversi da quelli presentati qui. Senza l’adsorbimento preliminare di gas sulle pellicole di cellulosa si trovano (vedi Figura 4) diversi frammenti che si desorbono nello stesso intervallo di temperatura come mostrato dagli spettri TPD qui sotto.
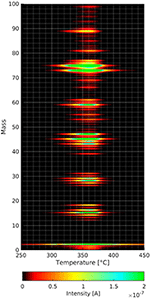
Figura 4. Spettri di massa in funzione della temperatura della decomposizione e del desorbimento del film di cellulosa. Le intensità delle diverse masse sono legate al codice colore.
Impronta del desorbimento/decomposizione della cellulosa
La figura 4 mostra il risultato di un esperimento TPD con un film di cellulosa senza precedente adsorbimento di gas. Nel grafico tridimensionale si può vedere che l’intensità massima dei frammenti di desorbimento della cellulosa si verifica a circa 360°C. Questa è una temperatura inferiore a quella degli altri spettri TPD mostrati in seguito. La velocità di riscaldamento nel suddetto esperimento è solo 0,1°C/s contro 1°C/s in tutti gli altri esperimenti. La velocità di riscaldamento più bassa è diventata necessaria perché l’acquisizione di uno spettro di massa completo da 0 a 100 amu richiede molto più tempo rispetto alle 4 masse individuali negli altri esperimenti mostrati in seguito.
Si può vedere nella Figura 4 che sia la massa 18 che la massa 44 si desorbono durante la decomposizione e il desorbimento della cellulosa. I picchi di desorbimento più intensi sono alle masse 73 e 75 amu. Mentre il picco alla massa 73 si adatta al gruppo trimetilsilico, non si può spiegare la massa 75 usando questo gruppo poiché l’isotopo Si con massa 30 ha solo un’occorrenza del 3% circa. In questo contesto, la massa 75 potrebbe anche derivare dalla frammentazione di specie più grandi che non siamo in grado di rilevare a causa della limitazione di massa (massa 100) dello spettrometro di massa utilizzato. Si possono vedere diversi cluster di masse con una distanza di circa 10 amu, che è una caratteristica comune degli spettri di massa delle molecole organiche. Tuttavia, bisogna considerare attentamente quali masse tracciare quando si fanno esperimenti di desorbimento termico da pellicole di cellulosa. Questo aiuta a distinguere la specie adsorbita dalla pellicola di cellulosa in decomposizione/desorbimento. Abbiamo scelto la massa 57 per l’n-decano perché questo picco è il più piccolo dei picchi della cellulosa che potrebbe essere utilizzato per l’n-decano. Metanolo deuterato è stato impiegato, perché il suo picco di massa più alta di 34 amu non viene rilevato nello spettro di desorbimento del film di cellulosa.
Abbiamo anche notato in esperimenti preliminari che il riscaldamento a 150 ° C ha portato ad un cambiamento marcato nei film sottili di cellulosa mostrato da un cambiamento significativo nell’inizio degli spettri TPD dopo misure ripetute sullo stesso film (vedi SI Figura 4). In questo lavoro presentiamo solo i dati ottenuti con un film sottile di cellulosa vergine. Il desorbimento dei film di cellulosa si completa a circa 600°C. Nel corso del tempo abbiamo trovato un accumulo di un residuo di carbonio sul substrato, che è stato tolto lucidando la superficie prima della formazione del film.
TPD-Spectra
L’interpretazione degli spettri TPD nella scienza delle superfici segue il principio dell’equilibrio microscopico. Una specie adsorbente prenderà quindi lo stesso percorso durante l’adsorbimento e il desorbimento. Come conclusione inversa si può imparare qualcosa sul processo di adsorbimento dagli esperimenti di desorbimento (Somorjai, 1981). È stato dimostrato che la forma del picco di desorbimento da un esperimento TPD ha una forma caratteristica per il desorbimento da un multistrato sia per il desorbimento molecolare che per l’adsorbimento dissociativo (Somorjai, 1981). Redhead ha proposto un metodo semplificato per calcolare l’energia di adsorbimento dalla temperatura al picco massimo di uno spettro di desorbimento termico (Redhead, 1962). In questo lavoro riportiamo le energie di adsorbimento per le specie adsorbite calcolate secondo la formula di Redhead. In ogni caso si dovrebbe tenere a mente che questo metodo è stato originariamente inteso per l’adsorbimento di molecole semplici come CO o H2. In quali circostanze il metodo Redhead si applica anche alle molecole organiche non è stato ancora studiato. Alla fine, i valori forniscono almeno un’idea dell’energia di adsorbimento. Energie di adsorbimento diverse sono comunemente collegate a diversi siti di adsorbimento sulla superficie. Questa connessione è usata in tutto questo documento.
Desorbimento dell’n-decano
La forma asimmetrica del picco con il bordo di uscita ripido del picco di desorbimento come dimostrato dalla Figura 5 è un chiaro segno che l’n-decano si desorbe da un multistrato che è stato adsorbito a -80°C. Il multistrato si desorbe tra circa -70 e -52°C con un’energia di adsorbimento di circa 60 kJ/mol. Questo valore si trova proprio tra il calore di vaporizzazione di 56 kJ/mol a -15°C (Carruth e Kobayashi, 1973) e 77 kJ/mol ottenuto estrapolando i dati di Majer e Scoboda (1985) a -70°C. Ciò suggerisce che questo picco di desorbimento deriva da un multistrato sulla superficie. Nello stesso intervallo di temperatura si può vedere anche un certo desorbimento di CO2, che molto probabilmente deriva dall’adsorbimento dal gas residuo durante il raffreddamento e durante l’adsorbimento di n-decano. Uno sguardo più attento allo stesso intervallo di temperatura mostra anche un picco di desorbimento dell’acqua (vedi Figura 6).
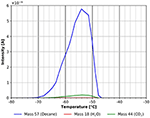
Figura 5. Desorbimento di n-decano (massa 57, blu), anidride carbonica (massa 44, verde) e acqua (massa 18, rosso) tra -80 e -30°C.
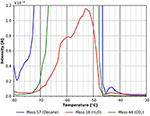
Figura 6. Zoom sullo spettro TPD mostrato nella Figura 5. n-decano (massa 57, blu), anidride carbonica (massa 44, verde) e acqua (massa 18, rosso).
Il picco di desorbimento dell’acqua visto nell’intervallo di temperatura tra -80 e circa -52°C è molto probabilmente dovuto all’adsorbimento dell’acqua dal gas residuo durante il raffreddamento e l’esposizione al gas. Potrebbe anche derivare in parte dall’acqua residua nel film di cellulosa. Per minimizzare quest’ultimo effetto, gli esperimenti qui mostrati sono stati avviati solo quando è stata raggiunta una pressione di fondo di circa 5 ×10-9 mbar. L’influenza della pressione di fondo prima dell’adsorbimento è mostrato nelle informazioni di supporto (SI Figura 5). La Figura 6 mostra anche un’altra caratteristica di desorbimento da n-decano e acqua con un massimo a circa -43°C. Anche se questo picco è piccolo, si prega di notare che tutte le figure sono derivate direttamente dai dati grezzi senza alcuna lisciatura. Per questo motivo, tutti i picchi discussi in questo articolo mostrano un buon rapporto segnale/rumore e tutte le caratteristiche discusse sono state riprodotte sperimentalmente diverse volte.
Questa caratteristica è mostrata più in dettaglio nella Figura 7. Il picco di desorbimento a circa -43°C suggerisce chiaramente una specie di n-decano più fortemente legata. Usando la formula di Redhead questo corrisponde a un’energia di legame di circa 70 kJ/mol. Un piccolo picco di CO2 e acqua è chiaramente visibile ancora nella Figura 7, indicando che queste specie trovano siti di adsorbimento simili sulla superficie della cellulosa.
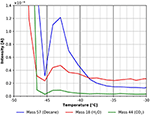
Figura 7. Zoom sullo spettro TPD mostrato in Figura 6. n-decano (massa 57, blu), anidride carbonica (massa 44, verde), e acqua (massa 18, rosso).
Andando a temperature più alte si trova una piccola e ampia caratteristica di desorbimento di n-decano tra circa -40 e +14°C (vedi Figura 8) corrispondente ad una energia di adsorbimento di circa 160 kJ/mol. Questa caratteristica non è presente nella traccia di desorbimento di CO2, e non è chiaramente visibile nella traccia di desorbimento dell’acqua. La ragione della maggiore dispersione nei dati della figura 8 potrebbe essere stata causata da un tasso di riscaldamento non perfettamente lineare in questo intervallo di temperatura.
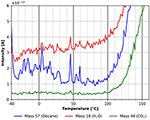
Figura 8. Desorbimento di n-decano (massa 57, blu), anidride carbonica (massa 44, verde) e acqua (massa 18, rosso) nell’intervallo di temperatura tra -40 e +160°C.
La figura 8 mostra anche che tutte e tre le specie iniziano a desorbire a diverse temperature di inizio di circa 80°C per l’acqua, 95°C per n-decano, e 100°C per CO2. Questo è anche l’inizio del desorbimento/degradazione del film di cellulosa, come si può vedere nella figura 8. Un’altra forte indicazione che il film di cellulosa subisce cambiamenti significativi durante il riscaldamento può essere visto nella differenza tra l’inizio del desorbimento dopo ripetuti cicli di adsorbimento e desorbimento senza preparare un nuovo film mostrato nelle informazioni di supporto (SI Figura 4).
Il più grande picco di desorbimento in Figura 9 è il picco di CO2 seguito dal picco dell’acqua. Sorprendentemente, c’è un significativo desorbimento di n-decano ancora visibile. Questo picco può anche provenire in parte dalla decomposizione/desorbimento del film di cellulosa. Sfortunatamente, queste due possibilità non possono essere distinte l’una dall’altra in questo momento. Come menzionato sopra, un frammento alla massa 57 può essere visto nella Figura 4. Probabilmente c’è un quarto sito di adsorbimento per l’n-decano con un’energia di legame di circa 180 kJ/mol. Anche la degradazione della cellulosa avviene all’incirca allo stesso intervallo di temperatura. Questi risultati mostrano che le molecole non polari adsorbono facilmente sulle superfici della cellulosa a temperatura ambiente e oltre.
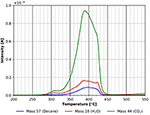
Figura 9. Desorbimento di n-decano (massa 57, blu), anidride carbonica (massa 44, verde) e acqua (massa 18, rosso) nell’intervallo di temperatura tra 200 e 550°C.
Un confronto delle figure 9 e 10 mostra che il desorbimento finale di tutte le specie è influenzato dalle molecole adsorbite. Nel caso dell’adsorbimento di n-decano, nella figura 9 si possono vedere tre diversi picchi di desorbimento per tutte e tre le specie studiate. Per il metanolo deuterato si osserva solo un picco nella stessa regione di temperatura (Figura 10). Questo suggerisce che le specie adsorbite hanno un’influenza sulla decomposizione e il desorbimento della cellulosa.
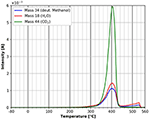
Figura 10. Desorbimento di metanolo deuterato (massa 34, blu), anidride carbonica (massa 44, verde) e acqua (massa 18, rosso) nell’intervallo di temperatura tra -80 e 560°C.
Desorbimento del metanolo deuterato
La figura 10 mostra lo spettro TPD del metanolo deuterato nell’intero intervallo di temperatura. Evidentemente i picchi a bassa temperatura sono assenti in questo caso. Questo è un forte indicatore che il metanolo deuterato polare è più fortemente legato durante l’adsorbimento rispetto al n-decano. Tuttavia, l’energia di adsorbimento secondo l’equazione di Redhead è anche circa 180 kJ/mol. Chiaramente bisogna tenere presente che il picco di desorbimento di massa 57 nel caso dell’n-decano si sovrappone alla massa 57 del desorbimento/decomposizione della cellulosa, cosa che non avviene nel desorbimento del metanolo deuterato. Tutto il desorbimento della massa 57 avviene a temperature più basse e quindi le energie di adsorbimento più basse mancano completamente nel caso del metanolo deuterato. Inoltre, sembra esserci una marcata influenza della molecola principale adsorbita sull’adsorbimento di acqua e CO2 dal gas residuo. L’influenza del metanolo deuterato sulla pellicola di cellulosa stessa può essere vista al picco principale a 400°C. Contrariamente al caso dell’n-decano, non ci sono spalle nel picco di degradazione/desorbimento dopo l’adsorbimento del metanolo deuterato. Dopo l’adsorbimento del metanolo deuterato, il piccolo picco che si verifica a circa 310°C dopo l’adsorbimento di n-decano manca, così come le spalle nel picco di desorbimento principale. Possiamo anche rilevare un piccolo desorbimento aggiuntivo di tutte e tre le specie a circa 550°C, che non è stato visto dopo l’adsorbimento di n-decano. Sfortunatamente, a questa temperatura un artefatto del portacampione di rame non può essere escluso completamente.
I risultati presentati nelle figure 9, 10 mostrano che l’adsorbimento di molecole polari ha una forte influenza sui film sottili di cellulosa, perché gli spettri di desorbimento sono significativamente diversi.
La figura 11 mostra il punto di partenza degli spettri TPD dopo l’adsorbimento di metanolo deuterato in modo più dettagliato. Il desorbimento dell’acqua inizia a circa -60°C. Le fluttuazioni del desorbimento dell’acqua in questo intervallo di temperatura ancora una volta è molto probabilmente dovuto a piccole fluttuazioni nel tasso di riscaldamento lineare. È interessante notare che il desorbimento del metanolo deuterato inizia ad una temperatura di circa +40°C. Questa differenza nei punti di partenza del desorbimento tra acqua e metanolo deuterato può essere attribuita ai diversi siti di adsorbimento. Apparentemente, il metanolo è più fortemente legato al film di cellulosa rispetto all’acqua. Il desorbimento di CO2 inizia a circa +60°C, segnando l’inizio della decomposizione e del desorbimento della cellulosa.
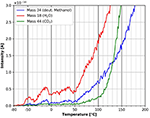
Figura 11. Zoom sul desorbimento di metanolo deuterato (massa 34, blu), anidride carbonica (massa 44, verde) e acqua (massa 18, rosso) nell’intervallo di temperatura tra -80 e 200°C.
Conclusioni
In questo studio è stato studiato l’adsorbimento e il desorbimento di molecole organiche su film sottili di cellulosa utilizzando il desorbimento programmato in temperatura. Si è potuto dimostrare che il co-adsorbimento di acqua e CO2 dal gas residuo è anche influenzato dalle molecole adsorbite. Tutte le specie hanno una marcata influenza sulla decomposizione/desorbimento dei film di cellulosa. Dai risultati qui presentati, diventa chiaro che sia le molecole non polari che quelle polari adsorbono prontamente su una superficie di cellulosa, con la molecola polare che mostra una maggiore energia di legame.
Il metanolo deuterato mostra un picco di desorbimento a circa 400°C e nello stesso intervallo di temperatura avviene il desorbimento/decomposizione della cellulosa. Poiché le specie adsorbite desorbono nello stesso intervallo del film di cellulosa, l’energia di adsorbimento potrebbe effettivamente essere superiore ai 180 kJ/mol approssimati ottenuti dall’equazione di Redhead.
In futuro abbiamo intenzione di studiare diverse molecole e la possibile influenza dello spessore del film di cellulosa sull’adsorbimento e il desorbimento delle molecole organiche.
Contributi degli autori
EH ha progettato e costruito la camera a vuoto e fatto gli esperimenti. VH ha condotto gli esperimenti iniziali. JA ha condotto gli esperimenti iniziali. RS ha avuto l’idea della ricerca, del setup della camera a vuoto, e ha supervisionato gli studenti.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Acknowledgments
Questo lavoro è stato sostenuto dalla Christian Doppler Society, Austria. Il sostegno finanziario del Ministero Federale Austriaco per gli Affari Digitali ed Economici e la Fondazione Nazionale per la Ricerca, la Tecnologia e lo Sviluppo, Austria è riconosciuto con gratitudine.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fmats.2019.00178/full#supplementary-material
Carruth, G. F., and Kobayashi, R. (1973). Pressione di vapore delle normali paraffine etano attraverso n-decano dai loro punti tripli a circa 10 mm di mercurio. J Chem Eng Data. 18, 115-126. doi: 10.1021/je60057a009
CrossRef Full Text | Google Scholar
Chen, P., Nishiyama, Y., Wohlert, J., Lu, A., Mazeau, K., and Ismail, A. E. (2017). L’entropia traslazionale e l’energia di dispersione guidano congiuntamente l’adsorbimento dell’urea alla cellulosa. J. Phys. Chem. B 121, 2244-2251. doi: 10.1021/acs.jpcb.6b11914
PubMed Abstract | CrossRef Full Text | Google Scholar
Djak, M., Gilli, E., Kontturi, E., e Schennach, R. (2011). Dipendenza dello spessore degli spettri infrarossi di riflessione-assorbimento di film polimerici sottili supportati. Macromolecole 44, 1775-1778. doi: 10.1021/ma102905v
CrossRef Full Text | Google Scholar
Ganser, C., Hirn, U., Rohm, S., Schennach, R., e Teichert, C. (2014). AFM nanoindentazione di fibre di cellulosa e film sottili di cellulosa al variare dell’umidità relativa. Holzforschung 68, 53-60. doi: 10.1515/hf-2013-0014
CrossRef Full Text | Google Scholar
Ganser, C., Niegelhell, K., Czibula, C., Chemelli, A., Teichert, C., Schennach, R., et al. (2016). Effetti di topografia in esperimenti di mappatura della forza AFM su film sottili di cellulosa decorati con xilano. Holzforschung 70, 1115-1123. doi: 10.1515/hf-2016-0023
CrossRef Full Text | Google Scholar
Hakalahti, M., Faustini, M., Boissiere, C., Kontturi, E., e Tammelin, T. (2017). Meccanismi interfacciali di assorbimento del vapore acqueo in pellicole di nanofibrille di cellulosa come rivelato da modelli quantitativi. Biomacromolecules 18, 2951-2958. doi: 10.1021/acs.biomac.7b00890
PubMed Abstract | CrossRef Full Text | Google Scholar
Hohenegger, M., Bechtold, E., and Schennach, R. (1998). Coadsorbimento di ossigeno e cloro su Pt(111). Surf. Sci. 412/413, 184-191.
Google Scholar
Hoja, J., Maurer, R. J., and Sax, A. F. (2014). Adsorbimento di glucosio, cellobiosio, e cellotetraose su superfici modello di cellulosa. J Phys. Chemistry B 118, 9017-9027. doi: 10.1021/jp5025685
PubMed Abstract | CrossRef Full Text | Google Scholar
Kontturi, E., Thüne, P. C., e Niemantsverdriet, J. W. (2003). Metodo nuovo per la preparazione di superfici modello di cellulosa tramite spin coating. Polymer 44, 3621-3625. doi: 10.1016/S0032-3861(03)00283-0
CrossRef Full Text | Google Scholar
Li, H., Du, Y., and Xu, Y. (2003). Adsorbimento e complessazione degli additivi di chitosano wet-end nei sistemi di fabbricazione della carta. J Appl Polymer Sci. 91, 2642-2648. doi: 10.1002/app.13444
CrossRef Full Text | Google Scholar
Lombardo, S., e Thielemans, W. (2019). Termodinamica dell’adsorbimento su superfici di nanocellulosa. Cellulosa 26, 249-279. doi: 10.1007/s10570-018-02239-2
CrossRef Full Text | Google Scholar
Majer, V., e Scoboda, V. (1985). Entalpie di vaporizzazione dei composti organici: una revisione critica e compilazione dei dati. Blackwell Sci. Publications. 1985:300.
Mazeau, K., e Vergelati, C. (2002). Modellazione atomistica dell’adsorbimento del benzofenone su superfici cellulosiche. Langmuir 18, 1919-1927. doi: 10.1021/la010792q
CrossRef Full Text | Google Scholar
Mazeau, K., e Wyszomirski, M. (2012). Modellazione di rosso Congo adsorbimento sulla superficie idrofoba della cellulosa utilizzando la dinamica molecolare. Cellulosa 19, 1495-1506. doi: 10.1007/s10570-012-9757-6
CrossRef Full Text | Google Scholar
Neumann, R. D., Berg, J. M., e Claesson, P. M. (2018). Misurazione diretta delle forze di superficie nei sistemi di fabbricazione della carta e di rivestimento della carta. Nordic Pulp Paper Res. J. 8, 96-104. doi: 10.3183/npprj-1993-08-01-p096-104
CrossRef Full Text
Niinivaara, E., Faustini, M., Tammelin, T., and Kontturi, E. (2015). Assorbimento del vapore acqueo di pellicole ultrasottili di nanocristalli di derivazione biologica: valutazione quantitativa con microbilancia a cristallo di quarzo e ellissometria spettroscopica. Langmuir 31, 12170-12176. doi: 10.1021/acs.langmuir.5b01763
PubMed Abstract | CrossRef Full Text | Google Scholar
Niinivaara, E., Faustini, M., Tammelin, T., e Kontturi, E. (2016). Mimare la risposta all’umidità della parete cellulare vegetale utilizzando sistemi bidimensionali: il ruolo critico dei polisaccaridi amorfi e cristallini. Langmuir 32, 2032-2040. doi: 10.1021/acs.langmuir.5b04264
PubMed Abstract | CrossRef Full Text | Google Scholar
Perez, D. D. S., Ruggiero, R., Morais, L. C., Machado, A. E. H., e Mazeau, K. (2004). Studi teorici e sperimentali sull’adsorbimento di composti aromatici sulla cellulosa. Langmuir 20, 3151-3158. doi: 10.1021/la0357817
CrossRef Full Text | Google Scholar
Redhead, P. A. (1962). Desorbimento termico dei gas. Vacuum 12, 203-211, doi: 10.1016/0042-207X(62)90978-8
CrossRef Full Text | Google Scholar
Rohm, S., Hirn, U., Ganser, C., Teichert, C., and Schennach, R. (2014). Film sottili di cellulosa come sistema modello per i legami delle fibre di carta. Cellulosa 21, 237-249. doi: 10.1007/s10570-013-0098-x
CrossRef Full Text | Google Scholar
Somorjai, G. A. (1981). Chimica in due dimensioni: Superfici. Ithaca, NY: Cornell University Press.
Tozuka, Y., Tashiro, E., Yonemochi, E., Oguchi, T., and Yamamoto, K. (2002). Studio di fluorescenza allo stato solido dell’adsorbimento di naftalene su materiale poroso. J. Colloid Interface Sci. 248, 239-243. doi: 10.1006/jcis.2001.8142
PubMed Abstract | CrossRef Full Text | Google Scholar
Tozuka, Y., Yonemochi, E., Oguchi, T., e Yamamoto, K. (1998). Studi fluorometrici di adsorbimento del pirene su cellulosa cristallina porosa. J Colloid Interface Sci. 205, 510-515.
PubMed Abstract | Google Scholar
Voisin, H., Bergström, L., Liu, P., and Mathew, A. P. (2017). Materiali a base di nanocellulosa per la purificazione dell’acqua. Nanomateriali 7:57. doi: 10.3390/nano7030057
PubMed Abstract | CrossRef Full Text | Google Scholar
Xie, Y., Hill, C. A. S., Jalaludin, Z., and Sun, D. (2011). Il comportamento di assorbimento del vapore acqueo di tre cellulose: analisi mediante cinetica esponenziale parallela e interpretazione mediante il modello viscoelastico di Kelvin-Voigt. Cellulosa 18, 517-530. doi: 10.1007/s10570-011-9512-4
CrossRef Full Text | Google Scholar