- Introduzione
- Materiali e metodi
- Animali e abitazioni
- Trattamento con Gaboxadol e tempistica sperimentale
- Open Field Test (OFT)
- Successive Alleys Test (SAT)
- Light-Dark Exploration Test (LDT)
- Interazione sociale (SI), comportamenti aggressivi
- Stereotipia
- Self-grooming
- Analisi statistica
- Risultati
- Gaboxadol normalizza l’iperattività osservata nei topi Fmr1 KO2
- I comportamenti simili all’ansia nei topi Fmr1 KO2 sono normalizzati dal gaboxadolo
- Irritabilità e comportamenti aggressivi in topi Fmr1 KO2 sono normalizzati da Gaboxadol
- Gaboxadolo normalizza i comportamenti ripetitivi nei topi Fmr1 KO2
- Discussione
- Dichiarazione etica
- Contributi degli autori
- Finanziamento
- Dichiarazione sul conflitto di interessi
Introduzione
La sindrome dell’X fragile (FXS) è la forma ereditaria più comune di disabilità intellettuale e autismo con una frequenza stimata di 1:4.000-5.000, che colpisce tutti i gruppi etnici nel mondo (Gross et al., 2015). Gli individui con FXS sono a maggior rischio per una serie di problemi comportamentali associati, tra cui: problemi di attenzione, iperattività, ansia, e molte caratteristiche associate all’autismo tra cui stereotipie motorie, evitamento sociale, comportamento autolesivo e aggressività (Hagerman et al., 2010). Inoltre, gli individui con FXS sono inclini a problemi medici in comorbilità tra cui convulsioni, disturbi del sonno, difficoltà gastrointestinali e problemi del tessuto connettivo. Interventi comportamentali e gestione farmacologica dei sintomi discreti sono offerti agli individui con FXS, ma attualmente non ci sono terapie approvate dalla FDA per trattare la sindrome nel suo complesso.
FXS è il risultato di mutazioni nel gene FMR1 che blocca l’espressione della proteina X fragile ritardo mentale (FMRP). FMRP è una proteina legante l’mRNA ubiquitariamente espressa, necessaria per il trasporto e la traduzione del 4%-8% delle proteine sinaptiche, e quindi regola una varietà di funzioni sinaptiche (Bassell e Warren, 2008). Il ruolo di FMRP in FXS e la valutazione di candidati terapeutici è stato studiato in gran parte attraverso l’uso di un modello di topo knockout Fmr1 (KO) prima caratterizzato dal Consorzio olandese-belga X Fragile (Bakker et al., 1994). Il Fmr1 KO è stato generato da un inserimento mirato di una cassetta di neomicina nell’esone 5 del gene FMR1, ottenendo un topo che aveva livelli non rilevabili di proteina FMRP e bassi livelli di mRNA Fmr1 residuo (Bakker et al., 1994). Il topo Fmr1 KO2 punta un nuovo allele nullo a Fmr1 generato dalla delezione del promotore e del primo esone di Fmr1 (Mientjes et al., 2006). È sia proteina che mRNA nullo. Questo modello è stato ampiamente utilizzato per i test farmacologici (Deacon et al., 2015; Cheng et al., 2017; Gaudissard et al., 2017; Dahlhaus, 2018; Leboucher et al., 2019; Tranfaglia et al., 2019), e la batteria di test comportamentali è stata in gran parte focalizzata sull’iperattività, sull’aumentata sensibilità agli stimoli uditivi, sulla stereotipia e sui deficit nell’apprendimento e nella memoria (Olmos-Serrano et al., 2011). A livello cellulare e circuitale, gli studi sui topi FXS si sono concentrati in gran parte sulla segnalazione iperattiva del recettore metabotropico del glutammato 5 (mGluR5) (Dölen et al., 2007), aumento della sintesi proteica (Osterweil et al., 2010), e potenziato il potenziamento a lungo termine (LTP; Auerbach e Bear, 2010).
Un’ipotesi γ-aminobutyric acid (GABA)ergic di FXS è emerso anche sulla base di osservazioni da individui con FXS e topi privi di una copia attiva del gene Fmr1. GABA è il principale neurotrasmettitore inibitorio nel cervello e segnala post-sinapticamente attraverso recettori ionotropi veloci (GABAA) o metabotropi lenti (GABAB). All’interno della popolazione dei recettori GABAA, viene fatta un’ulteriore distinzione tra recettori sinaptici ed extrasinaptici che mediano l’inibizione fasica e tonica, rispettivamente (Olmos-Serrano et al., 2010; Meera et al., 2011). A sostegno dell’ipotesi GABAergica, gli individui con FXS mostrano una ridotta disponibilità di recettori GABAA (D’Hulst et al., 2015). Questo risultato da individui con FXS è parallelo piacevolmente dai risultati in un modello murino della malattia.
Studi molecolari hanno dimostrato diminuzioni nel macchinario GABAergico, comprese le alterazioni nelle subunità del recettore GABA, il trasportatore GABA (Rotschafer et al., 2015), e la decarbossilasi dell’acido glutammico (GAD; D’Hulst e Kooy, 2007; Olmos-Serrano et al., 2010). Più specificamente, i livelli di mRNA per il gene che codifica la subunità delta del recettore GABAA-specifica per la popolazione extrasinaptica dei recettori-è stato segnalato per essere ridotto (Gantois et al., 2006). In termini di funzione GABAergica, il rilascio di GABA sinaptico è stato ridotto e l’inibizione fasica e tonica diminuita nell’amigdala (Olmos-Serrano et al., 2010).
Per quanto riguarda il comportamento, l’iperattività, lo startle uditivo, e l’apprendimento e la memoria osservati nei topi FX sono stati correlati alla perdita di tono inibitorio dagli ingressi GABAergici nel cervelletto e nell’amigdala (Olmos-Serrano et al., 2010), due regioni cerebrali legate anche alla FXS umana (Lightbody e Reiss, 2009; Hall et al, 2013).
Più criticamente, il potenziamento selettivo dei recettori GABAA extrasinaptici contenenti la subunità delta (dSEGA) con gaboxadolo, noto anche come OV101 e 4,5,6,7-tetraidroisossazolo(5,4-c)piridin-3-olo (THIP), ha normalizzato l’iperattività aberrante e le risposte uditive di startle nei topi Fmr1 KO (Olmos-Serrano et al., 2010). È importante notare che questi risultati sono stati osservati a esposizioni equivalenti a quelle a cui il gaboxadolo è ben tollerato negli esseri umani (Meera et al., 2011).
Poiché gli studi clinici iniziali non hanno ancora mostrato alcun beneficio terapeutico degli inibitori mGluR5 (Scharf et al., 2015), nel presente studio, abbiamo cercato di esplorare approcci che potrebbero informare più direttamente un piano clinico, includendo aspetti più ampi del fenotipo FXS non precedentemente riportati. In particolare, qui abbiamo studiato gli effetti di varie dosi di gaboxadolo su iperattività, ansia, aggressività e comportamenti ripetitivi nel modello Fmr1 KO2 di FXS, dimostrando il potenziale di efficacia del gaboxadolo per il trattamento di questi sintomi FXS.
Materiali e metodi
Animali e abitazioni
I topi Fmr1 KO2, generati precedentemente dalla delezione del promotore e del primo esone di Fmr1 con conseguente mRNA e proteine nulle (Mientjes et al, 2006), sono stati utilizzati per tutti gli esperimenti. Floxed Fmr1 topi sono stati allevati a topi che esprimono un primo ubiquitariamente espresso Cre-recombinase con conseguente eliminazione di Fmr1 da tutte le cellule. KO topi sono stati reincrociati per almeno otto generazioni a C57BL/6J, e wild-type-littermates (WT) sono stati utilizzati come controlli. Dieci topi (maschi, 2 mesi di età) sono stati utilizzati per ogni gruppo di trattamento in tutti gli esperimenti comportamentali. Coppie di allevamento eterozigote sono stati utilizzati per generare WT e KO compagni di cucciolata per tutti gli studi. I maschi sono stati rimossi dalle gabbie di allevamento dopo la nascita, le femmine sono state eliminate dalle cucciolate e genotipizzazione è stata eseguita utilizzando TransnetXY Automated Genotyping (Transnetyx, Inc., Cordova, TN, USA) utilizzando primer stabiliti e il protocollo. Topi nella stessa gabbia sono stati iniettati con la stessa dose di gaboxadol o veicolo, e mutanti e controlli sono stati alloggiati separatamente. Tutti i topi sono stati raggruppati in gabbie di plastica (35 × 30 × 12 cm), cinque per gabbia, e abituati alla struttura animale per almeno una settimana prima del test. La temperatura della stanza (21 ± 2°C), l’umidità relativa (55 ± 5%), un ciclo luce-buio di 12 ore (luci accese 7 am-7 pm) e il ricambio d’aria (16 volte all’ora) sono stati controllati automaticamente. Tutti i topi avevano accesso ad libitum a cibo e acqua. Tutti i test sono stati condotti nella fase di luce da un investigatore cieco al genotipo e al trattamento farmacologico. L’alloggiamento e gli esperimenti hanno avuto luogo presso GeN DDI Limited (Londra, Regno Unito) in conformità con i requisiti della legge britannica sugli animali (procedure scientifiche) del 1986.
Trattamento con Gaboxadol e tempistica sperimentale
I topi Fmr1 KO2 sono stati iniettati con veicolo (0.9% di soluzione salina sterile) o gaboxadolo (0.5, 1, 1.5, 2, 3, 4, o 5 mg/kg, i.p.) 30 minuti prima del test comportamentale in ogni giorno di test, con un intervallo di tre giorni tra ogni test per evitare qualsiasi effetto cumulativo della somministrazione del farmaco. Topi wild-type iniettati con il veicolo allo stesso punto temporale sono stati inclusi anche in tutti gli esperimenti. Lo screening comportamentale dei topi (n = 10 per gruppo) è stato condotto nel seguente ordine con 2-3 giorni tra ogni test: Test in campo aperto (OFT; giorno 1), vicoli successivi (giorno 4), box luce/buio (giorno 7), test sociali e aggressività (giorno 10), e self-grooming e stereotipia (giorno 12).
Open Field Test (OFT)
Il giorno del test 1, l’OFT è stato condotto in una camera VersaMax activity monitor (AccuScan Instruments, Columbus, OH, USA). L’attività locomotoria è stata registrata per 30 minuti in una grande camera di plexiglas (40 × 40 cm) illuminata a 40-lux. L’attività è stata monitorata da interruzioni di raggi infrarossi che sono stati combinati in 1 min bins e decodificato utilizzando VersaDat software (AccuScan Instruments, Columbus, OH, USA) per determinare la distanza percorsa (cm), distanza centrale percorsa (cm), giri in senso orario e antiorario (di almeno 5.08 cm di diametro), e le interruzioni ripetitive del raggio.
Successive Alleys Test (SAT)
Il giorno 4 del test, i topi sono stati sottoposti al test dei vicoli successivi (SAT). Il SAT ha un vantaggio rispetto all’elevated plus maze, in quanto sostiene una gamma più ampia di livelli di ansia (Deacon, 2013). La camera di prova consisteva in quattro vicoli successivi, disposti linearmente, sempre più ansiogeni (colore più chiaro, pareti più basse, più strette) che erano lunghi 25 cm e alti 50 cm da terra. I topi sono stati osservati per un periodo di 5 minuti sotto una luce rossa da 60 W posizionata sopra l’apparecchio. Il numero di ingressi in ogni vicolo è stato registrato.
Light-Dark Exploration Test (LDT)
Il giorno 7 del test, i topi sono stati sottoposti al light/dark exploration test (LDT). Il LDT è ampiamente utilizzato per misurare il comportamento ansioso nei topi basato sulla loro paura innata di spazi aperti e luminosi (Prut e Belzung, 2003). La camera di prova in polipropilene (44 × 21 × 21 cm) è stata divisa in un compartimento più piccolo, buio e coperto (14 cm) e un compartimento più grande, luminoso e aperto (28 cm) da un divisorio scuro con una piccola apertura (13 × 5 cm). Le transizioni tra i compartimenti sono state registrate da fotocellule situate nell’apertura della partizione. Ogni topo è stato collocato nel lato chiaro rivolto lontano dal divisorio, gli è stato permesso di esplorare liberamente la camera per 10 minuti, e le transizioni tra le camere sono state registrate.
Il giorno 10 del test, l’interazione sociale (SI) e i test di aggressività sono stati eseguiti in una gabbia di dimensioni simili alla gabbia di casa (40 × 23 × 12 cm) con un coperchio in Perspex per facilitare la visualizzazione dei topi. I topi sono stati abituati alla stanza di prova per 25 min. Due soggetti, un topo sperimentale e un topo wild-type “test”, sono stati poi messi nella gabbia di prova contemporaneamente. La durata totale e il numero di indagini sociali, il rumore della coda, il numero di morsi e il numero di montature sono stati registrati dall’alto e misurati per 3 min.
Stereotipia
Il giorno 12 del test, i tassi di stereotipia spontanea (movimenti della testa) sono stati valutati utilizzando un apparecchio a fotocellula automatico modificato (Columbus Instruments, Columbus, OH, USA). Il protocollo di test prevedeva la rimozione dei topi dalle loro gabbie domestiche e la loro collocazione individuale in gabbie di prova in plexiglas (22 × 25 × 28 cm). I topi sono stati lasciati indisturbati per 2 min per abituarsi alla camera di prova. Poi, ogni topo è stato monitorato per 3 min per generare un punteggio stereotipia che corrisponde alla frequenza media stereotipia per ora. Cibo e acqua sono stati forniti per tutto il periodo di test. Il conteggio delle stereotipie è una quantificazione del numero di volte che un topo interferisce con lo stesso raggio infrarosso in un periodo di attività stereotipica come misurato dall’apparato di test.
Self-grooming
Anche il giorno 12 del test, l’auto-grooming è stato monitorato. Ogni topo è stato messo individualmente in una gabbia standard per topi (46 × 23,5 × 20 cm) illuminata a 40-lux. Dopo un periodo di assuefazione di 5 minuti nella gabbia di prova, il tempo cumulativo trascorso a spulciare qualsiasi regione del corpo è stato registrato per 3 minuti per determinare il tempo cumulativo (in secondi) di spulciare qualsiasi regione del corpo.
Analisi statistica
Siccome i topi Fmr1 KO2 sono stati trattati con gaboxadol o veicolo, ma i topi WT sono stati trattati solo con il veicolo, i dati parametrici sono stati analizzati utilizzando un’analisi della varianza (ANOVA) e il test post hoc di Tukey. Tutti i dati sono stati analizzati utilizzando GraphPad Prism v7.0 (GraphPad Software, San Diego, CA, USA). La significatività statistica è stata fissata a P < 0,05.
Risultati
Gaboxadol normalizza l’iperattività osservata nei topi Fmr1 KO2
L’iperattività è una caratteristica saliente della FXS umana (Bailey et al, 2008; Wheeler et al., 2014; Hagerman et al., 2017) ed è stata riprodotta in modo affidabile nel topo Fmr1 KO olandese-belga precedentemente caratterizzato (Olmos-Serrano et al., 2010; Kazdoba et al., 2014). Per verificare se i topi Fmr1 KO2 mostrato iperattività locomotoria e se gaboxadolo potrebbe normalizzare questo comportamento aberrante, Fmr1 KO2 topi sono stati iniettati con veicolo o gaboxadolo (0.5-5 mg/kg, i.p.), e WT littermates sono stati iniettati con veicolo 30 min prima del test nel OFT. La distanza totale percorsa (cm) nella OFT è stata registrata per 30 min. I risultati hanno mostrato che la distanza percorsa dai topi Fmr1 KO2 era significativamente aumentato rispetto ai controlli WT littermate (Figura 1, F (8,81) = 21.27, p < 0.0001), coerente con i risultati di altri modelli di FXS. Il trattamento con gaboxadol (0.5 mg/kg) ha normalizzato la distanza percorsa dai topi Fmr1 KO2 ai livelli di attività WT (Figura 1). Dosi più elevate di gaboxadol (1-5 mg/kg, i.p.) non hanno avuto alcun effetto sull’attività locomotoria nei topi Fmr1 KO2 (Figura 1). Questi risultati non erano attribuibili a effetti sedativi di gaboxadolo perché in WT C57Bl/6 o BALB / c topi, dosi di gaboxadolo fino a 2.0 mg / kg, i.p. non hanno alcun effetto sull’attività locomotoria in un 60 min OFT (dati non mostrati), coerente con il lavoro precedente che mostra alcun effetto di gaboxadolo sulla locomozione in topi WT (Olmos-Serrano et al, 2011) o ratti (Silverman et al., 2016).
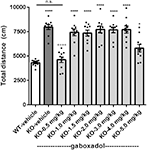
Figura 1. Gaboxadol normalizza l’iperattività nei topi Fmr1 KO2. Distanza totale percorsa per 30 min per wild-type-littermates (WT) topi trattati con veicolo (barra bianca), topi Fmr1 KO2 trattati con veicolo (knockout, KO barra grigio scuro) e topi Fmr1 KO2 trattati con gaboxadol (KO-0.5-5.0 mg/kg, barre grigio chiaro). Le barre sono medie ± SEM, i punti sono dati grezzi di singoli topi. *p < 0,05, ****p < 0,0001 vs. WT-veicolo gruppo; ns, non significativo vs. WT-veicolo gruppo; ++++p < 0,0001 vs. Fmr1 KO2-veicolo gruppo. N = 10 per gruppo.
I comportamenti simili all’ansia nei topi Fmr1 KO2 sono normalizzati dal gaboxadolo
Per valutare l’effetto del gaboxadolo sui comportamenti simili all’ansia nei topi Fmr1 KO2, sono stati impiegati tre diversi test comportamentali: distanza centrale percorsa nell’OFT, il LDT e il SAT. L’aumento della distanza percorsa al centro viene interpretato come una diminuzione dell’ansia e sfrutta la preferenza intrinseca dei topi a rimanere nel perimetro quando vengono introdotti in un ambiente nuovo. I topi Fmr1 KO2 sono stati iniettati con gaboxadol (0.5-5 mg/kg, i.p.), e i compagni di cucciolata WT sono stati iniettati con il veicolo 30 minuti prima di essere messi nel OFT per 30 minuti. La distanza totale percorsa nel centro era significativamente aumentata nei topi Fmr1 KO2 rispetto ai controlli WT (Figura 2A, F(8,81) = 21.32, p < 0.0001). Il trattamento con gaboxadol (0.5 mg/kg, i.p.) ha normalizzato l’effetto di Fmr1 KO2 sulla distanza centrale percorsa a livelli comparabili ai controlli WT (Figura 2A). Dosi più elevate di gaboxadolo (1-5 mg/kg) non hanno avuto alcun effetto sui topi Fmr1 KO2 in questo test (Figura 2A).
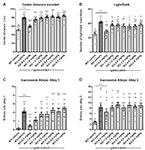
Figura 2. Gaboxadol normalizza i comportamenti legati all’ansia nei topi Fmr1 KO2. Topi WT trattati con veicolo (barra bianca), topi Fmr1 KO2 trattati con veicolo (KO, barra grigio scuro), o topi Fmr1 KO2 trattati con gaboxadolo (KO-0.5-5.0 mg/kg, barre grigio chiaro) sono stati sottoposti al test in campo aperto (OFT), luce / buio esplorazione test (LDT), e vicoli successivi test (SAT). (A) Distanza totale percorsa nel centro dell’OFT. (B) Il numero di transizioni tra compartimenti chiari e scuri nel LDT. (C) Il numero di ingressi nel vicolo 1 durante il SAT. (D) Il numero di ingressi in Alley 2 durante il SAT. Le barre sono medie ± SEM, i punti sono dati grezzi di singoli topi. ****p < 0.0001, ***p < 0.001, **p < 0.01, *p < 0.05 vs. WT-veicolo gruppo; ns, non significativo vs. WT-veicolo gruppo; ++++p < 0.0001, +++p < 0.001, ++p < 0.01 vs. Fmr1 KO2 gruppo veicolo. N = 10 per gruppo.
In seguito, il LDT, che sfrutta la naturale preferenza dei topi per il buio, ambienti protetti, è stato utilizzato come un altro saggio comportamentale per l’ansia. La volontà di esplorare lo scomparto luce della camera, misurata dal numero di transizioni tra gli scomparti, è interpretata come comportamento ansiolitico ed è sensibile al trattamento con agenti ansiolitici (Bourin e Hascoët, 2003). Fmr1 KO2 topi hanno mostrato un numero significativamente aumentato di transizioni tra le camere nel LDT rispetto ai topi WT (Figura 2B, F (8,81) = 5.819, p < 0.0001). Gaboxadol (0.5 mg/kg, i.p.) ha normalizzato il fenotipo comportamentale dei topi Fmr1 KO2 ai livelli WT (Figura 2B). Dosi più elevate di gaboxadolo non hanno avuto alcun effetto sulle transizioni luce/buio dei topi Fmr1 KO2 (Figura 2B).
Infine, i risultati del SAT hanno rafforzato che il fenotipo legato all’ansia osservato nei topi Fmr1 KO2 potrebbe essere normalizzato dal trattamento con gaboxadolo. Questo test è usato come una variante più sensibile dell’Elevated Plus Maze, ed è composto da quattro vicoli lineari, successivi, sempre più ansiogeni (Deacon, 2013). Il numero di ingressi nei vicoli 2-4 valuta il comportamento ansioso (Deacon, 2013), mentre l’aumento degli ingressi nel vicolo 1 è coerente con l’iperattività generale (Deacon, 2013). Importante, il lavoro precedente ha dimostrato che l’iperattività locomotoria non porta a risultati falsi positivi in questo test (rivisto in Deacon, 2013). Fmr1 KO2 topi hanno mostrato un aumento del numero di voci in vicolo 1 (Figura 2C, F (8,81) = 11.50, p < 0.0001), coerente con una maggiore attività locomotoria e il fenotipo iperattività mostrato in Figura 1. Fmr1 KO2 topi hanno anche mostrato un numero significativamente aumentato di voci in alley 2 rispetto ai controlli WT (Figura 2D, F (8,81) = 4.925, p < 0.0001), sostenendo un fenotipo legato all’ansia. L’iniezione di gaboxadolo (0.5 mg/kg) nei topi Fmr1 KO2 30 minuti prima del test ha normalizzato le voci nei vicoli 1 e 2 ai livelli dei controlli WT (Figure 2C,D). Dosi più elevate di gaboxadolo non hanno avuto alcun effetto sui topi Fmr1 KO2 nel SAT (Figure 2C,D). Le entrate nelle corsie 3 e 4 erano significativamente aumentate nei topi Fmr1 KO2 rispetto ai controlli WT, ma nessun beneficio evidente di gaboxadolo è stato visto con qualsiasi dose testata (non mostrato).
Irritabilità e comportamenti aggressivi in topi Fmr1 KO2 sono normalizzati da Gaboxadol
Come con altre forme di autismo sindromico, una grande percentuale di individui con FXS mostrano irritabilità, ansia sociale e aggressività. Questi comportamenti aberranti possono essere modellati nei roditori attraverso la caratterizzazione di SIs tra un topo di prova e un nuovo compagno di gabbia. Per verificare l’ipotesi che l’irritabilità e l’aggressività fossero aumentate nei mutanti Fmr1 KO2, abbiamo quantificato le istanze di sferragliare la coda, il comportamento mordace, il comportamento di montaggio e la latenza di attacco. I topi sono stati iniettati con veicolo o gaboxadol (0.5-5 mg/kg, i.p.) 30 min prima di essere messi nella gabbia di prova.
Lo sferragliare della coda, o rapide vibrazioni della coda, riflette l’aggressività e la tendenza alla lotta. Fmr1 KO2 topi hanno mostrato significativamente aumentato la frequenza di rattling coda rispetto ai controlli WT (Figura 3A, F (8,81) = 16.03, p < 0.0001). Gaboxadol (0.5, 1.5, e 5.0 mg/kg) ha normalizzato l’effetto nei topi Fmr1 KO2 a livelli comparabili ai controlli WT (Figura 3A).
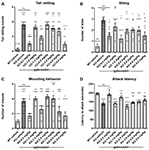
Figura 3. Gaboxadol normalizza l’irritabilità e comportamenti di aggressione in topi Fmr1 KO2. Coda rattling (A), mordere il comportamento (B), il comportamento di montaggio (C) e la latenza di attaccare un nuovo compagno di gabbia (D) sono stati misurati in topi WT trattati con veicolo (barra bianca), topi Fmr1 KO2 trattati con veicolo (KO, barra grigio scuro), o topi Fmr1 KO2 trattati con gaboxadolo (KO-0.5-5.0 mg/kg, barre grigio chiaro). Le barre sono medie ± SEM, i punti sono dati grezzi di singoli topi. ****p < 0.0001,***p < 0.001,**p < 0.01, *p < 0.05 vs. WT-veicolo gruppo; ns, non significativo vs. WT-veicolo gruppo; ++++p < 0.0001, +++p < 0.001, ++p < 0.01, +p < 0.05 vs. Fmr1 KO2 veicolo gruppo. N = 10 per gruppo.
Come il rumore della coda, mordere è una misura dell’aggressività nei topi. Fmr1 KO2 topi hanno mostrato un numero significativamente aumentato di morsi rispetto ai controlli WT (Figura 3B, F (8,81) = 5.446, p < 0.0001). Gaboxadol (0.5, 1.5, e 5.0 mg/kg) ha diminuito significativamente il numero di morsi fatti dai topi Fmr1 KO2 (Figura 3B). Tuttavia, ad alcune delle dosi testate (1.0, 3.0, e 4.0 mg/kg), il comportamento mordace è rimasto significativamente aumentato rispetto ai gruppi WT-veicolo e non è stato significativamente cambiato rispetto ai controlli KO-veicolo (Figura 3B).
Nei topi maschi, il comportamento di montaggio è un’affermazione aggressiva di dominanza sociale. Fmr1 KO2 topi hanno mostrato un numero significativamente aumentato di montaggi rispetto ai controlli WT (Figura 3C, F(8,81) = 9.008, p < 0.001). Il trattamento con gaboxadolo (0.5, 1.5, 4.0, e 5.0 mg/kg) ha significativamente diminuito il comportamento di montaggio nei topi Fmr1 KO2, e gli effetti delle dosi 0.5 e 5.0 mg/kg erano statisticamente significativi rispetto ai controlli trattati KO-veicolo (Figura 3C). Nei topi Fmr1 KO2 trattati con 1.5 e 4.0 mg/kg gaboxadolo, comportamento di montaggio non differiva significativamente da WT-veicolo topi trattati, suggerendo una tendenza per un effetto a queste dosi, anche se il loro confronto con il KO-veicolo gruppo trattato non ha raggiunto la significatività statistica (Figura 3C).
Infine, la latenza di attaccare un mouse appena incontrato è stato registrato come un’altra misura di aggressività. I topi Fmr1 KO2 hanno mostrato una latenza significativamente diminuita per attaccare rispetto ai compagni di cucciolata WT (Figura 3D, F(8,81) = 17.22, p < 0.0001). La ridotta latenza all’attacco è stata normalizzata nei topi Fmr1 KO2 trattati con gaboxadolo (0.5, 1.5 mg/kg; Figura 3D).
Gaboxadolo normalizza i comportamenti ripetitivi nei topi Fmr1 KO2
Perseverazione e comportamenti ripetitivi sono comuni negli individui con FXS e sono altamente dirompenti (Arron et al., 2011; Leekam et al., 2011; Hall et al., 2016). Per verificare l’ipotesi che tali caratteristiche potrebbero essere osservati in animali Fmr1 KO2, abbiamo quantificato circling, auto-grooming, e stereotipia in WT e Fmr1 KO2 topi mutanti. I giri in senso antiorario (CCW) sono stati misurati nella camera di prova dopo che i topi sono stati iniettati con veicolo o gaboxadol (0.5-5 mg/kg, i.p.). Fmr1 KO2 topi hanno mostrato rivoluzioni CCW significativamente aumentato durante il test 5 min rispetto ai controlli WT (Figura 4A, F (8,81) = 25.46, p < 0.0001). L’iniezione di gaboxadol (0.5, 1.0 mg/kg) in topi Fmr1 KO2 ripristinato il numero di rivoluzioni CCW ai livelli WT (Figura 4A). Non c’era alcun effetto del genotipo sul circling in senso orario (p = 0.386, dati non mostrati).

Figura 4. Gaboxadol normalizza comportamenti ripetitivi in topi Fmr1 KO2. Topi WT trattati con veicolo (barra bianca), topi Fmr1 KO2 trattati con veicolo (KO, barra grigio scuro), o topi Fmr1 KO2 trattati con gaboxadolo (KO-0.5-5.0 mg/kg, barre grigio chiaro) sono stati sottoposti a quattro prove che misurano comportamenti ripetitivi. (A) rivoluzioni in senso antiorario (CCW) sono stati misurati da interruzioni del fascio di infrarossi durante un 5-min test in campo aperto. (B) Dopo un 5-min assuefazione alla gabbia di prova, il tempo trascorso grooming per 3 min è mostrato. (C) I conteggi di stereotipia (eventi di bobbing della testa) durante un periodo di test di 3 minuti sono mostrati. Le barre sono mezzi ± SEM, i punti sono dati grezzi da singoli topi. ****p < 0.0001 vs. WT-veicolo gruppo; ns, non significativo vs. WT-veicolo gruppo; ++++p < 0.0001 vs. Fmr1 KO2 veicolo gruppo. N = 10 per gruppo.
Il tempo trascorso grooming era significativamente aumentato nei topi Fmr1 KO2 rispetto ai controlli WT (Figura 4B, F(8,81) = 41.99, p < 0.0001). Nei topi Fmr1 KO2, l’iniezione di gaboxadolo (0.5 mg/kg) ha normalizzato il tempo trascorso a governare ai livelli WT (Figura 4B).
La stereotipia è definita come movimenti ripetitivi e ritualistici ed è comune nell’autismo e nella FXS. Nei topi, le attività stereotipiche come il bobbing della testa possono essere misurate quantificando le interruzioni dei raggi infrarossi nella gabbia di prova. Conteggi stereotipia erano significativamente aumentati in topi Fmr1 KO2 rispetto ai controlli WT (Figura 4C, F (8,81) = 19.93, p < 0.0001). I topi Fmr1 KO2 iniettati con gaboxadolo (0.5 mg/kg) avevano normalizzato il comportamento stereotipato ai livelli WT (Figura 4C).
Discussione
I sintomi clinici della FXS possono includere iperattività, ansia, memoria e deficit di apprendimento, anomalie sociali, aggressività e comportamenti ripetitivi. In tutti i casi, il trattamento con 0.5 mg/kg di gaboxadolo ha ripristinato il comportamento dei topi Fmr1 KO2 ai livelli WT (riassunti nella Figura 5). Questi dati forniscono un ulteriore supporto per l’aumento dell’attività dSEGA e l’inibizione tonica da gaboxadolo come una strategia terapeutica che merita ulteriori indagini in individui con FXS.

Figura 5. Effetti comportamentali complessivi di gaboxadolo in topi Fmr1 KO2. Riassunto dei risultati della valutazione comportamentale dei topi Fmr1 KO2 trattati con veicolo o gaboxadolo (0.5-5.0 mg/kg) rispetto ai controlli WT littermate. I topi Fmr1 KO2 hanno mostrato fenotipi significativi nell’attività locomotoria, comportamenti legati all’ansia, irritabilità e aggressività, e comportamenti ripetitivi. Tutti questi fenotipi sono stati costantemente normalizzati ai livelli WT dal trattamento con gaboxadolo alla dose 0.5 mg/kg. Il comportamento “normale” (quadrati verdi) è coerente con i topi trattati con il veicolo WT ed è statisticamente diverso dai topi trattati con il veicolo Fmr1 KO2 (KO). Comportamento “anormale” (quadrati rossi) è coerente con Fmr1 KO2 (KO) topi trattati con il veicolo ed è statisticamente diverso dai topi trattati con il veicolo WT. I quadrati gialli indicano una differenza che non è significativamente diverso da topi WT o statisticamente diverso da Fmr1 KO2 (KO) topi trattati con il veicolo.
L’iperattività locomotoria è una caratteristica di FXS umano (Bailey et al., 2008; Wheeler et al., 2014; Hagerman et al., 2017). Nello studio attuale, i topi Fmr1 KO2 hanno mostrato una maggiore attività locomotoria che è stata normalizzata dal gaboxadolo. Il lavoro precedente nei topi Fmr1 KO olandese-belga ha anche mostrato un fenotipo coerente di iperattività che è stato invertito con il trattamento con gaboxadolo, tuttavia ad una dose più alta (Olmos-Serrano et al., 2011). Potenziali spiegazioni per questa differenza includono: regolazione differenziale di Gabrd mRNA (D’Hulst et al., 2006; Curia et al., 2009), alterata espressione superficiale dei recettori GABA extrasinaptici (Zhang et al., 2017), effetti sulla struttura del cervello (Lai et al., 2016), o differenze nelle manifestazioni comportamentali della mutazione (Pietropaolo et al., 2011; Spencer et al., 2011). Ognuno potrebbe essere mediato dal risultato del background genetico, come il lavoro precedente è stato fatto utilizzando topi FVB mentre gli animali studiati qui erano C57BL/6J. Sottili differenze nelle attrezzature di laboratorio, la manipolazione degli animali, e anche le condizioni di alloggio, che sono consolidati modificatori del comportamento del mouse, possono anche contribuire (Crabbe et al., 1999; Wahlsten et al., 2006).
I risultati di tre test di ansia, distanza centrale nel OFT, luce / buio box, e SAT, dimostrano un fenotipo robusto nel mouse Fmr1 KO2 che è invertito dal trattamento con gaboxadol. Va notato che l’iperattività potrebbe confondere i risultati di OFT e light/dark box. Tuttavia, il comportamento legato all’ansia osservato nel SAT si verifica indipendentemente dai cambiamenti dell’attività locomotoria (rivisto in Deacon, 2013); e mentre l’effetto dell’ansia nel KO è nella direzione opposta di quello che si osserva nei pazienti con FXS (Bailey et al., 2008), i nostri risultati sono coerenti con i rapporti precedenti che descrivono il fenotipo del topo FXS (rivisto da Kazdoba et al., 2014). Tuttavia, sarà importante che gli studi futuri mirino a chiarire ulteriormente l’effetto dell’ansia in questi topi. Nonostante questo, e soprattutto, i nostri dati dimostrano che il gaboxadolo normalizza il comportamento di ansia aberrante osservato nel modello di topo FXS così come in tutti gli altri comportamenti valutati nelle nostre analisi.
Irritabilità e comportamenti aggressivi, modellati misurando SIs con un nuovo compagno di gabbia, sono stati anche aumentati nei topi Fmr1 KO2 e invertiti da gaboxadolo. Un recente studio ha riportato che quasi tutti (>90%) i maschi e le femmine con FXS intervistati si sono impegnati in qualche aggressione nei 12 mesi precedenti. Tra questi, il 33% dei maschi e il 20% delle femmine ha mostrato un’aggressività grave, sufficiente a causare lesioni ai care givers (Wheeler et al., 2016). L’autolesionismo e il comportamento impulsivo sono anche più prevalenti negli individui con FXS (Arron et al., 2011).
I comportamenti ripetitivi e la stereotipia erano costantemente aumentati nei topi Fmr1 KO2 e alleviati dal trattamento con gaboxadolo. I comportamenti ripetitivi possono causare gravi problemi per il funzionamento quotidiano e possono diventare una barriera per l’apprendimento e la SI (Leekam et al., 2011). Paradigmi che valutano i comportamenti stereotipati e deficit socio-emotivi potrebbero quindi essere utili per valutare nuovi farmaci per la loro efficacia per migliorare i fenotipi autistici in FXS.
Gaboxadol normalizzato tutti i deficit comportamentali testati di topi Fmr1 KO2 ad una dose di 0.5 mg/kg. Mentre dosi più elevate hanno normalizzato anche l’irritabilità e i comportamenti aggressivi, questo non è stato osservato per altri domini comportamentali valutati. Una spiegazione per la finestra di efficacia un po’ stretta osservata qui può venire dal lavoro precedente che mostra l’elaborazione delle informazioni compromessa da inibizione tonica insufficiente o in eccesso, il processo fisiologico che gaboxadol potenzia. Secondo questo modello, il beneficio comportamentale del farmaco ad alte dosi sarebbe compensato da deficit farmacologicamente introdotti FXS-indipendenti (Duguid et al., 2012).
I nostri risultati forniscono una solida prova del potenziale beneficio del gaboxadolo nell’invertire i comportamenti correlati all’ASD, l’aggressività e la socievolezza. Presi insieme, questi risultati supportano l’ipotesi che il potenziamento dei recettori GABAA extrasinaptici da parte del gaboxadolo può essere di beneficio negli individui con FXS. In conclusione, questi dati supportano la futura valutazione del gaboxadolo in individui con FXS, in particolare per quanto riguarda i sintomi di iperattività, ansia, stereotipia ASD correlati, socievolezza, irritabilità, aggressività e cognizione.
Dichiarazione etica
Tutti gli esperimenti sono stati eseguiti con l’approvazione del Comitato etico dell’Istituto di ecologia e biodiversità, Università del Cile, Santiago, Cile.
Contributi degli autori
BA e MD hanno iniziato questo lavoro e hanno lavorato con PC e RD per sviluppare un piano sperimentale. PC e RD hanno scritto un rapporto tecnico che riassume i risultati, che JW-S ha utilizzato per produrre un manoscritto pronto per la pubblicazione. MvS, come altri autori, ha contribuito all’interpretazione dei risultati. Tutti gli autori hanno fornito un feedback sul manoscritto prima della presentazione.
Finanziamento
Questo studio è stato sponsorizzato e pagato interamente da Ovid Therapeutics Inc, New York, NY, USA.
Dichiarazione sul conflitto di interessi
PC e RD sono fondatore/CEO e CSO di Gen. DDI Limited, che è stata incaricata da Ovid Therapeutics di svolgere il lavoro sperimentale qui descritto. PC e RD sono attualmente capo e membro del team di FRAXA-DVI. JW-S, attraverso NeuroJenic Consulting, LLC, è stato incaricato di redigere questo manoscritto per la pubblicazione. MvS, BA e MD sono impiegati a tempo pieno alla Ovid Therapeutics e detengono anche azioni o stock option.
Arron, K., Oliver, C., Moss, J., Berg, K., and Burbidge, C. (2011). La prevalenza e la fenomenologia del comportamento autolesionista e aggressivo nelle sindromi genetiche. J. Intellect. Disabil. Res. 55, 109-120. doi: 10.1111/j.1365-2788.2010.01337.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Auerbach, B. D., and Bear, M. F. (2010). Perdita della proteina X fragile ritardo mentale disaccoppia metabotropico recettore del glutammato dipendente priming di potenziamento a lungo termine dalla sintesi proteica. J. Neurophysiol. 104, 1047-1051. doi: 10.1152/jn.00449.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Bailey, D. B. Jr., Raspa, M., Olmsted, M., e Holiday, D. B. (2008). Co-occurring condizioni associate con variazioni del gene FMR1: risultati di un sondaggio nazionale genitore. Am. J. Med. Genet. A 146A, 2060-2069. doi: 10.1002/ajmg.a.32439
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassell, G. J., and Warren, S. T. (2008). Sindrome dell’X fragile: perdita di regolazione mRNA locale altera lo sviluppo e la funzione sinaptica. Neuron 60, 201-214. doi: 10.1016/j.neuron.2008.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourin, M., e Hascoët, M. (2003). Il test della scatola luce/buio del topo. Eur. J. Pharmacol. 463, 55-65. doi: 10.1016/s0014-2999(03)01274-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, G. R., Li, X. Y., Xiang, Y. D., Liu, D., McClintock, S. M., and Zeng, Y. (2017). L’implicazione del recettore AMPA nella compromissione della plasticità sinaptica e la disabilità intellettuale nella sindrome X fragile. Physiol. Res. 66, 715-727.
PubMed Abstract | Google Scholar
Crabbe, J. C., Wahlsten, D., e Dudek, B. C. (1999). Genetica del comportamento del topo: interazioni con l’ambiente di laboratorio. Scienza 284, 1670-1672. doi: 10.1126/science.284.5420.1670
PubMed Abstract | CrossRef Full Text | Google Scholar
Curia, G., Papouin, T., Séguéla, P., e Avoli, M. (2009). Downregulation di inibizione GABAergic tonica in un modello murino della sindrome X fragile. Cereb. Cortex 19, 1515-1520. doi: 10.1093/cercor/bhn159
PubMed Abstract | CrossRef Full Text | Google Scholar
Dahlhaus, R. (2018). Di uomini e topi: modellazione della sindrome X fragile. Front. Mol. Neurosci. 11:41. doi: 10.3389/fnmol.2018.00041
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M. (2013). Il test vicoli successivi di ansia nei topi e ratti. J. Vis. Exp. 76:e2705. doi: 10.3791/2705
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M., Glass, L., Snape, M., Hurley, M. J., Altimiras, F. J., Biekofsky, R. R., et al. (2015). NNZ-2566, un nuovo analogo di (1-3) IGF-1, come un potenziale agente terapeutico per la sindrome X fragile. Neuromolecular Med. 17, 71-82. doi: 10.1007/s12017-015-8341-2
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., De Geest, N., Reeve, S. P., Van Dam, D., De De Deyn, P. P., Hassan, B. A., et al. (2006). Diminuzione dell’espressione del recettore GABAA nella sindrome dell’X fragile. Brain Res. 1121, 238-245. doi: 10.1016/j.brainres.2006.08.115
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., Heulens, I., Van der Aa, N., Goffin, K., Koole, M., Porke, K., et al. (2015). Tomografia ad emissione di positroni (PET) quantificazione dei recettori GABAA nel cervello di pazienti X fragile. PLoS One 10:e0131486. doi: 10.1371/journal.pone.0131486
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., e Kooy, R. F. (2007). Il recettore GABAA: un nuovo bersaglio per il trattamento della X fragile? Trends Neurosci. 30, 425-431. doi: 10.1016/j.tins.2007.06.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Dölen, G., Osterweil, E., Rao, B. S., Smith, G. B., Auerbach, B. D., Chattarji, S., et al. (2007). Correzione della sindrome X fragile nei topi. Neuron 56, 955-962. doi: 10.1016/j.neuron.2007.12.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Duguid, I., Branco, T., Londra, M., Chadderton, P., e Hausser, M. (2012). Inibizione tonica migliora la fedeltà della trasmissione delle informazioni sensoriali nella corteccia cerebellare. J. Neurosci. 32, 11132-11143. doi: 10.1523/jneurosci.0460-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Gantois, I., Vandesompele, J., Speleman, F., Reyniers, E., D’Hooge, R., Severijnen, L. A., et al. Espressione profilo suggerisce sottoespressione del recettore GABAA subunità delta nel modello di topo fragile X knockout. Neurobiol. Dis. 21, 346-357. doi: 10.1016/j.nbd.2005.07.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Gaudissard, J., Ginger, M., Premoli, M., Memo, M., Frick, A., e Pietropaolo, S. (2017). Anomalie comportamentali nel modello murino Fmr1-KO2 della sindrome dell’X fragile: la rilevanza delle prime fasi della vita. Autism Res. 10, 1584-1596. doi: 10.1002/aur.1814
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, C., Hoffmann, A., Bassell, G. J., and Berry-Kravis, E. M. (2015). Strategie terapeutiche nella sindrome X fragile: dal banco al capezzale e ritorno. Neurotherapeutics 12, 584-608. doi: 10.1007/s13311-015-0355-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R. J., Berry-Kravis, E., Hazlett, H. C., Bailey, D. B. Jr., Moine, H., Kooy, R. F., et al. (2017). Sindrome dell’X fragile. Nat. Rev. Dis. Primers 3:17065. doi: 10.1038/nrdp.2017.65
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R., Hoem, G., and Hagerman, P. (2010). X fragile e autismo: intrecciati a livello molecolare che portano a trattamenti mirati. Mol. Autism 1:12. doi: 10.1186/2040-2392-1-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Barnett, R. P., and Hustyi, K. M. (2016). Comportamento problematico nei ragazzi adolescenti con la sindrome dell’X fragile: prevalenza relativa, frequenza e gravità. J. Intellect. Disabil. Res. 60, 1189-1199. doi: 10.1111/jir.12341
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Jiang, H., Reiss, A. L., e Greicius, M. D. (2013). Identificazione di reti cerebrali su larga scala nella sindrome X fragile. JAMA Psychiatry 70, 1215-1223. doi: 10.1001/jamapsychiatry.2013.247
PubMed Abstract | CrossRef Full Text | Google Scholar
Kazdoba, T. M., Leach, P. T., Silverman, J. L., e Crawley, J. N. (2014). Modellazione della sindrome X fragile nel topo knockout Fmr1. Intractable Rare Dis. Res. 3, 118-133. doi: 10.5582/irdr.2014.01024
PubMed Abstract | CrossRef Full Text | Google Scholar
Lai, J. K., Lerch, J. P., Doering, L. C., Foster, J. A., e Ellegood, J. (2016). Cambiamenti dei volumi cerebrali regionali nel topo adulto maschio FMR1-KO sul ceppo FVB. Neuroscience 318, 12-21. doi: 10.1016/j.neuroscience.2016.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Leboucher, A., Pisani, D. F., Martinez-Gili, L., Chilloux, J., Bermudez-Martin, P., Van Dijck, A., et al. (2019). Il regolatore traslazionale FMRP controlla il metabolismo dei lipidi e del glucosio nei topi e negli esseri umani. Mol. Metab. 21, 22-35. doi: 10.1016/j.molmet.2019.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leekam, S. R., Prior, M. R., and Uljarevic, M. (2011). Comportamenti limitati e ripetitivi nei disturbi dello spettro autistico: una revisione della ricerca negli ultimi dieci anni. Psychol. Bull. 137, 562-593. doi: 10.1037/a0023341
PubMed Abstract | CrossRef Full Text | Google Scholar
Lightbody, A. A., e Reiss, A. L. (2009). Gene, cervello, e le relazioni di comportamento nella sindrome X fragile: prove da studi di neuroimaging. Dev. Disabil. Res. Rev. 15, 343-352. doi: 10.1002/ddrr.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Meera, P., Wallner, M., e Otis, T. S. (2011). Base molecolare per l’alta sensibilità THIP/gaboxadolo dei recettori GABAA extrasinaptici. J. Neurophysiol. 106, 2057-2064. doi: 10.1152/jn.00450.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Mientjes, E. J., Nieuwenhuizen, I., Kirkpatrick, L., Zu, T., Hoogeveen-Westerveld, M., Severijnen, L., et al. La generazione di un modello di topo knock out Fmr1 condizionale per studiare la funzione Fmrp in vivo. Neurobiol. Dis. 21, 549-555. doi: 10.1016/j.nbd.2005.08.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Corbin, J. G., e Burns, M. P. (2011). L’agonista del recettore GABAA THIP migliora i deficit comportamentali specifici nel modello murino della sindrome X fragile. Dev. Neurosci. 33, 395-403. doi: 10.1159/000332884
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Paluszkiewicz, S. M., Martin, B. S., Kaufmann, W. E., Corbin, J. G., e Huntsman, M. M. (2010). Difettosa neurotrasmissione GABAergica e salvataggio farmacologico di ipereccitabilità neuronale nell’amigdala in un modello murino di sindrome X fragile. J. Neurosci. 30, 9929-9938. doi: 10.1523/JNEUROSCI.1714-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Osterweil, E. K., Krueger, D. D., Reinhold, K., e Bear, M. F. (2010). Ipersensibilità a mGluR5 e ERK1/2 porta alla sintesi proteica eccessiva nell’ippocampo di un modello murino della sindrome X fragile. J. Neurosci. 30, 15616-15627. doi: 10.1523/JNEUROSCI.3888-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pietropaolo, S., Guilleminot, A., Martin, B., D’Amato, F. R., e Crusio, W. E. (2011). Genetico-sfondo modulazione del nucleo e variabile autistico-come sintomi in Fmr1 topi knock-out. PLoS One 6:e17073. doi: 10.1371/journal.pone.0017073
PubMed Abstract | CrossRef Full Text | Google Scholar
Prut, L., e Belzung, C. (2003). Il campo aperto come paradigma per misurare gli effetti dei farmaci sui comportamenti simili all’ansia: una revisione. Eur. J. Pharmacol. 463, 3-33. doi: 10.1016/s0014-2999(03)01272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rotschafer, S. E., Marshak, S., e Cramer, K. S. (2015). Delezione di Fmr1 altera la funzione e gli ingressi sinaptici nel tronco cerebrale uditivo. PLoS One 10:e0117266. doi: 10.1371/journal.pone.0117266
PubMed Abstract | CrossRef Full Text | Google Scholar
Scharf, S. H., Jaeschke, G., Wettstein, J. G., e Lindemann, L. (2015). Recettore metabotropico del glutammato 5 come bersaglio farmacologico per la sindrome dell’X fragile. Curr. Opin. Pharmacol. 20, 124-134. doi: 10.1016/j.coph.2014.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N. S., Popp, S., Vialou, V., Astafurov, K., Nestler, E. J., and Dow-Edwards, D. (2016). Effetti del gaboxadolo sull’espressione della sensibilizzazione alla cocaina nei ratti. Exp. Clin. Psychopharmacol. 24, 131-141. doi: 10.1037/pha0000069
PubMed Abstract | CrossRef Full Text | Google Scholar
Spencer, C. M., Alekseyenko, O., Hamilton, S. M., Thomas, A. M., Serysheva, E., Yuva-Paylor, L. A., et al. Modificare i fenotipi comportamentali in topi Fmr1KO: le differenze di background genetico rivelano risposte simili all’autismo. Autism Res. 4, 40-56. doi: 10.1002/aur.168
PubMed Abstract | CrossRef Full Text | Google Scholar
The Dutch-Belgian Fragile X Consortium, Bakker, C. E., Verheij, C., Willemsen, R., van der Helm, R., Oerlemans, F., et al. Fmr1 topi knockout: un modello per studiare il ritardo mentale X fragile. Cell 78, 23-33. doi: 10.1016/0092-8674(94)90569-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tranfaglia, M. R., Thibodeaux, C., Mason, D. J., Brown, D., Roberts, I., Smith, R., et al. (2019). Repurposing dei farmaci disponibili per i disturbi del neurosviluppo: l’esperienza di X fragile. Neuropharmacology 147, 74-86. doi: 10.1016/j.neuropharm.2018.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahlsten, D., Bachmanov, A., Finn, D. A., e Crabbe, J. C. (2006). Stabilità delle differenze di ceppo di topo inbred nel comportamento e le dimensioni del cervello tra i laboratori e attraverso i decenni. Proc. Natl. Acad. Sci. U S A 103, 16364-16369. doi: 10.1073/pnas.0605342103
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A., Raspa, M., Bann, C., Bishop, E., Hessl, D., Sacco, P., et al. Ansia, problemi di attenzione, iperattività e la lista di controllo del comportamento aberrante nella sindrome dell’X fragile. Am. J. Med. Genet. A 164A, 141-155. doi: 10.1002/ajmg.a.36232
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A. C., Raspa, M., Bishop, E., and Bailey, D. B. Jr. (2016). Aggressione nella sindrome dell’X fragile. J. Intellect. Disabil. Res. 60, 113-125. doi: 10.1111/jir.12238
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, N., Peng, Z., Tong, X., Lindemeyer, A. K., Cetina, Y., Huang, C. S., et al. (2017). Diminuita espressione di superficie della subunità delta del recettore GABAA contribuisce alla ridotta inibizione tonica nelle cellule del granulo dentato in un modello murino di sindrome X fragile. Exp. Neurol. 297, 168-178. doi: 10.1016/j.expneurol.2017.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar