- Introduzione
- Epidemiologia
- L’organismo e la fisiopatologia della diarrea da C. difficile
- Manifestazioni cliniche
- Diagnosi
- Linee guida pratiche per la diagnosi di sindromi diarroiche da C. difficile
- Diagnosi endoscopica di diarrea e colite da C. difficile
- Trattamento
- Gestione della diarrea da C. difficile ricorrente
- Colite grave da C. difficile
- Conclusione
Introduzione
La diarrea associata a Clostridium difficile (CDAD) è stata riconosciuta con maggiore frequenza come causa di malattia nosocomiale. La frequenza e l’incidenza della CDAD varia ampiamente, ed è influenzata da molteplici fattori tra cui focolai nosocomiali, modelli di uso antimicrobico e suscettibilità individuale. Non ci sono rapporti di studi prospettici da parte degli ospedali che tracciano la tossina A o A/B positiva e gli esiti di CDAD e le sue complicazioni.
I Centri per il controllo e la prevenzione delle malattie (CDC) hanno analizzato le tendenze secolari nell’incidenza di CDAD, e hanno riportato un aumento costante dal 1987 al 2001 (1). In questo rapporto, il 30% dei 440 medici di malattie infettive che hanno partecipato a un sondaggio basato sul web ha riferito che stanno vedendo tassi più elevati di CDAD, CDAD più grave, e più CDAD recidivante che in passato. C’è l’impressione generale che ci sia stato un aumento della proporzione di casi con complicazioni gravi e fatali, e un aumento del tasso di ricaduta tra i pazienti colpiti.
Oltre alla morbilità e alla mortalità, il peso economico dell’infezione da C. difficile in termini di dimissioni ritardate e altri costi ospedalieri è considerevole.
Epidemiologia
La frequenza e l’incidenza della CDAD varia tra gli ospedali e all’interno di una data istituzione nel tempo. Il rischio di malattia aumenta nei pazienti con esposizione agli antibiotici, interventi chirurgici gastrointestinali, aumento della durata della permanenza nelle strutture sanitarie, gravi malattie di base, condizioni di immunocompromissione ed età avanzata.
C. difficile viene diffuso nelle feci. Qualsiasi superficie, dispositivo o materiale (ad esempio, commode, vasca da bagno e termometro rettale elettronico) che viene contaminato con le feci può fungere da serbatoio per le spore di C. difficile. Le spore vengono trasferite ai pazienti principalmente attraverso le mani del personale sanitario che ha toccato una superficie o un oggetto contaminato (2-6).
 clicca per la versione grande
clicca per la versione grande
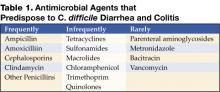
Figura 1 . La radiografia digitale della TAC mostra un ispessimento nodulare del colon trasverso.
L’organismo e la fisiopatologia della diarrea da C. difficile
C. difficile è un bacillo gram-positivo, anaerobio, che forma spore ed è responsabile dello sviluppo di diarrea e colite associate agli antibiotici. C. difficile è stato descritto per la prima volta nel 1935 come componente della flora fecale dei neonati sani e inizialmente non si pensava fosse patogeno (7). Il bacillo è stato chiamato difficile perché cresce lentamente ed è difficile da coltivare. C. difficile è attualmente responsabile di quasi tutte le cause di colite pseudomembranosa e di ben il 20% dei casi di diarrea associata ad antibiotici senza colite. Anche se si trova nelle feci di solo il 5% della popolazione generale, ben il 21% degli adulti viene colonizzato con questo organismo durante il ricovero in ospedale (2,6).
Un’alterazione della normale microflora colonica, solitamente causata dalla terapia antibiotica, è il principale fattore che predispone all’infezione da C. difficile. Quasi tutti gli antibiotici sono stati associati a diarrea e colite da C. difficile. Gli antibiotici più frequentemente associati includono clindamicina, cefalosporine, ampicillina e amoxicillina (Tabella 1) (8).
Oltre alla terapia antibiotica, l’età avanzata e la gravità della malattia sottostante sono importanti fattori di rischio per l’infezione da C. difficile. Altri fattori di rischio includono la presenza di un sondino nasogastrico, procedure gastrointestinali, farmaci antisecretori acidi, soggiorno in unità di terapia intensiva e durata del ricovero (9).
La diarrea da C. difficile è causata principalmente dall’elaborazione delle tossine A e B prodotte dalla moltiplicazione batterica nel lume intestinale. Queste tossine si legano alla mucosa del colon ed esercitano i loro effetti deleteri su di essa. L’organismo raramente danneggia il colon per invasione diretta, e la diarrea è causata dagli effetti delle tossine prodotte nel lume intestinale che aderiscono alla superficie della mucosa. La maggior parte degli isolati tossigeni produce entrambe le tossine, e circa il 5-25% degli isolati non produce né la tossina A né la B, e non causa colite o diarrea (3-5).
Manifestazioni cliniche
L’infezione da C. difficile può produrre una vasta gamma di manifestazioni cliniche, compreso il trasporto asintomatico, diarrea lieve-moderata, e malattia fulminante con colite pseudomembranosa (10). Nei pazienti che sviluppano la CDAD, i sintomi di solito iniziano subito dopo la colonizzazione. La colonizzazione può avvenire durante il trattamento antibiotico o fino a diverse settimane dopo un ciclo di antibiotici. La CDAD è tipicamente associata al passaggio di frequenti movimenti intestinali allentati, coerenti con la proctocolite. Possono essere presenti muco o sangue occulto, ma il sangue visibile è raro.
Diagnosi
La diagnosi di CDAD si basa su una storia di terapia antibiotica recente o in corso, lo sviluppo di diarrea o altre prove di colite acuta, e la dimostrazione di infezione da C. difficile tossico, di solito attraverso la rilevazione di tossina A o tossina B nel campione di feci.
 clicca per la versione grande
clicca per la versione grande
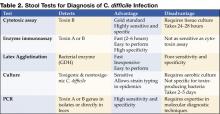
Figura 1 . La radiografia digitale della TAC mostra un ispessimento nodulare del colon trasverso.
Linee guida pratiche per la diagnosi di sindromi diarroiche da C. difficile
- La diagnosi dovrebbe essere sospettata in chiunque abbia diarrea che ha ricevuto antibiotici nei 2 mesi precedenti e/o la cui diarrea inizia 72 ore o più dopo il ricovero.
- Quando si sospetta la diagnosi, un singolo campione di feci dovrebbe essere inviato al laboratorio per l’analisi della presenza di C. difficile e/o delle sue tossine.
- Quando la diarrea persiste nonostante un risultato negativo alla tossina delle feci, uno o due campioni aggiuntivi possono essere inviati per l’analisi con gli stessi o diversi test (4). L’endoscopia è riservata a situazioni speciali, come quando è necessaria una diagnosi rapida e i risultati del test sono in ritardo o il test non è altamente sensibile, quando il paziente ha l’ileo e le feci non sono disponibili, o quando anche altre malattie del colon sono una considerazione.
Non esiste ancora un test semplice, poco costoso, rapido, sensibile e specifico per diagnosticare la diarrea da C. difficile diarrea e colite, né tutti i test disponibili sono adatti ad essere adottati da ogni laboratorio (Tabella 2) (11).
Diagnosi endoscopica di diarrea e colite da C. difficile
Sigmoidoscopia e colonscopia non sono indicate nella maggior parte dei pazienti con CDAD (10,12). L’endoscopia è utile, tuttavia, in situazioni speciali, come quando la diagnosi è in dubbio o la situazione clinica richiede una diagnosi rapida. I risultati dell’esame endoscopico possono essere normali nei pazienti con diarrea lieve o possono mostrare una colite aspecifica nei casi moderati. Il ritrovamento di pseudomembrane coloniche in un paziente con diarrea associata ad antibiotici è praticamente patognomonico per la colite da C. difficile. Alcuni pazienti senza alcuna caratteristica diagnostica nel rettosigmoide hanno pseudomembrane nelle aree più prossimali del colon (13). Altri risultati endoscopici includono eritema, edema, friabilità e colite aspecifica con piccole ulcerazioni o erosioni.
Trattamento
Il primo passo nella gestione della diarrea e della colite da C. difficile è di sospendere gli antibiotici precipitanti, se possibile (10,12). La diarrea si risolve in circa il 15-25% dei pazienti senza una specifica terapia anti-C. difficile (14,15). La gestione conservativa da sola può non essere indicata, tuttavia, nei pazienti che sono sistematicamente malati o che hanno problemi medici multipli, poiché è difficile prevedere quali pazienti miglioreranno spontaneamente. Se non è possibile interrompere l’antibiotico precipitante a causa di altre infezioni attive, il regime antibiotico del paziente dovrebbe essere modificato, se possibile, per fare uso di agenti che hanno meno probabilità di causare CDAD (ad es, aminoglicosidi, trimetoprim, rifampicina, o un chinolone).
Gli agenti antiperistaltici, come difenossilato più atropina (Lomotil), o loperamide (Imodium), e gli analgesici narcotici dovrebbero essere evitati perché possono ritardare l’eliminazione delle tossine dal colon e quindi esacerbare il danno al colon indotto dalle tossine o precipitare l’ileo e la dilatazione tossica (12,16). Una terapia specifica per eradicare il C. difficile dovrebbe essere usata nei pazienti con sintomi inizialmente gravi e nei pazienti i cui sintomi persistono nonostante la sospensione del trattamento antibiotico. Anche se la diagnosi di colite da C. difficile dovrebbe idealmente essere stabilita prima di attuare la terapia antimicrobica, le attuali linee guida ACG raccomandano che la terapia empirica sia iniziata in casi altamente suggestivi di pazienti gravemente malati (Tabella 3 a pagina 54) (12).
Attualmente, la vancomicina orale o il metronidazolo, usati per 7-10 giorni, sono considerati terapia di prima linea dalla maggior parte degli autori e dalle attuali linee guida. Il metronidazolo alla dose di 250 mg 4 volte al giorno è raccomandato dalla maggior parte degli autori e dalle linee guida ACG come il farmaco di scelta per il trattamento iniziale della colite da C. difficile (12). Queste raccomandazioni sono in gran parte basate sull’efficacia, sui costi inferiori e sulle preoccupazioni per lo sviluppo di ceppi resistenti alla vancomicina. I principali svantaggi del metronidazolo includono un profilo farmacologico meno desiderabile e controindicazioni nei bambini e nelle donne incinte.
La vancomicina, invece, alla dose di 125 mg 4 volte al giorno, è sicura e ben tollerata e raggiunge livelli di feci 20 volte superiori alla concentrazione minima inibitoria richiesta per il trattamento del C. difficile. Gli svantaggi dell’uso della vancomicina sono il costo e il potenziale sviluppo di ceppi resistenti alla vancomicina. Le attuali linee guida ACG considerano la vancomicina il farmaco di scelta nei pazienti gravemente malati e nei casi in cui l’uso del metronidazolo è precluso.
Mancano studi clinici controllati per i pazienti con colite fulminante che possono non tollerare la terapia orale. La somministrazione di metronidazolo per via endovenosa o la somministrazione di vancomicina tramite sondino nasogastrico o clistere rettale è stata descritta in piccole serie di casi (17-20). La somministrazione endovenosa di vancomicina non è raccomandata, perché il farmaco non è escreto nel colon (17).
Gestione della diarrea da C. difficile ricorrente
Nonostante il successo del trattamento iniziale della CDAD, il 15-20% dei pazienti ha una ricorrenza della diarrea in associazione con un test delle feci positivo per la tossina C. difficile. La recidiva sintomatica è raramente dovuta al fallimento del trattamento o alla resistenza antimicrobica al metronidazolo o alla vancomicina. Gli approcci alla gestione includono la terapia conservativa (tuttavia, molti pazienti sono anziani e infermi e non sono in grado di tollerare la diarrea), la terapia con antibiotici specifici anti-C. difficile, l’uso di resine leganti gli anioni, la terapia con microorganismi (probiotici) e la terapia con immunoglobuline.
La terapia più comune per la diarrea da C. difficile ricorrente è un secondo ciclo dello stesso antibiotico usato per trattare l’episodio iniziale (12). In un ampio studio osservazionale negli Stati Uniti, il 92% dei pazienti con CDAD ricorrente ha risposto con successo a un singolo ciclo ripetuto di terapia, di solito con metronidazolo o vancomicina (14). Ci sono prove che suggeriscono che i pazienti con una storia di recidiva hanno un alto rischio di ulteriori episodi di CDAD dopo la sospensione della terapia antibiotica. Non ci sono dati che suggeriscano che gli episodi sequenziali diventino progressivamente più gravi o complicati (21). Una varietà di programmi di trattamento sono stati suggeriti per i pazienti con recidive multiple di diarrea da C. difficile. Un approccio è quello di dare un corso prolungato di vancomicina (o metronidazolo) utilizzando un programma di dosaggio decrescente seguito da una terapia a impulsi (Tabella 4).
La colestiramina, una resina a scambio di anioni somministrata alla dose di 4 grammi 3 o 4 volte al giorno per 1 o 2 settimane, lega le tossine di C. difficile e può essere utilizzata in combinazione con gli antibiotici per trattare le recidive ripetute. Poiché la colestiramina può legare sia la vancomicina che le tossine, dovrebbe essere presa almeno 2 o 3 ore dopo la vancomicina.
Colite grave da C. difficile
L’incidenza della colite fulminante da C. difficile è stata riportata come 1,6-3,2% (22). Anche se mancano dati precisi recenti da altri centri, è stata riconosciuta come una causa crescente di complicazioni e morte. La sindrome clinica della colite C. difficile fulminante può essere riconosciuta con una conoscenza adeguata dello spettro di presentazione della malattia.
A. Diarrea: Anche se la diarrea è il segno distintivo della colite da C. difficile, non è invariabilmente presente, e la sua assenza può portare a confusione diagnostica. Quando la diarrea è assente, ciò sembra essere secondario ad una grave dismotilità del colon. Anche quando è presente, la diarrea può essere percepita come una componente minore di un quadro settico aspecifico.
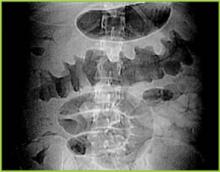 Ristampata con il permesso di BUMC Proceedings 1999; 12:249-250
Ristampata con il permesso di BUMC Proceedings 1999; 12:249-250
Figura 1 . La radiografia digitale della TAC mostra un ispessimento nodulare del colon trasverso.
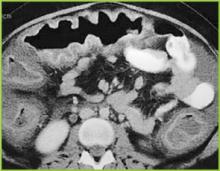 Ristampato con il permesso di BUMC Proceedings 1999; 12:249-250
Ristampato con il permesso di BUMC Proceedings 1999; 12:249-250
Figura 2 . Immagine CT dell’addome superiore conferma un marcato ispessimento haustrale nel colon trasverso.
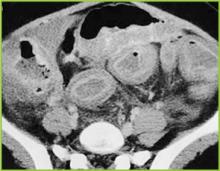 Ristampato con il permesso di BUMC Proceedings 1999; 12:249-250
Ristampato con il permesso di BUMC Proceedings 1999; 12:249-250
Figura 3 . L’immagine CT dell’addome medio dimostra un marcato ispessimento dell’intero colon. Lievi cambiamenti infiammatori sono presenti nel grasso pericolonico.
B. Malattia grave: La colite fulminante è una forma insolita di infezione da C. difficile, che si verifica solo nel 3% dei pazienti ma che rappresenta praticamente tutte le complicazioni gravi. I pazienti con forme più gravi della malattia possono presentarsi con o senza diarrea. Quando i pazienti sviluppano una colite localizzata al cieco e al lato destro del colon, la diarrea può essere minima o assente. In assenza di diarrea, gli unici indizi per la diagnosi possono essere i segni sistemici di tossicità (febbre, tachicardia, leucocitosi e/o deplezione di volume).
Un’elevata conta dei globuli bianchi può essere un importante indizio dell’imminente colite fulminante da C. difficile. La rapida elevazione della conta periferica dei globuli bianchi (comunemente fino a 30.000-50.000) con un eccesso significativo di bande e talvolta di forme più immature spesso precede l’instabilità emodinamica e lo sviluppo di disfunzioni d’organo. Anche in pazienti che sono lievemente sintomatici per un periodo prolungato, può verificarsi una progressione improvvisa e inaspettata verso lo shock. È difficile prevedere quei pazienti che potrebbero non rispondere al trattamento medico. Quindi, i segni di avvertimento precoce come una reazione leucemica possono essere preziosi.
L’ipotensione è una scoperta tardiva e può essere resistente al supporto vasopressorio. I segni addominali vanno dalla distensione alla tenerezza generalizzata con guardia. La perforazione del colon è solitamente accompagnata da rigidità addominale, guardia involontaria, tenerezza di rimbalzo e suoni intestinali assenti. L’aria libera può essere rivelata sulle radiografie addominali. Qualsiasi sospetto di perforazione in questa situazione dovrebbe richiedere un’immediata consultazione chirurgica. La morte generalmente si verifica prima che l’aria libera e la perforazione possano verificarsi. In uno studio, contrariamente alla maggior parte dell’altra letteratura, la perforazione è stata trovata essere rara (22).
La radiografia addominale può rivelare un colon dilatato (>7 cm nel suo diametro maggiore), coerente con il megacolon tossico. I pazienti con megacolon possono avere un ileo intestinale piccolo associato con intestino piccolo dilatato sulle radiografie addominali semplici, con livelli di aria-fluido che simulano un’ostruzione intestinale piccola o un’ischemia. La TAC senza contrasto e l’endoscopia possono rapidamente diagnosticare o almeno suggerire fortemente la colite C.difficile fulminante. I risultati della TAC includono evidenza di ascite, ispessimento della parete del colon e/o dilatazione. Questi risultati possono essere utili per classificare la gravità della colite.
Un intervento più aggressivo nei pazienti non responsivi dal punto di vista medico, compresa la rapida identificazione dei pazienti che non rispondono alla terapia medica, è cruciale per un risultato positivo, e un intervento chirurgico precoce dovrebbe essere fatto in questo gruppo (Figure 1-3).
È importante che tutti coloro che sono coinvolti nella cura dei pazienti negli ospedali, nelle case di cura e nelle strutture di cura qualificate siano informati sull’organismo e sulla sua epidemiologia, sugli approcci razionali al trattamento e alla cura dei pazienti con C. difficile diarrea, l’importanza del lavaggio delle mani tra un contatto e l’altro con i pazienti, l’uso dei guanti quando si cura un paziente con diarrea da C. difficile, e l’evitare l’uso non necessario di antimicrobici.
Conclusione
Gli anni recenti hanno sollevato preoccupazioni per l’aumento dell’incidenza e dei tassi di complicazioni gravi della CDAD negli ospedali del Nord America (22,23). La rivista Canadian Medical Association ha pubblicato un rapporto nel 2004 che descriveva in dettaglio un focolaio di CDAD che coinvolgeva diversi ospedali di Montreal. L’introduzione di nuovi ceppi ipervirulenti e altamente trasmissibili di C. difficile è stata postulata come possibile causa dell’epidemia (24). Un’infrastruttura deteriorata, pratiche inadeguate di controllo delle infezioni, il numero crescente di pazienti debilitati, una popolazione che invecchia e ceppi ipervirulenti sono stati ritenuti tutti probabili contributori alle recenti epidemie in Canada (25).
Due indagini epidemiologiche negli Stati Uniti e in Canada (24,26) hanno esaminato indipendentemente campioni di C. difficile e hanno trovato che una versione mutata del ceppo “selvatico” era responsabile delle epidemie in Quebec e dell’aumento dei tassi di CDAD negli ospedali degli Stati Uniti recentemente (22,23). Gli epidemiologi clinici del CDC hanno studiato gli isolati di C. difficile dagli ospedali degli Stati Uniti con recenti (cioè, 2001-2004) focolai di CDAD (22,23). Il rapporto indica l’emergere di un nuovo ceppo epidemico, “BI” (distinto dal ceppo “J” del 1989-1992), che può essere responsabile del recente aumento dei tassi e della gravità apparente della CDAD (26).
La CDAD e la colite nella maggior parte dei casi possono essere trattate con la somministrazione di metronidazolo o vancomicina. In alcuni pazienti, nonostante un trattamento medico appropriato e tempestivo, si sviluppa una tossicità grave e pericolosa per la vita, ed è necessario un intervento chirurgico. I sintomi sistemici dell’infezione da C. difficile non derivano dalla batteriemia, dalla perforazione del colon o dall’ischemia, ma da mediatori infiammatori indotti dalla tossina rilasciati dal colon (27-29). L’intervento chirurgico precoce dovrebbe essere impiegato nei casi refrattari di malattia grave. L’intervento chirurgico è lontano dall’ideale, tuttavia, e comporta un tasso molto alto di complicazioni e un rischio significativo di mortalità (22). Il futuro approccio clinico al trattamento della colite nosocomiale da C. difficile potrebbe alla fine coinvolgere iperimmunoglobuline antitossina specifiche e inibitori della cascata infiammatoria (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Tendenza secolare nella malattia da Clostridium difficile acquisita in ospedale negli Stati Uniti; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Colite associata agli antibiotici. In: Mandell G, Bennet JE, Dolin R, eds. Principi e pratica delle malattie infettive. 4a ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrea: Patogenesi, epidemiologia e trattamento. Gastroenterologo. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: storia del suo ruolo come patogeno enterico e lo stato attuale delle conoscenze sull’organismo. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Epidemiologia ospedaliera e controllo delle infezioni. Baltimora, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Acquisizione nosocomiale di Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Flora intestinale nei neonati: Con una descrizione di un nuovo anaerobo patogeno, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Trattamento della diarrea e della colite da Clostridium difficile. In: Wolfe MM, ed. Farmacoterapia gastrointestinale. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Fattori di rischio per l’infezione da Clostridium difficile. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Colite da Clostridium difficile. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Colite da clostridium difficile. In: Lamont JT, ed. Infezioni gastrointestinali: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Linee guida per la diagnosi e la gestione di diarrea e colite associate a Clostridium difficile. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Risparmio rettale nella colite pseudomembranosa associata ad antibiotici: Uno studio prospettico. Gastroenterologia. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Dieci anni di sorveglianza prospettica della malattia associata a Clostridium difficile e trattamento al Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Studio prospettico randomizzato di metronidazolo contro vancomicina per diarrea e colite associate a Clostridium difficile. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Trattamento della diarrea associata a Clostridium difficile. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Vancomicina intracolonica aggiuntiva per la colite grave da Clostridium difficile: serie di casi e revisione della letteratura. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Metronidazolo per via endovenosa per il trattamento della colite da Clostridium difficile. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Diarrea ricorrente da Clostridium difficile: caratteristiche e fattori di rischio per i pazienti arruolati in uno studio prospettico, randomizzato, in doppio cieco. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Clostridium difficile fulminante: una causa sottovalutata e crescente di morte e complicazioni. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Colite da Clostridium difficile: una malattia iatrogena sempre più aggressiva? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergenza di un ceppo epidemico di Clostridium difficile negli Stati Uniti, 2001-4: Ruolo potenziale dei fattori di virulenza e dei tratti di resistenza antimicrobica. Infectious Diseases Society of America 42th Annual Meeting. Boston, MA, 30 settembre – 3 ottobre 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Aumento della sostanza P risposte nei gangli della radice dorsale, macrofagi intestinali durante Clostridium difficile tossina A enterite nei ratti. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile tossina A stimola la produzione di macrofagi-infiammatori protein-2 in cellule epiteliali intestinali di ratto. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Sopravvivenza del concentrato di immunoglobulina bovina anti-Clostridium difficile nel tratto gastrointestinale umano. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Terapia con immunoglobuline endovena per una grave colite da Clostridium difficile. Gut. 1997;41:366-70.