Introduzione
La malattia renale cronica (CKD) è associata a un’elevata mortalità, in particolare di origine cardiovascolare. Tuttavia, la limitata associazione tra la mortalità e i tradizionali fattori di rischio cardiovascolare in questi pazienti è paradossale. Solo alcuni marcatori legati all’infiammazione o alla nutrizione (ad esempio la proteina C-reattiva e l’albumina sierica) hanno dimostrato di essere predittori coerenti di mortalità nella CKD.1
Negli ultimi anni alcuni studi osservazionali hanno mostrato un’associazione tra elevate concentrazioni sieriche di fosfatasi alcalina totale (ALP) e mortalità nei pazienti con CKD2-5; tuttavia, il significato biologico e clinico di questa scoperta rimane sconosciuto.
La gamma-glutamil transferasi (GGT) è un enzima presente nel siero e sulla superficie esterna delle cellule di diversi organi come il fegato, il pancreas, l’intestino, i polmoni e i reni.6 La GGT sierica non è solo un marcatore tradizionale del consumo di alcol e delle malattie epatobiliari, ma diversi studi hanno anche dimostrato un’associazione tra livelli elevati di GGT sierica e malattie cardiovascolari, diabete mellito, ipertensione e sindrome metabolica.7
I livelli di GGT sono un predittore di mortalità nella popolazione generale; infatti, questo enzima è stato recentemente incluso come uno di una serie di parametri biochimici che predicono la mortalità.8 Inoltre, i livelli sierici di GGT potrebbero aiutare a interpretare valori elevati di ALP di origine non chiara.
Sono pochi gli studi che hanno analizzato il significato clinico e prognostico della GGT sierica nella CKD.9,10 Lo scopo di questo studio è stato quello di indagare le caratteristiche cliniche dei pazienti CKD con livelli sierici di GGT anormalmente elevati e la loro interazione con l’ALP, e di determinare il valore di questo parametro come predittore di mortalità.
Materiali e metodi
Questo è uno studio retrospettivo e osservazionale condotto su una coorte di pazienti adulti seguiti nell’ambulatorio per pazienti a bassa clearance (CKD avanzata) del reparto di nefrologia dell’ospedale Infanta Cristina, Badajoz, Spagna, da gennaio 2002 a ottobre 2013. Lo studio ha incluso tutti i pazienti pre-dialisi di età >18 anni con una velocità di filtrazione glomerulare stimata (eGFR)
mL/min/1.73m2. I pazienti con CKD dovuta a disfunzione da trapianto renale non sono stati inclusi.
I dati demografici e i parametri clinici come età, sesso, indice di massa corporea (BMI), comorbidità e farmaci sono stati registrati al momento dell’inclusione.
La comorbidità è stata valutata usando il punteggio Davies,11 e i pazienti sono stati classificati secondo l’aggregato delle loro diverse comorbidità: nessuna comorbidità, lieve-moderata (1 o 2 processi comorbidi), o grave (3 o più processi comorbidi). Le principali comorbidità registrate erano: diabete mellito, insufficienza cardiaca, malattia coronarica, malattia cerebrovascolare o vascolare periferica, malattia polmonare ostruttiva cronica, cancro e processi infiammatori cronici.
Nel presente studio, il termine “malattia del fegato” non solo includeva pazienti con diagnosi di malattie croniche del fegato, cirrosi o trapianti di fegato, ma anche pazienti con alcolismo attivo, o infezione attiva da virus epatotropo (B o C). La steatoepatite non alcolica (malattia del fegato grasso) era un reperto ecografico comune tra questi pazienti, anche se questa malattia non era inclusa nell’elenco delle malattie del fegato.
I pazienti sono stati seguiti regolarmente dal momento dell’inclusione nello studio fino alla loro morte, trapianto renale, perdita al follow-up o la fine del periodo di raccolta dati (31 dicembre 2014).
Dato il disegno retrospettivo dello studio, non è stato ottenuto il consenso informato individuale.
Misurazioni biochimiche
A partire dal gennaio 2002, la GGT sierica e l’ALP totale sono state aggiunte alle misure di routine dei parametri biochimici nei pazienti della nostra clinica CKD avanzata.
I livelli di GGT sono stati determinati utilizzando un autoanalizzatore (Advia Chemistry, Siemens Healthcare Diagnostics, New York, USA) con metodo cinetico colorimetrico con gamma-glutamyl-3-carboxy-4-nitroanilide e glicilglicina. Il coefficiente di variazione è inferiore al 4,5% e il range di riferimento 0-36U/L.
I livelli sierici di ALP sono stati misurati anche tramite autoanalizzatore (Advia Chemistry), con il metodo ALPI, che quantifica l’attività della fosfatasi alcalina misurando la transfosforilazione del p-nitrofenilfosfato a p-nitrofenolo in presenza di 2-amino-2-metil-1-propanolo. Il coefficiente di variazione era inferiore al 4% e il range di riferimento era 45-120U/L.
Per caratterizzare i pazienti con GGT o ALP sieriche anormalmente elevate, sono stati inclusi nello studio anche i parametri ematologici e biochimici di base (indicati nella tabella 1). I parametri biochimici sono stati determinati con metodi di laboratorio convenzionali (Advia Chemistry, New York, USA). I livelli dell’ormone paratiroideo (molecola 7-84) (PTH) sono stati determinati mediante un test automatico di chemiluminescenza (DiaSorin, Italia), le concentrazioni di albumina nel siero mediante il metodo del verde di bromocresolo e la proteina C-reattiva ad alta sensibilità mediante test immunoenzimatico di chemiluminescenza in fase solida (Immulite autoanalyser, Diagnostic Product Corporation, New York, USA).
Caratteristiche cliniche e biochimiche del gruppo di pazienti e sottogruppi in base ai valori anormalmente elevati di GGT o ALP.
| Totale | Normale GGT e ALP | Alto GGT | Alta ALP | Simultaneamente alta GGT e ALP | P* | |
|---|---|---|---|---|---|---|
| N pazienti | 909 | 596 | 141 | 104 | 68 | |
| Età (anni) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 |
| Sesso, maschio/femmina | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 |
| Indice di comorbilità % | ||||||
| Nessuno | 31 | 37 | 21 | 29 | 9 | |
| Mitemoderato | 52 | 48 | 63 | 59 | 54 | |
| grave | 17 | 15 | 16 | 12 | 37 | |
| Fumatori attivi, % | 15 | 14 | 21 | 10 | 25 | 0.011 |
| Diabete mellito, % | 39 | 35 | 46 | 41 | 50 | 0.013 |
| Malattia epatica, % | 3 | 2 | 6 | 2 | 10 | |
| Malattia cardiaca ischemica, % | 16 | 14 | 10 | 16 | 38 | |
| Ischemia SNC o periferica, % | 21 | 19 | 18 | 23 | 34 | 0.031 |
| Insufficienza cardiaca, % | 18 | 16 | 21 | 14 | 37 | |
| BMI, kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5.9) | 0.176 |
| eGFR, mL/min/1.73 m2 | 14.7 (5.1) | 14.8 (5.1) | 14.6 (4.6) | 14.1 (4.4) | 15.6 (6.2) | 0.234 |
| Emoglobina (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 |
| Acido urico sierico, mg/dL | 7.6 (1.9) | 7.5 (1.9) | 7.9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | |
| Colesterolo totale, mg/dL | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 |
| Trigliceridi, mg/dL | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 |
| Albumina sierica, g/dl | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 |
| Calcio totale del siero, mg/dL | 9.1 (0.8) | 9.2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 |
| Fosforo sierico, mg/dL | 4.7 (1.1) | 4.7 (1) | 4.7 (0.9) | 4.6 (1.2) | 4.6 (1.2) | 0.851 |
| Bicarbonato sierico, mEq/L | 21.4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 |
| PTH, pg/mL | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | |
| ALT, IU/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | |
| GGT, IU/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | |
| ALP, IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | |
| Ferritina sierica, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | |
| Proteina C reattiva, mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | |
| Proteinuria, mg/g creatinina | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 |
| Inibitori della renina-angiotensina, % | 79 | 80 | 78 | 78 | 72 | 0.502 |
| Beta-bloccanti, % | 26 | 25 | 30 | 22 | 35 | 0.140 |
| Diuretici, % | 60 | 59 | 62 | 60 | 65 | 0.829 |
| Statine, % | 53 | 54 | 53 | 55 | 47 | 0.762 |
| Alopurinolo, % | 22 | 22 | 25 | 26 | 13 | 0.200 |
| Analoghi della vitamina D, % | 10 | 10 | 7 | 15 | 9 | 0.201 |
| Agenti antipiastrinici, % | 34 | 33 | 28 | 41 | 38 | 0.124 |
I dati sono presentati come media (deviazione standard), salvo diversa indicazione.
ANOVA o χ2 tra gruppi.
P0.05 GGT-ALP alta vs. GGT-ALP normale o ALP alta, test di Scheffé.
P0.05 GGT alta vs. GGT-ALP normale, test di Scheffé.
P0.0001 ALP alta vs. ALP normale. ciascuno degli altri sottogruppi, test di Scheffé.
P0.0001 GGT alta o GGT-ALP alta vs. GGT-ALP normale o ALP alta, test di Scheffé.
P0.0001 ALP alta o GGT-ALP alta vs. GGT-ALP normale o GGT alta, test di Scheffé.
P0.001 GGT alta o GGT-ALP alta contro GGT-ALP normale o ALP alta, test di Scheffé.
Dati disponibili su 845 pazienti.
La formula MDRD-4 è stata usata per stimare la velocità di filtrazione glomerulare (eGFR).12
La ferritina sierica era l’unico parametro con valori mancanti. La media dei valori disponibili è stata inclusa nell’analisi descrittiva, ma i valori mancanti non sono stati calcolati, e questa variabile non è stata inclusa come covariabile nell’analisi di sopravvivenza.
Variabile di outcome
La variabile di outcome era la morte per qualsiasi causa. Le cause di morte sono state classificate in 5 gruppi: morte improvvisa, cardiovascolare, infettiva, maligna e altre cause.
Analisi statistica
Sono stati utilizzati test parametrici o non parametrici per il confronto descrittivo delle variabili continue, a seconda delle loro caratteristiche; e, il test Chi-quadro è stato utilizzato per le variabili categoriche. Il test di Pearson è stato utilizzato per l’analisi di correlazione bivariata.
Le differenze di sopravvivenza tra i pazienti secondo i quartili di GGT o ALP sono state analizzate utilizzando le curve di Kaplan-Meier e confrontate utilizzando il test log-rank Mantel-Haenszel.
Sono stati utilizzati modelli di rischio proporzionale di Cox multivariati per analizzare l’effetto dei valori basali di GGT e ALP sul tempo di mortalità per tutte le cause.
Siccome i livelli basali di GGT e ALP presentavano una distribuzione a tendenza positiva, i valori sono stati trasformati logaritmicamente per essere inclusi come variabile continua.
Per tenere conto dei diversi periodi di reclutamento, i modelli multivariati sono stati anche aggiustati secondo una variabile categorica corrispondente ai periodi di reclutamento (2002-2005, 2006-2009, 2010-2014).
GGT e ALP sono stati analizzati come variabili continue (trasformazione logaritmica) e come variabili categoriche: quartile superiore e valori anormalmente elevati (GGT>36IU/L e ALP>120IU/L).
Sono stati inclusi i seguenti modelli di regressione: (1) Univariata. (2). Aggiustato per età, sesso, punteggio di comorbidità, diabete, malattia epatica, fumatore attivo, BMI, eGFR basale e periodo di reclutamento. (3) Aggiustato per le stesse variabili del modello 2, più calcio sierico totale, fosforo, PTH, albumina, proteina C reattiva, trigliceridi, acido urico e livelli di alanina aminotransferasi (ALT). (4) Modello più adatto utilizzando il processo di eliminazione condizionale a ritroso.
L’ipotesi di rischio proporzionale è stata testata usando le curve log-minus-log e i residui di Schöenfeld per ogni variabile. I pazienti sono stati censurati al momento della morte, perdita al follow-up, trapianto renale, o alla fine del follow-up (31 dicembre 2014), a seconda di quale si è verificato prima.
I dati descrittivi sono presentati come una media e deviazione standard, o una mediana e intervallo interquartile per le variabili continue, e valori assoluti e percentuali per le variabili categoriche. A p-value
RisultatiCaratteristiche dei pazienti
Il gruppo di studio comprendeva 909 pazienti con CKD stadio 4 o 5, pre-dialisi (eGFR medio 14,7±5,1mL/min/1,73m2). L’età media (±SD) era di 65±15 anni e il 53% dei pazienti era maschio. Tutti erano caucasici. Le caratteristiche cliniche e biochimiche di base sono riportate nella tabella 1.
Per analizzare le caratteristiche cliniche e biochimiche dei pazienti in base alla presenza di livelli anormalmente alti di GGT o ALP, i pazienti sono stati divisi in quattro sottogruppi (tabella 1): livelli normali di GGT e ALP (66% dei pazienti), GGT alta ma ALP normale (16%), GGT normale ma ALP alta (11%), e contemporaneamente GGT e ALP alte (7%).
Quindi, 209 (23%) e 172 (19%) pazienti avevano GGT e ALP anormalmente alte al basale, rispettivamente. Il valore del quartile superiore per GGT e ALP era 34IU/L e 112IU/L, rispettivamente.
Non c’erano differenze significative nell’età media e nella distribuzione del sesso tra i sottogruppi. Il punteggio di comorbidità e la percentuale di fumatori attivi era notevolmente più alta nei pazienti con GGT alta, specialmente nel gruppo con GGT e ALP alte contemporaneamente (Tabella 1).
Le malattie del fegato erano comorbidità rare in questo gruppo di pazienti. Tuttavia, a circa l’8% dei pazienti con alti livelli di GGT era stata diagnosticata una malattia epatica.
La prevalenza di malattie cardiovascolari nei pazienti con GGT o ALP alta era simile a quella dei pazienti con valori normali di GGT e ALP, tuttavia questa prevalenza di malattie cardiovascolari era significativamente aumentata nei pazienti con GGT e ALP alte contemporaneamente.
Sono state osservate differenze significative nei parametri biochimici tra i sottogruppi (Tabella 1). I pazienti con GGT alta avevano concentrazioni sieriche più elevate di acido urico, trigliceridi, ALT, ferritina e CRP rispetto ai pazienti con livelli normali di GGT e ALP o solo ALP alta. Il sottogruppo di pazienti con ALP alta da sola aveva livelli di PTH più alti. I valori medi di albumina al basale erano simili tra i sottogruppi.
Questi modelli biochimici associati a GGT o ALP sono stati confermati dall’analisi di correlazione bivariata (tabella 2).
Coefficienti di correlazione tra parametri biochimici.
| Log GGTa | Log ALPb | Haemoglobina | Acido urico | Trigliceridi | ALT | Fosforo | Calcio | Ferritina | Albumina | PTH | C-reattiva | eGFR | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | |||||||||||||||
| Log ALPb | 0.337** | ||||||||||||||
| Haemoglobina | -0.001 | 0.029 | |||||||||||||
| Acido urico | 0.162** | 0.051 | 0.068* | ||||||||||||
| Trigliceridi | 0.164** | 0.011 | 0.063 | 0.083* | |||||||||||
| ALT | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | ||||||||||
| Fosforo | -0,013 | 0,024 | -0.092* | 0.075* | 0.020 | 0.026 | |||||||||
| Calcio | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0.014 | -0.178** | ||||||||
| Ferritina | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0.043 | |||||||
| Albumina | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | ||||||
| PTH | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0.072* | |||||
| Proteina C reattiva | 0.197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0.077* | ||||
| eGFR | 0.080* | -0.028 | 0.163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0,054 | |||
| Proteinuria | 0,098* | 0,131** | -0,055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0.01.
Log-transformed gamma-glutamyl transferase.
Fosfatasi alcalina trasformata logicamente.
Mortalità e altri eventi di interesse
Un totale di 365 pazienti (40%) è morto durante il periodo di studio, con una sopravvivenza mediana per il gruppo di pazienti di 74 mesi (Tabella 3). Come previsto, le cause più comuni di morte sono state cardiovascolari e infezioni, senza differenze significative tra i sottogruppi (Tabella 3).
Mortalità e altre variabili di risultato di interesse nel gruppo complessivo e nei sottogruppi secondo GGT e fosfatasi alcalina (ALP).
| Totale | GGT e ALP normali | GGT alta | Alta ALP | Simultaneamente alta GGT e ALP | |
|---|---|---|---|---|---|
| Tempo mediano di sopravvivenza , mesi | 74 | 86 | 61 | 82 | 38 |
| Decessi, N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) |
| Cause di morte, N (%): | |||||
| Improvviso | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) |
| Cardiovascolare | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) |
| Infettivo | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) |
| Maligno | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) |
| Altri | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) |
| Dialisi, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) |
| Trapianto renale, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) |
| Perso al follow-up, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) |
Durante il periodo di follow-up, il 58% dei pazienti ha dovuto iniziare la dialisi e il 15% ha ricevuto un trapianto renale (non ci sono stati trapianti preventivi). Non sono state osservate differenze tra i sottogruppi nella percentuale di pazienti che hanno iniziato la dialisi, sono stati sottoposti a trapianto o hanno perso il follow-up (tabella 3).
Gamma-glutamil transferasi e fosfatasi alcalina come determinanti della sopravvivenza
Le figure 1 e 2 mostrano le curve di sopravvivenza Kaplan-Meier secondo i quartili della distribuzione di frequenza dei valori GGT e ALP, rispettivamente. I pazienti con alti livelli di GGT o ALP (quartili superiori) avevano una sopravvivenza più povera.
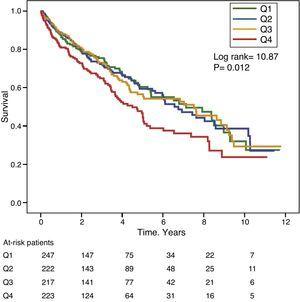
Curve di sopravvivenza Kaplan-Meier secondo i quartili della distribuzione di frequenza dei livelli sierici di GGT (Q, quartili).
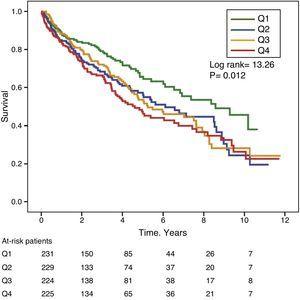
Curve di sopravvivenza Kaplan-Meier secondo i quartili di distribuzione di frequenza dei livelli sierici di ALP. (Q=quartili).
Utilizzando i modelli di regressione di Cox, la GGT come variabile continua o categorica (quartile superiore o valore sierico >36IU/L) era significativamente associata a una maggiore mortalità nei modelli analizzati (tabella 4). Anche l’ALP era significativamente e indipendentemente associata a un aumento della mortalità in tutti i modelli analizzati, tranne se l’ALP era inclusa nel modello best fit come variabile categorica definita come il valore del quartile superiore. In questo modello, il grado di associazione dell’ALP con la mortalità non ha raggiunto la significatività statistica (P=0,052) (Tabella 4).
Modelli di regressione Cox di associazione con la mortalità.
| Variabile | Univariata HR (95% CI) | Modello multivariato 1a HR (95% CI) | Modello multivariato 2b HR (95% CI) | Modello multivariato 3c HR (95% CI) |
|---|---|---|---|---|
| Log-trasformato GGT | 1.310 (1.154-1.489) P0.0001 |
1.260 (1.095-1.449) P0.0001 |
1.174 (1.005-1.371) P=0.042 |
1.166 (1.010-1.347) P=0.036 |
| GGT quartile superiore | 1.459 (1.163-1.829) P=0.001 |
1.415 (1.119-1.788) P=0.004 |
1.329 (1.036-1.705) P=0.025 |
1.315 (1.064-1.714) P=0.013 |
| GGT>36IU/L | 1.513 (1.202-1.905) P0.0001 |
1.509 (1.185-1.923) P=0.001 |
1.393 (1.078-1.800) P=0.011 |
1.390 (1.089-1.779) P=0.009 |
| Log-transformed ALP | 1.635 (1.278-2.093) P0.0001 |
1.479 (1.149-1.904) P=0.002 |
1.395 (1.061-1.833) P=0.017 |
1.327 (1.008-1.746) P=0.044 |
| ALP quartile superiore | 1.332 (1.062-1.670) P=0.013 |
1.288 (1,023-1,621) P=0,031 |
1,277 (1,001-1,630) P=0,049 |
1,261 (0,998-1,594) P=0,052 |
| ALP>120IU/L | 1.527 (1.197-1.947) P=0.001 |
1.419 (1.109-1.815) P=0.005 |
1.362 (1.048-1.770) P=0.021 |
1.305 (1.015-1.678) P=0.038 |
Adeguato per età, sesso, indice di comorbidità, diabete, fumo, malattie epatiche, BMI, eGFR e periodi di studio.
Regolato per tutte le covariabili del modello 1 più calcio, fosforo, PTH, acido urico, trigliceridi, ALT, albumina e proteina C reattiva.
Modello più adatto che include tutte le variabili dei modelli 1 e 2 più GGT o ALP, con processo di selezione automatica delle variabili.
L’hazard ratio (HR) per la mortalità nei pazienti con alti livelli di GGT (>36IU/L) (HR=1,39) era simile a quello osservato nei pazienti con ALP alta (>120IU/L) (HR=1,31) nel modello completamente aggiustato (Tabella 4). La Fig. 3 mostra le curve di sopravvivenza Kaplan-Meier che illustrano questa associazione e l’effetto additivo sulla sopravvivenza ridotta di GGT e ALP elevate contemporaneamente.
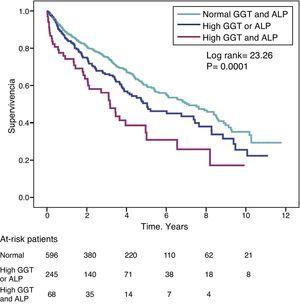
Curve di sopravvivenza Kaplan-Meier nei pazienti dello studio secondo i livelli normali di GGT e ALP, GGT o ALP anormalmente alti (uno o l’altro), e contemporaneamente GGT e ALP alti.
Per valutare il possibile effetto confondente della comorbidità epatica sull’associazione tra GGT e ALP con la mortalità, è stato costruito un modello di regressione di Cox, escludendo 27 pazienti con diagnosi precedente di malattia epatica. In questo modello adattato, la GGT alta (>36IU/L) ha mantenuto un’associazione statisticamente significativa con la mortalità (HR=1,316; 95% CI: 1,016-1,705; P=0,03), mentre l’ALP elevata (>120IU/L) ha mostrato un’associazione al limite della significatività statistica (HR=1,296; 95% CI: 0,999-1,680; P=0,05).
Discussione
I risultati del presente studio mostrano che GGT o ALP elevate nel siero sono indipendentemente associate a una maggiore mortalità nei pazienti con CKD. Questo studio rivela anche per la prima volta che l’elevazione simultanea di entrambi i parametri ha un effetto additivo sulla previsione di mortalità, anche in pazienti senza malattia epatica.
In questo studio, i pazienti con CKD e alti livelli di GGT avevano una maggiore comorbidità, in particolare diabete e insufficienza cardiaca, e un profilo biochimico simile a quello osservato nella sindrome metabolica, anche se il BMI in questo sottogruppo non era diverso da quello del resto dei pazienti dello studio.
Data la natura onnipresente di ALP nel corpo, alti livelli sierici di questo enzima possono essere espressione di diversi processi patologici. In questo senso, la determinazione di specifici isoenzimi ALP può essere utile per distinguere la loro origine nei casi in cui gli aumenti isolati non possono essere attribuiti a un aumento del rimodellamento osseo.
L’eccesso di mortalità riportato nei pazienti con CKD e alti livelli di ALP è stato attribuito in modo controverso a potenziali effetti avversi cardiovascolari come risultato della mancanza di controllo molto grave sul metabolismo osseo-minerale.2,3,13,14 Sono stati proposti diversi meccanismi patogenetici per spiegare questa associazione, tra cui l’aumento della calcificazione vascolare attraverso l’idrolisi del pirofosfato nella parete arteriosa,15 l’infiammazione sistemica16,17 e la carenza di vitamina D.18 Tuttavia, l’assenza di un’associazione significativa tra i livelli sierici dell’isoenzima osseo dell’ALP (ALP osso-specifica) e la mortalità nei pazienti con CKD19 solleva seri dubbi sull’ipotesi di un legame patogenetico con il metabolismo osseo-minerale.
In questo studio, l’11% dei pazienti aveva livelli elevati di ALP con livelli normali di GGT, e la caratteristica principale di questo sottogruppo era l’alto livello medio di PTH, suggerendo che l’osso potrebbe essere l’origine di questo aumento di ALP. Tuttavia, ALP e GGT elevate hanno caratterizzato contemporaneamente un sottogruppo di pazienti con un maggior grado di comorbidità, soprattutto malattie cardiovascolari, e un profilo biochimico che era più simile a quello dei pazienti con GGT elevata da sola che a quello dei pazienti con ALP elevata da sola. Così, due profili di rischio possono essere distinti nei pazienti con CKD e ALP alta secondo la presenza o l’assenza di alti livelli di GGT. Mentre l’ALP alta da sola era associata a un rischio moderato di mortalità, l’elevazione simultanea di entrambi gli enzimi era associata a un rischio più elevato di mortalità.
GGT è l’enzima responsabile dell’idrolisi del glutatione ridotto extracellulare (GSH), uno dei principali antiossidanti intracellulari nei mammiferi, permettendo agli aminoacidi precursori di essere successivamente utilizzati per la sintesi di nuovo GSH intracellulare.6 Pertanto, l’aumento della GGT è espressione della deplezione intracellulare di GSH e, pertanto, la GGT potrebbe essere considerata un marcatore di stress ossidativo.6
La GGT nel siero ha dimostrato di essere un biomarcatore cardiometabolico nella popolazione generale. Vari studi hanno trovato un’associazione significativa e indipendente tra i livelli di GGT e la mortalità cardiovascolare e per tutte le cause.20-22 È stato dimostrato che alti livelli di GGT sono associati a una prognosi peggiore nella malattia coronarica e nell’insufficienza cardiaca.23,24 È stata anche osservata una possibile implicazione patogenetica della GGT nella formazione della placca aterosclerotica, nella sua erosione e nella successiva rottura,25 che potrebbe contribuire a spiegare la sua relazione con la morbilità e la mortalità cardiovascolare da un punto di vista biologico.
Il valore predittivo della GGT nei pazienti con CKD è stato scarsamente studiato. Postorino et al.9 hanno osservato una forte associazione indipendente tra alti livelli di GGT e mortalità totale e cardiovascolare in 584 pazienti CKD in dialisi. Tuttavia, le concentrazioni sieriche di ALP non sono state determinate in questo studio.
In un altro studio, alti livelli di GGT sono stati associati a una marcata disfunzione endoteliale in pazienti con CKD, il che suggerisce un legame tra livelli elevati di questo marcatore e il rischio di malattie cardiovascolari.10
Oltre al possibile effetto pro-ossidativo sistemico, altre ipotesi potrebbero contribuire a spiegare l’associazione tra elevati livelli di GGT e mortalità in pazienti con CKD. Così, la GGT elevata potrebbe semplicemente indicare abuso di alcol o malattie del fegato, comorbidità che giustificherebbero l’eccessiva mortalità. Tuttavia, in questo studio, la GGT ha mantenuto un’associazione significativa con la mortalità dopo aver escluso i pazienti con alcolismo cronico, malattie epatiche croniche o infezioni da virus epatotropi, escludendo così il ruolo esclusivo delle malattie epatiche in questa associazione.
Tuttavia, la malattia del fegato grasso e la malattia epatica congestizia sono due disturbi epatici sub-clinici che possono causare alti livelli di GGT.26,27 La malattia del fegato grasso è un reperto relativamente comune nei pazienti con CKD, ed è più strettamente correlata ai fattori di rischio cardiovascolare che allo sviluppo di complicazioni epatiche.27 Le caratteristiche cliniche e biochimiche associate alla malattia del fegato grasso sono simili a quelle osservate nel sottogruppo di pazienti del nostro studio con GGT elevata. Tuttavia, in questo studio, la diagnosi di malattia del fegato grasso non è stata adeguatamente studiata nella maggior parte dei pazienti e quindi non si può garantire che la GGT elevata fosse dovuta principalmente a questa malattia.
La malattia epatica congestizia si riferisce a uno spettro di anomalie epatiche attribuite alla congestione passiva secondaria all’insufficienza cardiaca del lato destro o a qualsiasi causa che aumenti la pressione venosa centrale, compresi il sovraccarico di volume, una grave ipertensione polmonare o valvulopatie.28 GGT o ALP elevate nel siero sono anomalie biochimiche caratteristiche nei pazienti con CKD con disfunzione diastolica ventricolare sinistra, specialmente se sono associate a congestione polmonare,29 che è anche un fattore di rischio riconosciuto per la mortalità in questi pazienti.30
GGGT elevate possono anche riflettere l’induzione degli enzimi microsomiali.31 Oltre all’assunzione di alcol, molti farmaci possono indurre gli enzimi epatici. In questo studio, nessuno dei farmaci più comunemente prescritti nei pazienti con CKD era significativamente associato ad alti livelli di GGT o ALP, anche se il potenziale effetto dei farmaci da banco (in particolare analgesici) su alti livelli di GGT nei nostri pazienti non può essere escluso.
Questo studio ha una serie di limiti. Dato il suo disegno retrospettivo, non è stato possibile stabilire relazioni causali. Lo studio è stato condotto in un unico sito e la coorte studiata, sebbene rappresentativa della popolazione locale, era etnicamente omogenea (caucasica). GGT e ALP non sono stati analizzati come covariate variabili nel tempo e, pertanto, è probabile che il significato prognostico degli aumenti transitori di GGT sia diverso dagli aumenti mantenuti nel tempo. Tuttavia, in questo studio, il rilevamento di GGT elevato nell’analisi trasversale in una certa fase della CKD era associato a un fenotipo clinico di grande interesse per la sua relazione con la comorbidità cardiovascolare e la mortalità. Infine, l’ALP osseo-specifica e altri parametri legati più specificamente al rimodellamento osseo non sono stati misurati.
In conclusione, un livello anormalmente elevato di GGT è un reperto comune nei pazienti con CKD, che si osserva più comunemente nei pazienti con maggiore comorbidità, in particolare malattie cardiovascolari, ed è indipendentemente associato alla mortalità. GGT e ALP sieriche simultaneamente elevate aumentano il rischio di mortalità. Pertanto, la misurazione combinata di GGT sierica con ALP potrebbe offrire ulteriori informazioni predittive nei pazienti con CKD.
Conflitti di interesse
Gli autori dichiarano che non ci sono conflitti di interesse.