Meccanismi che spiegano la regioselettività
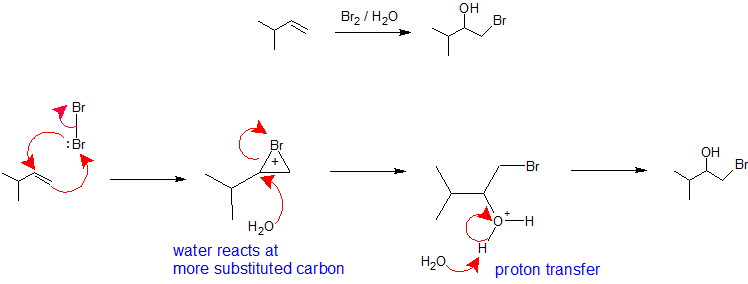
X2/H2O o X2/ROH: La regioselettività della formazione di aloidrine da una reazione di un alchene con un alogeno in un solvente nucleofilo è analoga alla via di ossimercurazione-demercurazione. La molecola alogena assume il ruolo di elettrofilo accettando elettroni pi nucleofili dall’alchene mentre simultaneamente forma un legame con l’altro carbonio vinilico per creare uno ione bromonio (o cloroio). La formazione dello ione bromonio (o cloronio) stabilizza la carica positiva e impedisce il riarrangiamento dei carbocationi. Il solvente assume il ruolo di nucleofilo perché è presente in una percentuale molto maggiore rispetto al gruppo lasciante e reagisce con il carbonio più sostituito dello ione bromonio (o cloronio) ciclico per creare la regiochimica. La stereochimica di questa reazione è anti-addizione perché il solvente si avvicina allo ione bromonio con orientamento posteriore per produrre il prodotto di addizione. Tuttavia, poiché l’interazione dell’alogeno con l’alchene può avvenire dall’alto o dal basso, non c’è controllo stereochimico in questa reazione e una miscela di enantiomeri sarà prodotta quando applicabile. Il passo finale di questo meccanismo è un trasferimento di protoni a una molecola di acqua del solvente per neutralizzare il prodotto di addizione.
HOX o RSCl: La regioselettività delle reazioni degli acidi ipoalosi e del cloruro di solfenile può essere spiegata dallo stesso meccanismo che abbiamo usato per razionalizzare la regola di Markovnikov. Il legame di una specie elettrofila al doppio legame di un alchene si forma preferenzialmente per produrre il carbocatione più stabile (più altamente sostituito). Questo intermedio dovrebbe poi combinarsi rapidamente con una specie nucleofila per produrre il prodotto di addizione.
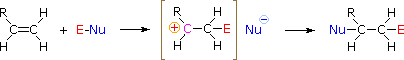
Per applicare questo meccanismo dobbiamo determinare la parte elettrofila in ciascuno dei reagenti. Usando le differenze di elettronegatività, possiamo dividere i reagenti di addizione comuni in moiety elettrofile e nucleofile, come mostrato sulla destra. Nel caso degli acidi ipocloroso e ipobromoso (HOX), questi acidi Brønsted deboli (pKa circa 8) non reagiscono come donatori di protoni; e poiché l’ossigeno è più elettronegativo del cloro o del bromo, l’elettrofilo sarà un catione alogenuro. La specie nucleofila che si lega al carbocatione intermedio è quindi lo ione idrossido, o più probabilmente l’acqua (il solvente usuale per questi reagenti), e i prodotti sono chiamati aloidrine. I cloruri sulfenilici si aggiungono nel modo opposto perché l’elettrofilo è un catione di zolfo, RS(+), mentre la parte nucleofila è l’anione cloruro (il cloro è più elettronegativo dello zolfo).
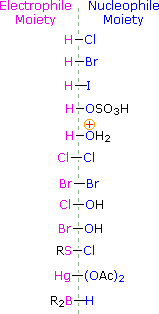
Sotto ci sono alcuni esempi che illustrano l’aggiunta di vari reagenti alogeni elettrofili a gruppi alchenici. Notate la specifica regiochimica dei prodotti, come spiegato sopra.
Esercizio
1. Prevedi il prodotto della seguente reazione:

2. Quando il butene è trattato con NBS in presenza di acqua, il prodotto mostra che il bromo è sul carbonio meno sostituito, questo è Markovnikov o anti-Markovnikov?
Risposta

2. Poiché il bromo è la prima aggiunta all’alchene, questa aggiunta sarebbe un’aggiunta anti-Markovnikov.
Collaboratori
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professore emerito (Michigan State U.), Virtual Textbook of Organic Chemistry