Stereochimica dei triacilgliceridi/fosfolipidi
Il glicerolo è una molecola achirale, poiché C2 ha due sostituenti uguali, -CH2OH. Il glicerolo nel corpo può essere chimicamente convertito in triacilgliceridi e fosfolipidi (PL) che sono chirali, e che esistono in una forma enantiomerica. Come può essere possibile se i due gruppi CH2OH sul glicerolo sono identici? Si scopre che anche se questi gruppi sono stereochimicamente equivalenti, possiamo differenziarli come segue. Orientare il glicerolo con l’OH su C2 che punta a sinistra. Poi sostituite l’OH di C1 con OD, dove D è il deuterio. Ora i due sostituenti alcolici su C1 e C3 non sono identici e la molecola risultante è chirale. Ruotando la molecola in modo che l’H su C2 punti verso la parte posteriore, e assegnando le priorità agli altri sostituenti su C2 come segue: OH =1, DOCH2 =2, e CH2OH = 3, si può vedere che la molecola risultante è nella configurazione S. Quindi diciamo che C1 è il carbonio proS. Allo stesso modo, se sostituiamo l’OH su C3 con OD, formiamo l’enantiomero R. Quindi C3 è il carbonio proR. Questo dimostra che in realtà possiamo distinguere tra i due sostituenti CH2OH identici. Diciamo che il glicerolo non è chirale, ma prochirale. (Pensate a questo come il glicerolo ha il potenziale per diventare chirale modificando uno dei due sostituenti identici.)
Figura: Glicerolo – Una molecola prochirale
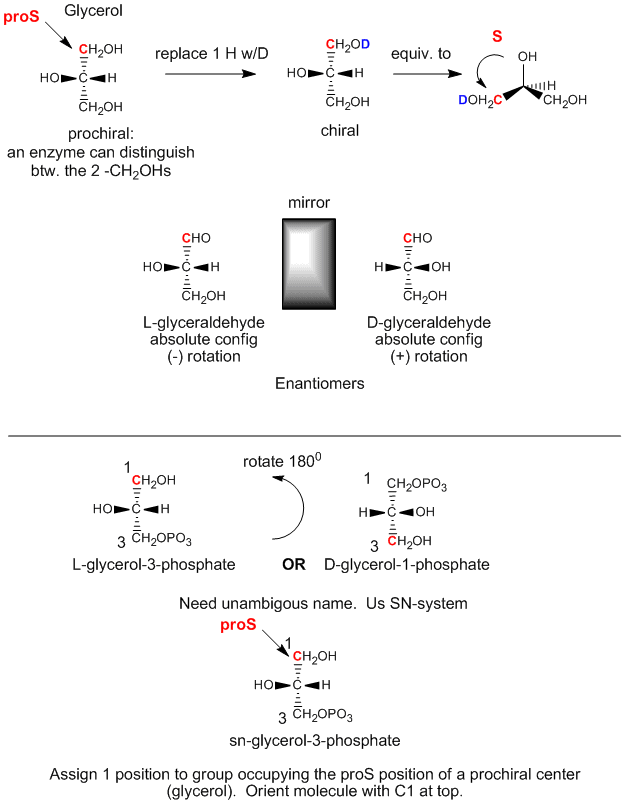
Possiamo mettere in relazione la configurazione del glicerolo qui sopra, (quando l’OH su C2 punta a sinistra) con la configurazione assoluta della L-gliceraldeide, uno zucchero semplice (una poliidrossialdeide o chetone), un altro derivato 3C del glicerolo. Questa molecola è chirale con l’OH su C2 (l’unico carbonio chirale) che punta a sinistra. È facile ricordare che qualsiasi zucchero L ha l’OH sull’ultimo carbonio chirale che punta a sinistra. L’enantiomero (isomero speculare) della L-gliceraldeide è la D-gliceraldeide, in cui l’OH su C2 punta a destra. I biochimici usano L e D per la stereochimica dei lipidi, degli zuccheri e degli aminoacidi, invece della nomenclatura R,S che si usa in chimica organica. La designazione stereochimica di tutti gli zuccheri, aminoacidi e glicerolipidi può essere determinata dalla configurazione assoluta di L e D-gliceraldeide.
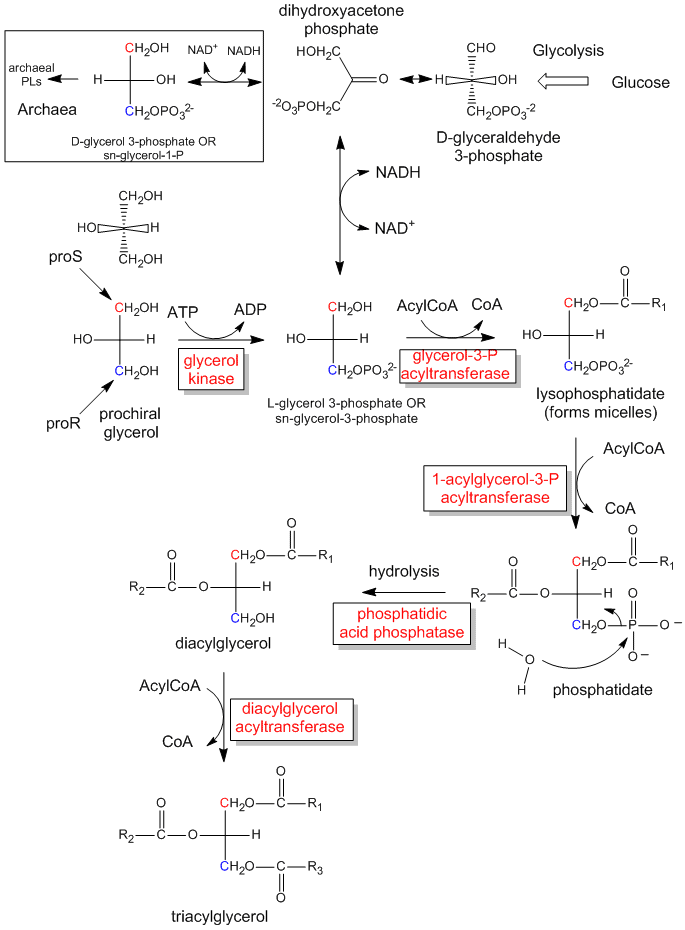
Il primo passo nella sintesi in vivo (nel corpo) dei derivati chirali dal glicerolo achirale comporta la fosforilazione dell’OH sul C3 da parte dell’ATP (una fosfoanidride simile nella struttura all’anidride acetica, un eccellente agente acetilante) per produrre la molecola chirale glicerolo fosfato. Basandoci sulla configurazione assoluta della L-gliceraldeide, e usando questa per disegnare il glicerolo (con l’OH su C2 che punta a sinistra), possiamo vedere che la molecola fosforilata può essere chiamata L-glicerolo-3-fosfato. Tuttavia, ruotando questa molecola di 180 gradi, senza cambiare la stereochimica della molecola, non cambiamo affatto la molecola, ma usando la nomenclatura D/L di cui sopra, chiameremmo la molecola ruotata come D-glicerolo-1-fosfato. Non possiamo dare alla stessa molecola due nomi diversi. Quindi i biochimici hanno sviluppato il sistema di numerazione stereospecifico (sn), che assegna la posizione 1 di una molecola prochirale al gruppo che occupa la posizione proS. Usando questa nomenclatura, possiamo vedere che la molecola chirale descritta sopra, il glicerolo-fosfato, può essere nominata senza ambiguità come sn-glicerolo-3-fosfato. Il sostituente idrossile sul carbonio proR è stato fosforilato.
Figura: La sintesi biologica dei triacilgliceridi e dell’acido fosfatidico dal glicerolo prochirale
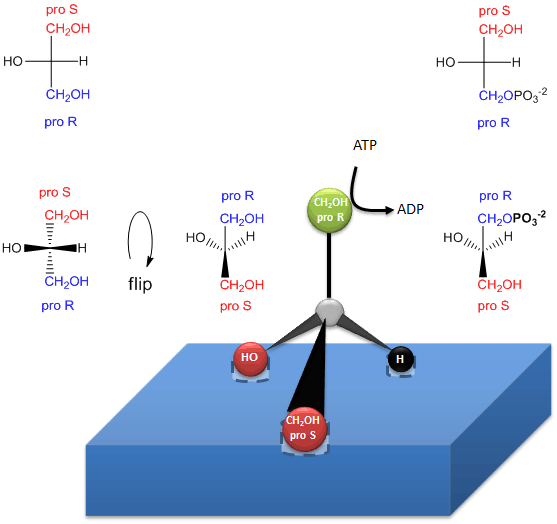
La fosforilazione enzimatica del glicerolo prochirale sull’OH del carbonio proR per formare sn-glicerolo-3-fosfato è illustrata nel link sottostante. Come siamo stati in grado di differenziare i 2 sostituti CH2OH identici come contenenti i carboni proS o proR, così può fare l’enzima. L’enzima può differenziare sostituenti identici su una molecola prochirale se la molecola prochirale interagisce con l’enzima in tre punti. Un altro esempio di un sistema reagenti/enzima prochirale coinvolge l’ossidazione della molecola prochirale di etanolo da parte dell’enzima alcol deidrogenasi, in cui solo l’H proR delle 2 H su C2 viene rimosso. (Ne parleremo più avanti.)
Figura: Come un enzima (glicerolo chinasi) trasferisce un PO4 da ATP al proR CH2OH del glicerolo sulla formazione di triacilgliceroli chirali e acido fosfatidico.