XeF4 eli Xenon Tetrafluoride on kemiallinen yhdiste, joka muodostuu ksenon- ja fluoriatomeista. Se on maailman ensimmäinen löydetty binääriyhdiste. Se on jalokaasutyyppi, jonka kemiallinen yhtälö on
Xe +2 F2 -> XeF4
XeF4 on ulkonäöltään kiinteää valkoista ja sen tiheys on kiinteässä muodossa 4,040 g cm-3. Tavallisissa olosuhteissa se näyttää värittömältä kiteeltä. Sen alilämpötila on 115,7 celsiusastetta eli 240,26 Fahrenheit-astetta. Kuten muillakin ksenonfluorideilla, myös ksenontetrafluoridilla on eksergoninen muodostuminen. Normaalissa lämpötilassa ja paineessa se pysyy vakaassa tilassa. Se reagoi veden kanssa välittömästi ja vapauttaa molekulaarista happea, fluorivetyä ja puhdasta ksenonkaasua.
| Molekyylin nimi | Xenon-tetrafluoridi (XeF4) |
| Valenssiluku Elektronien määrä molekyylissä | 36 |
| Hybridisaatio XeF4 | sp3d2 hybridisaatio |
| Sidekulmat | 90 astetta ja 180 astetta |
| XeF4:n molekyyligeometria | Neliötasomainen |
Tietääksemme lisää sen fysikaalisista ominaisuuksista ja kemiallisista ominaisuuksista, on tunnettava sen Lewisin rakenne ja molekyyligeometria. Selvitetään ksenontetrafluoridin Lewis-rakenne.
Lewis-rakenteen tekemistä varten meidän on tunnettava XeF4:n valenssielektronit, jotta voimme tehdä sen rakenteen ja tietää atomien sijoittumisen molekyylissä.
Sisältö
XeF4 Valenssielektronit
Tässä molekyylissä on yksi ksenonatomi ja neljä fluoriatomia. Laskemme näiden molempien atomien valenssielektronit määrittääksemme XeF4:n valenssielektronien kokonaismäärän.
Ksenonin valenssielektronit = 8
Fluorin valenssielektronit = 7*4 ( koska fluoriatomeja on neljä, kerromme sen 4:llä)
Xef4:n valenssielektronien kokonaismäärä: 8 + 7*4
: 8 + 28
: 36
XeF4:ssä on siis yhteensä 36 valenssielektronia.
XeF4 Lewis-rakenne
Nyt kun tiedämme ksenontetrafluoridin valenssielektronit, sinun on helpompi piirtää sen Lewis-rakenne. Tämä Lewisin pisterakenne on kuvallinen esitys molekyylin yksittäisten atomien ympärillä olevista valenssielektroneista yhdessä sen muodostaman sidoksen kanssa.
Rakenteessa olevat sidokset on esitetty viivoilla, kun taas sidoksen muodostamiseen osallistumattomat elektronit on esitetty pisteinä. Elektroneita, jotka eivät muodosta mitään sidosta, kutsutaan sitoutumattomiksi elektroneiksi tai yksinäisiksi elektronipareiksi.
Tässä tapauksessa, koska ksenon on vähiten elektronegatiivinen atomi, sijoitamme sen keskelle ja kaikki muut fluoriatomit sen ympärille näin:

Nyt kun olemme sijoittaneet kaikki atomit, näytetään kunkin fluori- ja ksenonatomin väliset sidokset. Jokainen sidos molekyylissä vie kaksi elektronia, ja koska tässä molekyylissä on neljä yksittäistä sidosta, 8 elektronia 36:sta on käytetty.
Aloitetaan loput valenssielektronien sijoittaminen atomien ympärille. Jokaisen fluoriatomin ympärillä on kuusi valenssielektronia, koska yksi elektroni käytettiin sidoksen muodostamiseen.
Voit huomata, että olemme jo sijoittaneet 24 elektronia 28:sta fluoriatomien ympärille. Loput sitoutumattomat elektronit tai yksinäiset elektroniparit sijoitetaan ksenonille, koska se on poikkeus oktettisäännöstä.
Sijoitetaan nämä kaksi ei-sitoutuvaa elektroniparia ksenonille, ja nyt meillä on Lewisin rakenne, jossa ksenonilla on kaksi yksinäistä elektroniparia ja kullakin fluoriatomilla kuusi ei-sitoutuvaa elektronia.
XeF4:n hybridisaatio
Keskeisen Xenon-atomin orbitaalit hybridisoituvat, jolloin syntyy uusia hybridisoituneita orbitaaleja. Ksenonilla on kuusi elektronia 5p-orbitaaleissa ja kaksi elektronia 5s-orbitaaleissa. Ksenonin perustilassa d-orbitaaleissa ja f-orbitaaleissa ei ole elektroneja. Mutta kun tämä atomi on kiihdytetyssä tilassa, kaksi p-orbitaaleissa olevaa elektronia siirtyy d-orbitaaleihin, jolloin parittomia elektroneja on yhteensä neljä. Niistä kaksi on p-orbitaaleissa ja kaksi muuta parittamatonta elektronia d-orbitaaleissa. Nämä hybridisoituneet orbitaalit johtavat sp3d2-hybridisaatioon XeF4:ssä.
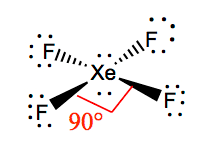
XeF4:n molekyyligeometria
Jonkin molekyylin molekyyligeometriaa on helpompi ymmärtää, kun tiedämme sen Lewisin rakenteen. Koska ksenonilla on kaksi yksinäistä elektroniparia, se ottaa sellaisen rakenteen, joka auttaa näitä yksinäisiä pareja välttämään hylkimisvoimia. Jotta nämä repulsiovoimat pysyisivät mahdollisimman vähäisinä, yksinäiset parit ovat kohtisuorassa tasossa. Koska molekyylissä on neljä fluoriatomia, molekyyli on järjestetty siten, että sen molekyyligeometria on neliönmuotoinen. XeF4:n elektronigeometria on oktaedrinen, joten ksenonitetrafluoridin molekyyligeometria on neliönmuotoinen.

XeF4 Sidekulmat
F-Xe-F:n sidekulmat ovat 90 astetta, ja yksinäisten parien kulmat ovat 180 astetta. Fluoriatomit sijaitsevat 90 asteen kulmassa toisiinsa nähden, mikä johtaa elektronien symmetriseen jakautumiseen molekyylin tasossa. Nämä sidoskulmat edistävät neliönmuotoisen molekyyligeometrian muodostumista.
XeF4:n poolisuus – Onko XeF4 poolinen vai pooliton?
Vaikka ksenon- ja fluoriatomien väliset sidokset ovat poolisia, XeF4 on pooliton molekyyli. Mietitkö miten? Kaikki Xe-F-sidokset ovat vastakkain keskenään, jolloin dipolimomentin summa on nolla. Koska ksenonatomilla on neljä elektronia, jotka ovat paikallistuneet sitoutumattomiksi elektronipareiksi. Koska molekyylin atomien ja elektronien kokonaisjärjestely on sellainen, että dipolien vektorisumma on nolla, XeF4 on pooliton molekyyli.
Loppuhuomautukset
Xenontetrafluoridi on yksi niistä molekyyleistä, joita on suhteellisen helppo ymmärtää. Sen Lewis-rakenne on yksi vähiten monimutkaisista rakenteista, koska kaikki fluoriatomit on sijoitettu symmetriseen kuvioon. Molekyylin yksinäiset parit sijaitsevat kohtisuorassa tasossa oktaedrin muodossa, jotta niiden hylkimisvoimat olisivat mahdollisimman pienet.
Tämän blogikirjoituksen yhteenvetona voidaan sanoa, että XeF4:llä on 36 valenssielektronia. Sillä on kaksi yksinäistä paria ei-sitovia elektroneja ksenonin keskeisellä atomilla. Molekyylillä on oktaedrinen elektronigeometria ja neliötasomainen molekyyligeometria. XeF4 on pooliton molekyyli ja sillä on sp3d2-hybridisaatio.