Esittely
Krooninen munuaissairaus (CKD) liittyy korkeaan kuolleisuuteen, erityisesti sydän- ja verisuonitauteihin liittyvään. Kuolleisuuden ja perinteisten sydän- ja verisuonitautien riskitekijöiden välinen vähäinen yhteys näillä potilailla on kuitenkin paradoksaalista. Ainoastaan joidenkin tulehdukseen tai ravitsemukseen liittyvien merkkiaineiden (esim. C-reaktiivinen proteiini ja seerumin albumiini) on osoitettu olevan johdonmukaisia kuolleisuuden ennustajia CKD:n yhteydessä1 .
Viime vuosina joissakin havainnointitutkimuksissa on osoitettu yhteys kohonneiden seerumin alkalisen fosfataasin (ALP) kokonaispitoisuuksien ja kuolleisuuden välillä CKD-potilailla2-5; tämän havainnon biologinen ja kliininen merkitys on kuitenkin edelleen tuntematon.
Gamma-glutamyylitransferaasi (GGT) on entsyymi, jota esiintyy seerumissa ja solujen ulommalla pinnalla eri elimissä, kuten maksassa, haimassa, suolistossa, keuhkoissa ja munuaisissa.6 Seerumin GGT ei ole ainoastaan perinteinen alkoholinkäytön ja hepatobilitaaristen sairauksien merkkiaine, vaan useissa tutkimuksissa on myös osoitettu yhteys seerumin kohonneiden GGT-pitoisuuksien ja sydän- ja verisuonitautien, diabetes mellituksen, verenpainetaudin ja metabolisen oireyhtymän välillä.7.
GGT-tasot ovat kuolleisuuden ennustaja väestössä; itse asiassa tämä entsyymi on hiljattain sisällytetty yhdeksi niistä biokemiallisista parametreista, jotka ennustavat kuolleisuutta.8 Lisäksi seerumin GGT-tasot voivat auttaa tulkitsemaan epäselvästä alkuperästä johtuvia korkeita ALP-arvoja.
Seerumin GGT-tasojen kliinistä ja ennusteteknistä merkitystä maksan ja maksan vajaatoiminnan taudissa (CKD:n yhteydessä) on analysoitu vain muutamissa tutkimuksissa.9,10 Tämän tutkimuksen tavoitteena oli tutkia niiden CKD-potilaiden kliinisiä ominaisuuksia, joilla on epänormaalisti kohonneet seerumin GGT-arvot, ja niiden vuorovaikutusta ALP:n kanssa sekä määrittää tämän parametrin arvo kuolleisuuden ennustajana.
Materiaalit ja menetelmät
Tämä on retrospektiivinen, havainnointitutkimus, joka tehtiin kohortille aikuispotilaita, joita seurattiin Hospital Infanta Cristina -sairaalan nefrologian osaston (Hospital Infanta Cristina, Badajoz, Espanja) matalan puhdistuman (pitkälle edennyt CKD) poliklinikalla tammikuusta 2002 lokakuuhun 2013. Tutkimukseen osallistuivat kaikki >18-vuotiaat pre-dialyysipotilaat, joiden arvioitu glomerulussuodatusnopeus (eGFR) oli
ml/min/1,73m2. Tutkimukseen ei otettu mukaan potilaita, joilla oli munuaisensiirron toimintahäiriöstä johtuva CKD.
Demografiset tiedot ja kliiniset parametrit, kuten ikä, sukupuoli, painoindeksi (BMI), liitännäissairaudet ja lääkitys, kirjattiin tutkimukseen mukaan otettaessa.
Komorbiditeetti arvioitiin Daviesin pistemäärän11 avulla, ja potilaat luokiteltiin erilaisten liitännäissairauksiensa yhteismäärän mukaan: ei liitännäissairauksia, lieväasteinen-kevytasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinenasteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen asteinen aste. Tärkeimmät kirjatut liitännäissairaudet olivat: diabetes mellitus, sydämen vajaatoiminta, sepelvaltimotauti, aivoverisuonitauti tai ääreisverisuonitauti, krooninen obstruktiivinen keuhkosairaus, syöpä ja krooniset tulehdusprosessit.
Tässä tutkimuksessa termi ”maksasairaus” ei sisältänyt ainoastaan potilaita, joilla oli diagnosoitu krooninen maksasairaus, maksakirroosi tai maksansiirto, vaan myös potilaita, joilla esiintyi aktiivista alkoholismia tai jotka kärsivät aktiivisesta (B- tai C-) hepatotrooppisesta virustartunnasta. Ei-alkoholipitoinen steatohepatiitti (rasvamaksasairaus) oli yleinen ultraäänilöydös näillä potilailla, vaikka tätä sairautta ei sisällytetty maksasairauksien luetteloon.
Potilaita seurattiin säännöllisesti siitä lähtien, kun heidät otettiin mukaan tutkimukseen, kunnes he kuolivat, heille tehtiin munuaisensiirto, he menettivät seurantakohteensa tai tiedonkeruuajanjakso päättyi (31.12.2014).
Tutkimuksen retrospektiivisen rakenteen vuoksi yksilöllistä tietoon perustuvaa suostumusta ei saatu.
Biokemialliset mittaukset
Tammikuusta 2002 alkaen seerumin GGT- ja kokonais-ALP-arvot lisättiin pitkälle edenneen CKD:n klinikkamme potilaiden rutiininomaisiin biokemiallisten parametrien mittauksiin.
GGT-pitoisuudet määritettiin autoanalysaattorilla (Advia Chemistry, Siemens Healthcare Diagnostics, New York, USA) kineettisellä kolorimetrisellä menetelmällä, jossa käytettiin gammaglutamyyli-3-karboksi-4-nitroanilidia ja glykyyliglysiiniä. Variaatiokerroin on alle 4,5 % ja viitealue 0-36U/L.
Serumin ALP-pitoisuudet mitattiin myös autoanalysaattorilla (Advia Chemistry) ALPI-menetelmällä, jolla kvantifioidaan alkaliinifosfataasiaktiivisuutta mittaamalla p-nitrofenyylifosfaatin transfosforylaatio p-nitrofenoliksi 2-amino-2-metyyli-1-propanolin läsnä ollessa. Variaatiokerroin oli alle 4 %, ja viitealue oli 45-120U/L.
Tutkimukseen otettiin mukaan myös hematologiset ja biokemialliset perusparametrit (ks. taulukko 1) niiden potilaiden luonnehtimiseksi, joiden seerumin GGT- tai ALP-arvo oli poikkeuksellisen koholla. Biokemialliset parametrit määritettiin tavanomaisilla laboratoriomenetelmillä (Advia Chemistry, New York, USA). Lisäkilpirauhashormonin (molekyyli 7-84) (PTH) pitoisuudet määritettiin automaattisella kemiluminesenssi-immunomäärityksellä (DiaSorin, Italia), seerumin albumiinipitoisuudet bromokresolivihreämenetelmällä ja korkean herkkyyden C-reaktiivisen proteiinin pitoisuudet kiinteän faasin kemiluminesenssi-entsyymi-immunomäärityksellä (Immulite-autoanalysaattorilla, Diagnostic Product Corporation, New York, USA).
Potilasjoukon kliiniset ja biokemialliset ominaisuudet ja alaryhmät poikkeavan korkeiden GGT- tai ALP-arvojen mukaan.
| Yhteensä | Normaalit GGT- ja ALP-arvot | korkeiden GGT | Korkea ALP | Yhtäaikaisesti korkea GGT ja ALP | P* | ||
|---|---|---|---|---|---|---|---|
| N potilaat | 909 | 596 | 141 | 104 | 68 | ||
| Ikä (vuotta) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 | |
| Sukupuoli, mies/nainen | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 | |
| Komorbiditeetti-indeksi % | |||||||
| Ei ole | 31 | 37 | 21 | 29 | 9 | ||
| Liev.kohtalainen | 52 | 48 | 63 | 59 | 54 | ||
| Vaikea | 17 | 15 | 16 | 12 | 37 | ||
| Aktiiviset tupakoitsijat, % | 15 | 14 | 21 | 10 | 25 | 0.011 | |
| Diabetes mellitus, % | 39 | 35 | 46 | 41 | 50 | 0.013 | |
| Maksasairaus, % | 3 | 2 | 6 | 2 | 10 | ||
| Sepelvaltimotauti, % | 16 | 14 | 10 | 16 | 38 | ||
| Keskushermoston tai perifeerinen iskemia, % | 21 | 19 | 18 | 23 | 34 | 0.031 | |
| Sydämen vajaatoiminta, % | 18 | 16 | 21 | 14 | 37 | ||
| Painoindeksi (BMI), kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5.9) | 0.176 | |
| eGFR, ml/min/1.73 m2 | 14.7 (5.1) | 14.8 (5.1) | 14.6 (4.6) | 14.1 (4.4) | 15.6 (6.2) | 0.234 | |
| Hemoglobiini (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 | |
| Seerumin virtsahappo, mg/dl | 7.6 (1.9) | 7.5 (1.9) | 7.9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | ||
| Kokonaiskolesteroli, mg/dl | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 | |
| Triglyseridit, mg/dl | 147 (96) | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 |
| Seerumin albumiini, g/dl | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 | |
| Seerumin kokonaiskalsium, mg/dl | 9.1 (0.8) | 9.2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 | |
| Seerumin fosfori, mg/dl | 4.7 (1.1) | 4.7 (1) | 4.7 (0.9) | 4.6 (1.2) | 4.6 (1.2) | 0.851 | |
| Seerumin bikarbonaatti, mEq/L | 21.4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 | |
| PTH, pg/ml | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | ||
| ALT, IU/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | ||
| GGT, IU/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | ||
| ALP, IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | ||
| Seerumin ferritiini, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | ||
| C-reaktiivinen valkuainen (C-reaktiivinen valkuainen), mg/l | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | ||
| Proteinuria, mg/g kreatiniinia | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 | |
| Reniini-angiotensiinin estäjät, % | 79 | 80 | 78 | 78 | 72 | 0.502 | |
| Beetasalpaajat, % | 26 | 25 | 30 | 22 | 35 | 0.140 | |
| Diureetit, % | 60 | 59 | 62 | 60 | 65 | 0.829 | |
| Statiinit, % | 53 | 54 | 53 | 55 | 47 | 0.762 | |
| Alopurinoli, % | 22 | 22 | 25 | 26 | 13 | 0.200 | |
| D-vitamiinianalogit, % | 10 | 10 | 7 | 15 | 9 | 0.201 | |
| Trombosyyttivasta-aineet, % | 34 | 33 | 28 | 41 | 38 | 0.124 | |
Tiedot on esitetty keskiarvona (keskihajonta), ellei toisin mainita.
ANOVA tai χ2 ryhmien välillä.
P0.05 korkea GGT-ALP vs. normaali GGT-ALP tai korkea ALP, Scheffé-testi.
P0.05 korkea GGT vs. normaali GGT-ALP, Scheffé-testi.
P0.0001 korkea ALP vs. kukin muista alaryhmistä, Scheffé test.
P0.0001 korkea GGT tai korkea GGT-ALP vs. normaali GGT-ALP tai korkea ALP, Scheffé test.
P0.0001 korkea ALP tai korkea GGT-ALP vs. normaali GGT-ALP tai korkea GGT, Scheffé-testi.
P0.001 korkea GGT tai korkea GGT-ALP vs. normaali GGT-ALP tai korkea ALP, Scheffé-testi.
Tietoja on saatavilla 845:stä potilaasta.
Glomerulussuodatusnopeuden (eGFR) arviointiin käytettiin MDRD-4-kaavaa.12
Serumferritiini oli ainoa parametri, jonka arvot puuttuivat. Käytettävissä olevien arvojen keskiarvo otettiin mukaan kuvailevaan analyysiin, mutta puuttuvia arvoja ei laskettu, eikä tätä muuttujaa sisällytetty kovariaattorina eloonjäämisanalyysiin.
Tulosmuuttuja
Tulosmuuttuja oli mistä tahansa syystä johtuva kuolema. Kuolemansyyt luokiteltiin viiteen ryhmään: äkkikuolema, sydän- ja verisuonisairaudet, infektiot, pahanlaatuiset sairaudet ja muut syyt.
Statistinen analyysi
Jatkuvien muuttujien kuvailevaan vertailuun käytettiin parametrisiä tai ei-parametrisiä testejä niiden ominaisuuksien mukaan, ja kategorisiin muuttujiin käytettiin Khiin neliö -testiä. Pearsonin testiä käytettiin kaksimuuttujaiseen korrelaatioanalyysiin.
Eroja potilaiden eloonjäämisessä GGT- tai ALP-kvartiilien mukaan analysoitiin Kaplan-Meierin käyrillä ja niitä verrattiin Mantel-Haenszelin log-rank-testillä.
Monimuuttujaisia Coxin suhteellisia vaaramalleja käytettiin analysoimaan lähtötilanteen GGT- ja ALP-arvojen vaikutusta kaikkien syiden aiheuttamaan kuolleisuuteen johtavaan aikaan.
Sen vuoksi, että lähtötilanteen GGT- ja ALP-pitoisuudet osoittivat positiivisesti vinoutunutta jakaumaa, arvot muunnettiin logaritmisesti, jotta ne voitiin sisällyttää jatkuvaksi muuttujaksi.
Erojen rekrytointijaksojen huomioon ottamiseksi monimuuttujamallit mukautettiin myös rekrytointijaksoja (2002-2005, 2006-2009, 2010-2014) vastaavan kategorisen muuttujan mukaisesti.
GGT:tä ja ALP:tä analysoitiin jatkuvina muuttujina (logaritmimuunnos) ja kategorisina muuttujina: yläkvartiili ja poikkeuksellisen korkeat arvot (GGT>36IU/L ja ALP>120IU/L).
Seurantaan otettiin mukaan seuraavat regressiomallit: (1) Univariaatti. (2). Mukautettu iän, sukupuolen, komorbiditeettipisteytyksen, diabeteksen, maksasairauden, aktiivisen tupakoinnin, BMI:n, lähtötilanteen eGFR:n ja rekrytointiajan mukaan. (3) Oikaistuna samoilla muuttujilla kuin mallissa 2 sekä seerumin kokonaiskalsium-, fosfori-, PTH-, albumiini-, C-reaktiivisen proteiinin, triglyseridien, virtsahapon ja alaniiniaminotransferaasin (ALT) tasoilla. (4) Parhaiten sopiva malli käyttäen taaksepäin tapahtuvaa ehdollista vaiheittaista eliminointiprosessia.
Suhteellisten vaarojen oletus testattiin käyttämällä log-minus-log-käyriä ja Schöenfeldin residuaaleja kullekin muuttujalle. Potilaat sensuroitiin kuoleman, seurantakadon, munuaisensiirron tai seurannan päättymisen (31.12.2014) yhteydessä sen mukaan, kumpi tapahtui ensin.
Kuvaavat tiedot esitetään keskiarvona ja keskihajontana tai mediaanina ja interkvartiilivälialueena jatkuvien muuttujien osalta ja absoluuttisina arvoina ja prosenttiosuuksina kategoristen muuttujien osalta. A p-arvo
TuloksetPotilaan ominaisuudet
Tutkimusryhmään kuului 909 potilasta, jotka olivat CKD-vaiheessa 4 tai 5 ja jotka olivat ennen dialyysiä (keskimääräinen eGFR 14,7 ± 5,1 ml/min/1,73m2). Keski-ikä (±SD) oli 65±15 vuotta, ja 53 % potilaista oli miehiä. Kaikki olivat valkoihoisia. Kliiniset ja biokemialliset perusominaisuudet on esitetty taulukossa 1.
Potilaiden kliinisten ja biokemiallisten ominaisuuksien analysoimiseksi sen mukaan, oliko GGT- tai ALP-pitoisuus poikkeuksellisen korkea, potilaat jaettiin neljään alaryhmään (taulukko 1): normaalit GGT- ja ALP-pitoisuudet (66 %:lla potilaista), korkea GGT-pitoisuus, mutta normaali ALP-pitoisuus (16 %:lla potilaista), normaali GGT-pitoisuus, mutta korkea ALP-pitoisuus (11 %:lla potilaista), ja yhtäaikaisesti korkeat GGT:n- ja ALP-pitoisuudet (7 %:lla).
Siten 209:llä (23 %) ja 172:llä (19 %) potilaalla oli poikkeavan korkea GGT- ja ALP-arvo lähtötilanteessa. GGT:n ja ALP:n yläkvartiiliarvo oli 34IU/L ja 112IU/L.
Alaryhmien välillä ei ollut merkittäviä eroja keski-ikä- ja sukupuolijakaumassa. Komorbiditeettipisteet ja aktiivisten tupakoitsijoiden osuus oli huomattavasti korkeampi potilailla, joilla oli korkea GGT-arvo, erityisesti ryhmässä, jolla oli samanaikaisesti korkea GGT- ja ALP-arvo (taulukko 1).
Maksasairaudet olivat harvinaisia liitännäissairauksia tässä potilasjoukossa. Kuitenkin noin 8 %:lla potilaista, joilla oli korkeat GGT-arvot, oli diagnosoitu maksasairaus.
Sydän- ja verisuonitautien esiintyvyys potilailla, joilla oli joko korkea GGT- tai korkea ALP-arvo, oli samanlainen kuin potilailla, joilla oli normaalit GGT- ja ALP-arvot, mutta tämä sydän- ja verisuonitautien esiintyvyys lisääntyi merkittävästi potilailla, joilla oli yhtä aikaa korkeat GGT:n ja ALP:n pitoisuudet.
Biokemiallisissa parametreissa havaittiin huomattavia eroja alatyöryhmien välillä (taulukko 1). Potilailla, joilla oli korkea GGT, oli korkeammat seerumin virtsahapon, triglyseridien, ALT:n, ferritiinin ja CRP:n pitoisuudet kuin potilailla, joiden GGT- ja ALP-pitoisuudet olivat normaalit, tai potilailla, joilla oli pelkästään korkea ALP. Niiden potilaiden alaryhmässä, joilla oli pelkästään korkea ALP, oli korkeammat PTH-pitoisuudet. Keskimääräiset lähtötason albumiiniarvot olivat alaryhmissä samanlaiset.
Nämä GGT:hen tai ALP:hen liittyvät biokemialliset mallit vahvistettiin bivariaattisella korrelaatioanalyysillä (taulukko 2).
Biokemian muuttujien välisten korrelaatioiden korrelaatiokertoimet.
| Log GGTa | Log ALPb | Haemoglobiini | Virtsahappo | Triglyseridit | ALT | Fosfori | Kalsium | Ferritiini | Albumiini | PTH | C-reaktiivinen proteiini | eGFR | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | ||||||||||||||||||||||||||||||
| Log ALPb | 0.337** | |||||||||||||||||||||||||||||
| Haemoglobiini | -0.001 | 0.029 | ||||||||||||||||||||||||||||
| Happohappo | 0.162** | 0.051 | 0.068* | |||||||||||||||||||||||||||
| TRIGOLYSIERIDIT | 0.164** | 0.011 | 0.063 | 0.083* | ||||||||||||||||||||||||||
| ALTTOASTEET | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | -0.013 | 0.024 | -0.092* | 0.075* | 0.020 | 0.026 | |||||||||||||||||||
| Kalsium | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0.014 | -0.178** | |||||||||||||||||||||||
| Ferritiini | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0.043 | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | |||||||||||||
| PTH | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0.072* | ||||||||||||||||||||
| C-reaktiivinen proteiini | 0.197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0.077* | |||||||||||||||||||
| eGFR | 0.080* | -0.028 | 0.163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0.054 | ||||||||||||||||||
| Proteinuria | 0.098* | 0.131** | -0.055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0.01.
Log-muunnettu gamma-glutamyylitransferaasi.
Log-muunnettu emäksinen fosfataasi.
Kuolleisuus ja muut kiinnostavat tapahtumat
Tutkimuksen aikana kuoli kaikkiaan 365 potilasta (40 %) potilasjoukon elossaolojakson mediaanipituuden ollessa 74 kuukautta (taulukko 3). Yleisimmät kuolinsyyt olivat odotetusti sydän- ja verisuonisairaudet ja infektiot, eikä alaryhmien välillä ollut merkittäviä eroja (taulukko 3).
Kuolleisuus ja muut kiinnostavat lopputulosmuuttujat potilasryhmässä kokonaisuutena ja GGT:n ja emäksisen fosfataasin (ALP) mukaan jaotelluissa alaryhmissä.
| yhteensä | Normaali GGT ja ALP | korkea GGT. | Korkea ALP | Yhtäaikaisesti korkea GGT ja ALP | ||
|---|---|---|---|---|---|---|
| Median survival time , kuukautta | 74 | 86 | 61 | 82 | 38 | |
| Kuolleet, N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) | |
| Kuolemansyy, N (%): | ||||||
| Äkillinen | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) | |
| Sydän- ja verisuonitauti | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) | |
| Tartuntataudit | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) | |
| Maligniteetti | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) | 6 (15) |
| Muut | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) | |
| Dialyysi, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) | |
| Munuaisensiirto, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) | |
| Hävinnyt seurantaan, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) | |
Seurantajakson aikana, 58 % potilaista joutui aloittamaan dialyysin, ja 15 % sai munuaisensiirron (ennaltaehkäiseviä siirtoja ei ollut). Alaryhmien välillä ei myöskään havaittu eroja niiden potilaiden prosentuaalisessa osuudessa, jotka aloittivat dialyysin, joille tehtiin elinsiirto tai jotka hävisivät seurannasta (taulukko 3).
Gamma-glutamyylitransferaasi ja alkalinen fosfataasi eloonjäämisen määrittäjinä
Kuvissa 1 ja 2 on esitetty Kaplan-Meierin eloonjäämiskäyrät GGT- ja ALP-arvojen taajuusjakauman kvartiilien mukaan. Potilailla, joilla oli korkeat GGT- tai ALP-arvot (ylemmät kvartiilit), oli huonompi eloonjääminen.
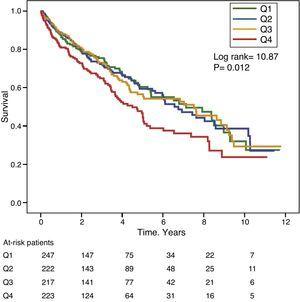
Kaplan-Meierin eloonjäämiskäyrät seerumin GGT-pitoisuuksien taajuusjakauman kvartiilien mukaan (Q, kvartiilit).
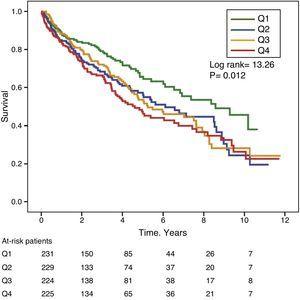
Kaplan-Meierin eloonjäämiskäyrät seerumin ALP-tasojen taajuusjakauman kvartiilien mukaan. (Q=kvartiilit).
Käytettäessä Coxin regressiomalleja GGT jatkuvana tai kategorisena muuttujana (ylempi kvartiili tai seerumin arvo >36IU/L) liittyi merkitsevästi suurentuneeseen kuolleisuuteen analysoiduissa malleissa (taulukko 4). Myös ALP oli merkitsevästi ja itsenäisesti yhteydessä kuolleisuuden lisääntymiseen kaikissa analysoiduissa malleissa, paitsi jos ALP oli sisällytetty parhaiten sopivaan malliin kategorisena muuttujana, joka oli määritelty yläkvartiilin arvona. Tässä mallissa ALP:n yhteys kuolleisuuteen ei saavuttanut tilastollista merkitsevyyttä (P=0,052) (taulukko 4).
Coxin regressiomallit, jotka kuvaavat yhteyttä kuolleisuuteen.
| Muuttuja | yksilöllinen HR (95 % CI) | monimuuttujamalli 1a HR (95 % CI) | monimuuttujamalli 1a HR (95 % CI). CI) | Monimuuttujamalli 2b HR (95 % CI) | Monimuuttujamalli 3c HR (95 % CI) |
|---|---|---|---|---|---|
| Log-muunnettu GGT | 1.310 (1.154-1.489) P0.0001 |
1.260 (1.095-1.449) P0.0001 |
1.174 (1.005-1.371) P=0.042 |
1.166 (1.010-1.347) P=0.036 |
|
| GGT ylempi kvartiili | 1.459 (1.163-1.829) P=0.001 |
1.415 (1.119-1.347) P=0.001.788) P=0.004 |
1.329 (1.036-1.705) P=0.025 |
1.315 (1.064-1.714) P=0.013 |
|
| GGT>36IU/L | 1.513 (1.202-1.905) P0.0001 |
1.509 (1.185-1.923) P=0.001 |
1.393 (1.078-1.800) P=0.011 |
1.390 (1.089-1.779) P=0.009 |
|
| Log-muunnettu ALP | 1.635 (1.278-2.093) P0.0001 |
1.479 (1.149-1.904) P=0.002 |
1.395 (1.061-1.833) P=0.017 |
1.327 (1.008-1.746) P=0.044 |
|
| ALP yläkvartiili | 1.332 (1.062-1.670) P=0.013 |
1.288 (1.023-1.621) P=0.031 |
1.277 (1.001-1.630) P=0.049 |
1.261 (0.998-1.594) P=0.052 |
|
| ALP>120IU/L | 1.527 (1.197-1.947) P=0.001 |
1.419 (1.109-1.815) P=0.005 |
1.362 (1.048-1.770) P=0.021 |
1.305 (1.015-1.678) P=0.038 |
Korjattu iän, sukupuolen, liitännäissairausindeksin, diabeteksen, tupakoinnin, maksasairauden, BMI:n, eGFR:n ja tutkimusjaksojen suhteen.
Oikaistu kaikkien mallin 1 yhteismuuttujien sekä kalsiumin, fosforin, PTH:n, virtsahapon, triglyseridien, ALT:n, albumiinin ja C-reaktiivisen proteiinin osalta.
Paras sovitettu malli, joka sisältää kaikki mallien 1 ja 2 muuttujat sekä GGT:n tai ALP:n, automaattisella muuttujien valintaprosessilla.
Potilaiden, joilla oli korkeat GGT-pitoisuudet (>36IU/L), kuolleisuuden vaarasuhde (HR) oli samanlainen kuin potilailla, joilla oli korkeat ALP-pitoisuudet (>120IU/L), havaittu vaarasuhde (HR) (HR=1,31) täydellisesti sovitetussa mallissa (taulukko 4). Kuvassa 3 esitetään Kaplan-Meierin eloonjäämiskäyrät, jotka havainnollistavat tätä yhteyttä, sekä samanaikaisesti korkean GGT- ja ALP-arvon additiivinen vaikutus eloonjäämisen vähenemiseen.
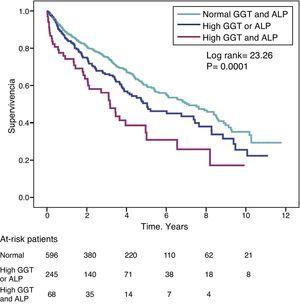
Kaplan-Meierin eloonjäämiskäyrät tutkimuspotilailla normaalien GGT- ja ALP-pitoisuuksien, poikkeavan korkean GGT- tai ALP-pitoisuuden (jompikumpi) ja samanaikaisesti korkean GGT- ja ALP-pitoisuuden mukaan.
Maksan liitännäissairauksien mahdollisen sekoittavan vaikutuksen arvioimiseksi GGT:n ja ALP:n ja kuolleisuuden väliseen yhteyteen muodostettiin Coxin regressiomalli, josta jätettiin pois 27 potilasta, joilla oli aiemmin todettu maksasairaus. Tässä sovitetussa mallissa korkea GGT (>36IU/L) säilytti tilastollisesti merkitsevän yhteyden kuolleisuuteen (HR=1,316; 95 % CI: 1,016-1,705; P=0,03), kun taas korkea ALP (>120IU/L) osoitti yhteyttä tilastollisen merkitsevyyden rajalla (HR=1,296; 95 % CI: 0,999-1,680; P=0,05).
Keskustelu
Tässä tutkimuksessa saadut tulokset osoittavat, että kohonnut seerumin GGT- tai ALP-pitoisuus liittyy itsenäisesti korkeampaan kuolleisuuteen potilailla, joilla on CKD. Tämä tutkimus paljastaa myös ensimmäistä kertaa, että molempien parametrien samanaikaisella kohoamisella on additiivinen vaikutus kuolleisuuden ennustamiseen myös potilailla, joilla ei ole maksasairautta.
Tässä tutkimuksessa potilailla, joilla oli CKD ja korkeat GGT-pitoisuudet, oli enemmän liitännäissairauksia, erityisesti diabetesta ja sydämen vajaatoimintaa, ja heillä oli samankaltainen biokemiallinen profiili kuin metabolisessa oireyhtymässä, vaikka BMI ei tässä alaryhmässä eronnutkaan muiden tutkimuspotilaiden BMI:stä.
Kun otetaan huomioon ALP:n kaikkialla elimistössä esiintyvä luonne, tämän entsyymin korkeat pitoisuudet seerumissa voivat ilmentää useita erilaisia patologisia prosesseja. Tässä mielessä spesifisten ALP-isoentsyymien määrittäminen voi olla hyödyllistä niiden alkuperän erottamisessa tapauksissa, joissa yksittäisiä kohonneita arvoja ei voida katsoa johtuvan lisääntyneestä luun uudelleenmuodostuksesta.
CKD-potilaiden, joilla on CKD ja korkeat ALP-pitoisuudet, raportoidun liiallisen kuolleisuuden on kiistanalaisesti katsottu johtuvan mahdollisista sydän- ja verisuoniperäisistä haitallisista vaikutuksista, jotka johtuvat luun ja kivennäisaineiden aineenvaihdunnan erittäin vakavasta kontrolloimattomasta tilasta.2,3,13,14 Tätä yhteyttä on ehdotettu selitettäväksi useilla patogeneettisillä mekanismeilla, kuten lisääntynyt verisuonten kalkkeutuminen valtimoiden seinämässä tapahtuvan pyrofosfaatin hydrolyysin kautta15 , systeeminen tulehdus16,17 ja D-vitamiinin puute18. Se, että luustosta peräisin olevan ALP:n isoentsyymin (luustospesifisen ALP:n) seerumipitoisuuksien ja kuolleisuuden välillä ei kuitenkaan ole merkittävää yhteyttä CKD-potilailla19 , herättää kuitenkin vakavia epäilyjä hypoteesin patogeenisesta yhteydestä luun ja kivennäisaineiden aineenvaihduntaan.
Tässä tutkimuksessa 11 %:lla potilaista oli kohonnut ALP-pitoisuus, kun taas GGT-pitoisuudet olivat normaalit, ja tälle alaryhmälle oli tunnusomaista korkeat PTH:n keskiarvot, mikä viittaa siihen, että luusto saattaisi olla ALP:n kohonneen pitoisuuden aiheuttaja. Samanaikainen korkea ALP- ja GGT-arvo luonnehti kuitenkin potilaiden alaryhmää, jolla oli enemmän liitännäissairauksia, pääasiassa sydän- ja verisuonitauteja, ja jonka biokemiallinen profiili muistutti enemmän potilaita, joilla oli pelkästään korkea GGT-arvo, kuin potilaita, joilla oli pelkästään korkea ALP-arvo. Näin ollen voidaan erottaa kaksi riskiprofiilia potilailla, joilla on CKD ja korkea ALP-pitoisuus, sen mukaan, onko heillä korkea GGT-pitoisuus vai ei. Vaikka korkea ALP yksinään liittyi kohtalaiseen kuolleisuusriskiin, molempien entsyymien samanaikainen kohoaminen liittyi suurempaan kuolleisuusriskiin.
GGT on entsyymi, joka vastaa solunulkoisen pelkistyneen glutationin (GSH), yhden nisäkkäiden tärkeimmän solunsisäisen antioksidantin, hydrolyysistä, mikä mahdollistaa sen, että esiasteina olevia aminohappoja voidaan myöhemmin käyttää uuteen solunsisäiseen GSH:n synteesiin.6 Näin ollen lisääntynyt GGT on osoitus solunsisäisestä GSH:n ehtymisestä, ja siksi GGT:tä voidaan pitää oksidatiivisen stressin merkkiaineena.6
Serumin GGT:n on osoitettu olevan kardiometabolinen biomarkkeri väestössä. Useissa tutkimuksissa on havaittu merkitsevä, riippumaton yhteys GGT-pitoisuuksien ja sekä sydän- ja verisuonitautikuolleisuuden että kokonaiskuolleisuuden välillä.20-22 Korkeiden GGT-pitoisuuksien on osoitettu olevan yhteydessä huonompaan ennusteeseen sepelvaltimotaudissa ja sydämen vajaatoiminnassa.23,24,24 On myös havaittu GGT:n mahdollinen patogeeninen vaikutus ateroskleroottisen plakin muodostumiseen, sen eroosioon ja myöhempään repeämiseen,25 mikä voisi osaltaan selittää sen yhteyttä kardiovaskulaariseen sairastavuuteen ja kuolleisuuteen biologiselta kannalta.
GGT:n ennustearvoa CKD-potilailla on tutkittu niukasti. Postorino ym.9 havaitsivat 584:llä dialyysihoidossa olevalla CKD-potilaalla vahvan, riippumattoman yhteyden korkeiden GGT-pitoisuuksien ja kokonais- ja sydän- ja verisuonikuolleisuuden välillä. Seerumin ALP-pitoisuuksia ei kuitenkaan määritetty tässä tutkimuksessa.
Jossain toisessa tutkimuksessa korkeat GGT-pitoisuudet liittyivät CKD-potilaiden huomattavaan endoteelin toimintahäiriöön, mikä viittaa tämän merkkiaineen kohonneiden pitoisuuksien ja sydän- ja verisuonitautien riskin väliseen yhteyteen.10
Mahdollisen systeemisen pro-oksidaatiovaikutuksen lisäksi muutkin hypoteesit voisivat osaltaan selittää kohonneiden GGT-pitoisuuksien ja kuolleisuuden välistä yhteyttä potilaille, joilla on CKD-tauti. Näin ollen korkea GGT voisi yksinkertaisesti viitata alkoholin väärinkäyttöön tai maksasairauksiin, liitännäissairauksiin, jotka perustelisivat liiallisen kuolleisuuden. Tässä tutkimuksessa GGT:llä säilyi kuitenkin merkittävä yhteys kuolleisuuteen sen jälkeen, kun kroonista alkoholismia, kroonisia maksasairauksia tai hepatotrooppisia virusinfektioita sairastavat potilaat oli suljettu pois, mikä sulkee pois maksasairauksien yksinomaisen roolin tässä yhteydessä.
Rasvainen maksasairaus ja kongestiivinen maksasairaus ovat kuitenkin kaksi subkliinistä maksasairautta, jotka voivat aiheuttaa korkeita GGT-pitoisuuksia26,27. Rasvamaksasairaus on suhteellisen yleinen löydös CKD-potilailla, ja se liittyy läheisemmin sydän- ja verisuonitautien riskitekijöihin kuin maksakomplikaatioiden kehittymiseen.27 Rasvamaksasairauteen liittyvät kliiniset ja biokemialliset piirteet ovat samankaltaisia kuin ne, jotka havaittiin tutkimuksemme korkean GGT:n saaneiden potilaiden alaryhmässä. Tässä tutkimuksessa rasvamaksasairauden diagnoosia ei kuitenkaan selvitetty riittävästi useimmilta potilailta, joten ei voida taata, että korkea GGT johtuisi pääasiassa tästä sairaudesta.
Kongestiivinen maksasairaus tarkoittaa maksan poikkeavuuksien kirjoa, joka johtuu oikeanpuoleisen sydämen vajaatoiminnan tai minkä tahansa sellaisen syyn, joka nostaa keskuslaskimopaineita, mukaan lukien tilavuuden ylikuormittuminen, vakava keuhkoverenpainetauti tai läppäkivipotilaat, aiheuttamasta passiivisesta ahtaumasta.28 Seerumin kohonnut GGT tai ALP ovat tyypillisiä biokemiallisia poikkeavuuksia CKD-potilailla, joilla on vasemman kammion diastolinen toimintahäiriö, erityisesti jos niihin liittyy keuhkojen ruuhkautuminen29 , joka on myös tunnustettu kuolleisuuden riskitekijä näillä potilailla.30
Korostunut GGT voi myös kuvastaa mikrosomaalisten entsyymien induktiota.31 Alkoholin nauttimisen lisäksi monet lääkeaineet voivat indusoida maksa-arvoja. Tässä tutkimuksessa yksikään CKD-potilaille yleisimmin määrätyistä lääkkeistä ei ollut merkitsevästi yhteydessä korkeisiin GGT- tai ALP-pitoisuuksiin, vaikka käsikauppalääkkeiden (erityisesti kipulääkkeiden) mahdollista vaikutusta potilaidemme korkeisiin GGT-pitoisuuksiin ei voida sulkea pois.
Tässä tutkimuksessa on joukko rajoituksia. Sen retrospektiivisen rakenteen vuoksi kausaalisuhteita ei voitu todeta. Tutkimus tehtiin yhdellä paikkakunnalla, ja tutkittu kohortti oli etnisesti homogeeninen (valkoihoinen), vaikka se edustikin paikallista väestöä. GGT:tä ja ALP:tä ei analysoitu ajassa muuttuvina kovariaattoreina, ja siksi on todennäköistä, että GGT:n ohimenevän nousun ennusteellinen merkitys on erilainen kuin ajan mittaan jatkuvan nousun. Tässä tutkimuksessa korkean GGT:n havaitseminen poikkileikkausanalyysissä tietyssä CKD:n vaiheessa liittyi kuitenkin kliiniseen fenotyyppiin, joka on erittäin kiinnostava, koska sillä on yhteys kardiovaskulaariseen liitännäissairauteen ja kuolleisuuteen. Lopuksi, luustospesifistä ALP:tä ja muita parametreja, jotka liittyvät tarkemmin luun uudelleenmuodostukseen, ei mitattu.
Johtopäätöksenä voidaan todeta, että epänormaalisti kohonnut GGT-pitoisuus on yleinen löydös CKD-potilailla, jota havaitaan yleisemmin potilailla, joilla on enemmän liitännäissairauksia, erityisesti sydän- ja verisuonitauteja, ja joka on itsenäisesti yhteydessä kuolleisuuteen. Samanaikaisesti koholla olevat seerumin GGT- ja ALP-arvot lisäävät kuolleisuusriskiä. Siksi seerumin GGT:n ja ALP:n yhdistetty mittaaminen voisi tarjota lisäennustetietoa CKD:tä sairastavilla potilailla.
Interintäristiriidat
Tekijät ilmoittavat, että eturistiriitoja ei ole.
Tekijät ilmoittavat, että eturistiriitoja ei ole.