Potilas, jolla on mahalaukun subepiteelivaurio
Martín Gómez Zuleta, MD (1)
(1) Gastroenterologian yksikkö, sisätautien osasto, Kolumbian kansallinen yliopisto. Hospital Tunal. Bogotá, Kolumbia..
Vastaanotettu: 05-10-10 Hyväksytty: 25-11-10
Abstract
Vaikka subepiteliaalisia leesioita esiintyy harvoin ylemmässä ruoansulatuskanavassa, ne voivat aiheuttaa epävarmuutta diagnostisessa lähestymistavassa ja hoidossa. Endosonografiset löydökset kuvataan ja nykyisiä suosituksia tarkastellaan yhden tapauksen valossa, jotta näihin leesioihin voidaan suhtautua rationaalisesti.
Avainsanat
Submucosaaliset kasvaimet, endoskooppinen ultraääni, GIST.
Kliininen tapaus
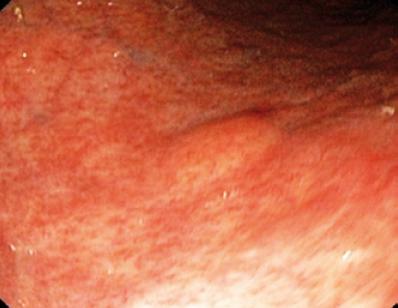
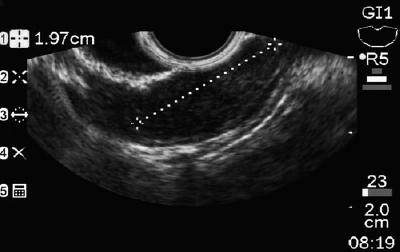
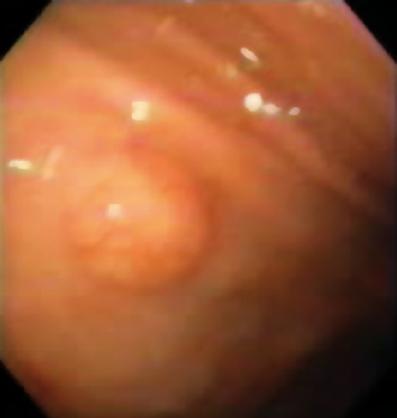
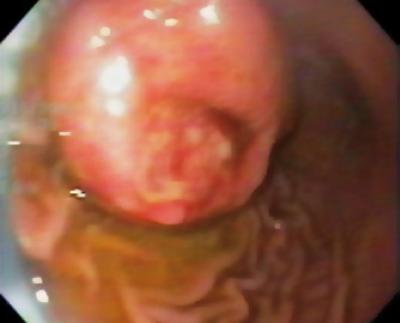
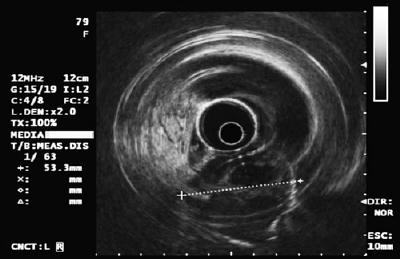
50-vuotias mies, jolla oli dyspepsia, lähetettiin ylempään endoskopiaan, jossa havaittiin 9 mm:n suuruinen subepiteliaalinen leesio mahalaukun korpuksessa (kuva 1). Yläpuolisen limakalvon biopsia oli normaali. Potilaalla ei ollut aiempaa sairaushistoriaa, ja fyysinen tutkimus oli normaali.
Kuva 1. Mahalaukun subepiteliaalinen leesio.
Alkuperäinen lähestymistapa: Mitä sitten voitaisiin tehdä?
Massaa tai uloketta normaalin epiteelin peittämän elimen luumenissa kutsutaan subepiteelileesioksi. Ne ovat harvinaisia leesioita, joita esiintyy arviolta yhdessä 300:sta endoskopiasta (1, 2). Syynä voivat olla ruoansulatuskanavan seinämän sisäiset hyvän- tai pahanlaatuiset leesiot tai normaalien tai patologisten viereisten rakenteiden aiheuttama ekstrinsinen puristus (3).
Nämä leesiot löydetään yleensä satunnaisesti, eikä niillä useinkaan ole yhteyttä oireisiin, kuten potilaallamme oli. Tämä voi saada lääkärin epäilemään, pitäisikö hänen seurata tarkempia tutkimuksia ja suorittaa lisätutkimuksia (4). Mielestämme kaikki nämä vauriot olisi arvioitava niiden alkuperän selvittämiseksi. Aina on otettava koepala limakalvon yläpuolelta (ellei epäillä verisuoniperäistä tai kystistä alkuperää), koska monet näistä leesioista voivat olla peräisin lamina propriasta tai muscularis mucosasta. Näissä tapauksissa ne voidaan tavoittaa pihdeillä, ja tarkka diagnoosi voidaan tehdä. Jos biopsiat ovat normaalit, tässä vaiheessa on määriteltävä, lopetetaanko tutkimus vai jatketaanko sitä.
Kun endoskopia on suoritettu ja subepiteelivaurio on havaittu, voimme välittömästi arvioida sen. Aluksi on kuvattava sen koko, muoto, väri ja liikkuvuus sekä se, sykkiikö se vai ei. Lopuksi voimme arvioida sen koostumusta suljetuilla biopsiapihdeillä, jolloin voimme havaita, onko se kystinen, kiinteä vai pehmeä, painuva ja tyynymäinen (hitaasti toipuva vaurio). Tyynynmuotoiset vauriot, joissa on keltaisia haloja, viittaavat vahvasti lipoomiin. Jos leesio on hieman epäsäännöllinen limakalvolla ja siinä on keskeinen painauma, se viittaa ektooppiseen haimaan. Yleensä kystat tai suonikohjut ovat sileää, symmetristä limakalvoa. GIST:t (gastrointestinaaliset stroomakasvaimet) voivat olla hieman haavaumia, mutta ne ovat kiinteitä ja liikkuvia (9). On myös hyödyllistä vaihtaa potilaan asentoa, jotta voidaan sulkea pois mahdollinen eksternaalinen leesio, jonka endoskooppinen ulkonäkö muuttuu, jos potilas vaihtaa asentoa, hengittää tai jos potilaan vatsa on täynnä ilmaa (10-12).
Mikä on erotusdiagnoosi?
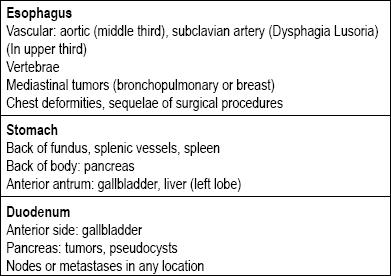
Ruoansulatuskanavassa on monen tyyppisiä leesioita, jotka voidaan luokitella subepiteliaalisiksi. Niiden syyt riippuvat yleensä siitä, sijaitseeko vaurio ruokatorvessa, mahassa, pohjukaissuolessa vai peräsuolessa. Seuraavaksi on pohdittava, onko kyseessä todella seinämän leesio vai onko kyseessä ekstrinsinen puristus, sillä koko ruoansulatuskanavan ympärillä on rakenteita, jotka voivat johtaa puristukseen (taulukko 1) (5-8).
Taulukko 1. Suoliston seinämän vaurio. Ylemmän ruoansulatuskanavan ekstraluminaalisten puristusten ensisijaiset syyt.
Pitäisikö kaikki vauriot arvioida endoskooppisella ultraäänellä (EUS)?
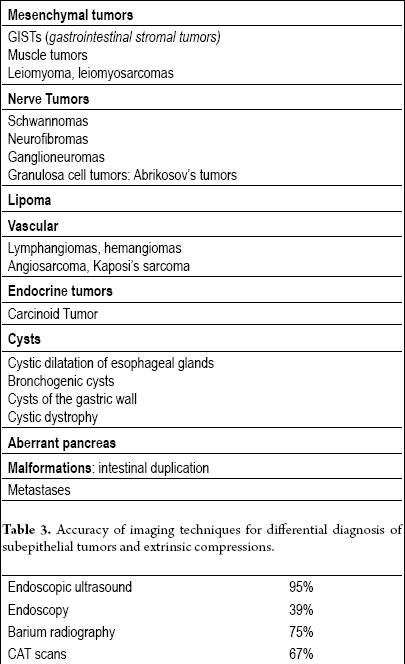
Kaikki subepiteliaaliset leesiot (taulukko 2) on arvioitava lisäkuvantamismenetelmillä, mutta jos leesio on alle senttimetrin läpimittainen (etenkin jos se on keltainen), arviointi ei ole tarpeen, koska kyseessä on suurella todennäköisyydellä lipooma.
Taulukko 2. Lihasleesiot. Ruoansulatuskanavan subepiteliaaliset kasvaimet.
Valintatekniikka on endoluminaalinen tai endoskooppinen ultraääni (EUS) (13, 14). EUS:n tarkkuus ekstraluminaalisen puristuksen erottamisessa subepiteelikasvaimesta on yli 95 %. Tämä on paljon parempi kuin muilla kuvantamistekniikoilla, kuten tavanomaisella ultraäänellä tai tietokonetomografialla (15-17) (Taulukko 3).
Taulukko 3. Kuvantamistekniikoiden tarkkuus subepiteliaalisten kasvainten ja ekstrinsisten puristusten erotusdiagnostiikassa.
Kun olemme todenneet, että leesio on seinämän sisäinen eikä ole ekstrinsinen puristus, meidän on arvioitava, mihin seinämäkerrokseen se kuuluu. Normaalisti mahalaukun seinämä jaetaan limakalvoon, submukoosaan, muscularis propriaan ja seroosaan. Limakalvokerros jaetaan epiteeliin, tyvikalvoon, lamina propriaan ja lihaskalvoon. EUS:llä ja radiolaitteilla seinämä voidaan jakaa viiteen kerrokseen (18):
Ensimmäinen hyperechoinen kerros vastaa mahalaukun limakalvon pinnallisinta osaa.
Toinen hyperechoinen kerros vastaa limakalvon syvintä osaa, joka voidaan korreloida lihaskalvon kanssa.
Kolmas hyperechoinen kerros vastaa submucosakerrosta.
Neljäs hyperechoinen kerros vastaa itse lihasta.
Viides hyperechoinen kerros vastaa serosaa tai adventitiaa.
Normaalisti kerroksissa yksi ja viisi ei ole leesioita (19), joten ne rajoittuvat kolmeen kerrokseen. Ne ovat yleensä hypoekaikuisia, anekaikuisia tai hyperechoisia.
Diagnostiikka endoskooppisen ultraäänen avulla
Kuvaamme jokaisen esityksen kerroksen mukaan.
Kakkoskerroksen kaiku
Kerros kaksi
Vastaavat limakalvon syvintä osaa tai lamina propriaa ja muscularis mucosaa. Tähän kerrokseen syntyvät vauriot ovat harvinaisia ja yleensä hypoekaikuisia.
Hypoekaikuiset vauriot: Suurin osa tähän kerrokseen syntyvistä kasvaimista on lihaskasvaimia, yleensä leiomyoomia. Niissä voi olla kalkkeutumia, ja suuret leesiot voivat olla heterogeenisiä ja niissä voi esiintyä kyhmyjä toisin kuin pienissä leesioissa, jotka ovat homogeenisia. (20).
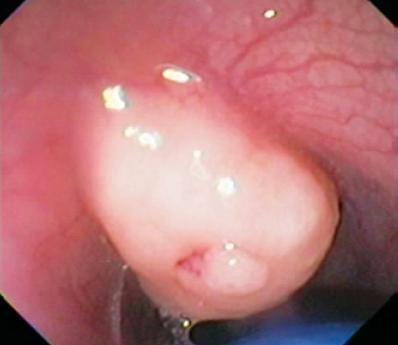
Tässä kerroksessa esiintyy myös Abrikosovin kasvaimia tai granulaarisia soluja. Ne ovat yleensä pieniä, ja toisin kuin leiomyoomat, ne deformoivat endoskoopin palloa kovuutensa vuoksi (kuvat 2 ja 3). Myös karsinoidit voivat saada alkunsa tästä kerroksesta, yleensä funduksesta tai peräsuolesta (kuva 4).
Kuva 2. Keltaisen värinen subepiteelivaurio distaalisessa ruokatorvessa.
Kuva 3. EUS:ssä näkyy kolmannessa kaikukerroksessa palloa deformoiva isoeikäinen leesio, joka viittaa 2 cm:n suuruiseen rakeiseen solukasvaimeen
Kuva 4. Subepiteliaalinen leesio, jonka keskellä on verkkomainen kuvio, mikä viittaa neuroendokriiniseen kasvaimeen.
Anechoiset leesiot: Yleensä nähdään, että inkluusio- tai retentiokystat voivat saada alkunsa tästä kerroksesta.
Echokerros kolme
On kudoskaistale, joka näyttää EUS:ssä ylikaikuiselta. Lukuisat kasvaimet voivat saada alkunsa tästä kerroksesta.
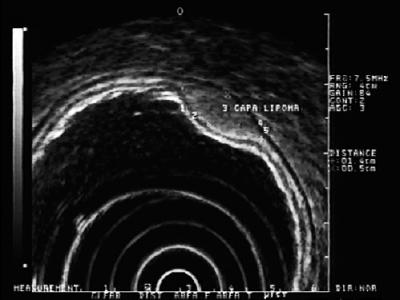
Hyperechoic lesions: Tässä kerroksessa yleisimmin esiintyvät leesiot ovat lipoomia. Niitä luonnehditaan homogeenisiksi hyperechoisiksi leesioiksi. Yleensä ne ovat tyynymäisiä, kun niitä työnnetään endoskooppisella pihdillä (kuva 5) (9).
Kuva 5. EUS: lipooman kanssa yhteensopiva hyperechoinen leesio submukoosikerroksessa 3.
Neurofibroomat ovat yleensä hyperechoisia. Ne saavat alkunsa submucosasta tai muscularis propriasta.
Hypoechoiset leesiot tässä kerroksessa voivat vastata ektooppista tai poikkeavaa haimaa. Nämä leesiot ovat yleensä heterogeenisiä, ja toisinaan niiden keskellä voidaan nähdä anehekoisia kanavamaisia rakenteita, jotka saattavat vastata kanavia. Endoskopiassa nähdään leesio, jonka keskus on painunut (21).
Hypoekoottiset leesiot voivat vastata myös karsinoidikasvaimia. Vaikka ne eivät ole subepiteliaalisia kasvaimia, koska ne ovat pikemminkin neuroendokriinisiä kuin mesenkymaalisia, ne voivat sijaita ruoansulatuskanavan seinämässä ja synnyttää samantyyppisiä kyhmyjä. Yleensä ne ovat pieniä (alle yhden senttimetrin kokoisia), hypoekaikuisia (mutta enemmän echogeenisiä kuin lihaksikkaita) ja asettuvat limakalvoon. Histologinen tutkimus on yleensä mahdollista biopsiasta (22, 23).
Mahalaukun lymfoomia voi esiintyä myös submucosan hypoekaikuisina tai hyperekaikuisina leesioina (24).
Tässä kerroksessa havaittavat kaikuisat leesiot ovat todennäköisesti verisuonirakenteita tai kystia (25).
Echokerros neljä
Echokerros neljäs
Echokerroksena vastaa lihaskerrosta. Näin ollen suurin osa tässä kerroksessa esiintyvistä kasvaimista on lihasperäisiä.
Hyperechoiset leesiot ovat hyvin harvinaisia, mutta ne voivat liittyä lymfoomiin, neurogeenisiin kasvaimiin tai etäpesäkkeisiin (26).
Hypoechoiset leesiot: Suurin osa tämän kerroksen kasvaimista on hypoekaikuisia, useimmiten stroomakasvaimia (GIST), kun ne sijaitsevat mahalaukussa. Jos ne kuitenkin sijaitsevat ruokatorvessa, niitä kutsutaan yleensä leiomyoomiksi. Muita vaurioita, joilla voi olla tämä ulkonäkö, ovat keuhkoista tai rinnoista peräisin olevat etäpesäkkeet ja glomuskasvain (27). Myös lymfoomat voivat vaarantaa tämän kerroksen, mutta niihin liittyy yleensä ylempien kerrosten sitoutuminen.
GIST (gastrointestinaalinen stroomakasvain) on nimitys leesiolle, josta tietämyksemme on parantunut huomattavasti viime vuosina (28-30). Nämä kasvaimet näyttävät saaneen alkunsa totipotentiaalisista soluista, jotka ovat myös niin sanottujen Cajalin interstitiaalisten solujen syntypaikkoja. Ne voidaan erottaa ryhmiin: pääasiassa lihassoluja, pääasiassa hermosoluja tai näiden kahden yhdistelmä. Diagnoosi tehdään tunnistamalla immunohistokemiallisesti CD-117-proteiini (tunnetaan myös nimellä c-kit-proteiini), joka on kalvoreseptori, jolla on tyrosiinikinaasiaktiivisuus (31).
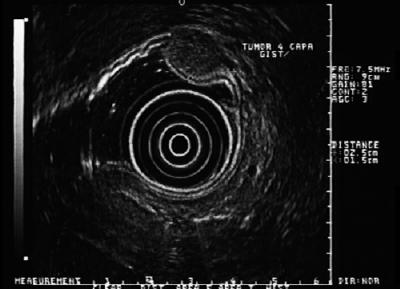
Tärkeää näissä leesioissa on se, että 30 % niistä voi käyttäytyä pahanlaatuisesti ja synnyttää etäpesäkkeitä. Pelkästään Yhdysvalloissa raportoidaan vuosittain 5 000-6 000 tapausta (32). Ne jakautuvat ruoansulatuskanavassa seuraavasti: mahalaukku (40-70 %), ohutsuoli (20-40 %), paksu- ja peräsuoli (5-15 %) ja ruokatorvi (<5 %) (33). Tämä tarkoittaa, että jos ruokatorvessa on neljännen kerroksen hypoekaikuinen leesio, se on todennäköisesti leiomyooma, mutta jos se on mahassa, se on yleensä GIST (kuva 6, 7 y 8). Useimmat potilaat ovat viidennellä tai kuudennella elinvuosikymmenellä. Yleensä heillä leesio sijaitsee neljännessä kerroksessa eli muscularis propria, vaikka se voi sijaita myös muscularis mucosassa (34). Useimmat potilaat ovat oireettomia, kunnes kasvain kasvaa niin suureksi, että se haavaantuu, vuotaa tai muodostaa etäpesäkkeitä.
Kuva 6. EUS:ssä näkyy GIST:n kanssa yhteensopiva hypoekoottinen leesio neljännessä kerroksessa.
Kuva 7. GIST:iin viittaava haavainen leesio.
Kuva 8. Kuvan 7 EUS:ssä näkyy neljännen kaikukerroksen hypoekoottinen leesio, joka viittaa vahvasti GIST:iin ja on yli 5 cm:n kokoinen.
Tästä syystä, jos tunnistamme yli 3 cm:n kokoisen GIST:n, se on leikkausindikaatio, vaikka se olisikin oireeton (muut kirjoittajat suosittelevat 4 cm:n rajaa). (35). Alle 3 cm:n leesiot ovat kuitenkin haasteellisia hoidon kannalta, koska suurin osa niistä on hyvänlaatuisia. On kuitenkin selvennettävä, että kaikki GIST:t ovat potentiaalisesti pahanlaatuisia, ja pieniä GIST:iä, jotka ovat antaneet etäpesäkkeitä, on raportoitu erityisesti alemmassa ruoansulatuskanavassa. Tällä hetkellä emme pysty ennustamaan endoskooppisella ultraäänitutkimuksella GIST:n pahanlaatuisuuspotentiaalia. Tiedämme kuitenkin, että leesioilla, jotka ovat yli 4 cm:n kokoisia, joissa on epäsäännölliset rajat ja/tai kystiset tilat sisällä tai joissa on echogeenisiä polttopisteitä, on suuri todennäköisyys olla pahanlaatuisia (36).
Toisaalta endoskooppisella ultraääniohjatulla ohutneulanäytteenotolla (EUS-FNA) voidaan diagnosoida GIST:iä paitsi CD-117:n tunnistamisen avulla myös Ki-67-proteiinin läsnäololla, joka ilmaisee proliferaatiota ja viittaa pahanlaatuisuuteen (37). On erittäin tärkeää korostaa, että GIST-leesiot ovat hyvin vaarallisia. Meidän on seurattava niitä jatkuvasti ja arvioitava kasvaimen kokoa ja proliferaationopeutta todettujen riskien mukaisesti. Jopa täydellisen resektion jälkeen nämä leesiot voivat uusiutua, erityisesti lähtöpaikassa, mutta myös vatsakalvossa tai maksassa. 40-90 prosenttia vaurioista uusiutuu täydellisestä resektiosta huolimatta. 50 % uusiutumisista kohdistuu maksaan. GIST:ien uusiutumisriski on nelinkertainen, kun primaaripaikkana on suolisto, verrattuna siihen, kun se on mahalaukussa (38).
Millainen on endoskooppisen ultraäänitutkimuksen tarkkuus?
Monissa tutkimuksissa on osoitettu, että EUS on erittäin tarkka määritettäessä, onko leesio seinämässä vai ei, ja määritettäessä, mistä seinämän kerroksesta leesio on peräisin. Näin voimme valita parhaan diagnostisen lähestymistavan. Eräässä tutkimuksessa määritettiin lähdekerros 48 potilaalla 50:stä (96 %), joilla oli kirurginen vahvistus (39). Tarkkailijoiden välinen yksimielisyys on erittäin hyvä, erityisesti tunnistettaessa leesioita, kuten leiomyoomia ja vaskulaarisia leesioita. On tärkeää huomata, että leesioiden sonografisen ulkonäön perusteella ei voida määrittää niiden syitä 100 prosentin varmuudella. Karacan ym. tutkimuksessa (40), joka koski 22 potilasta, joille tehtiin EUS ja sen jälkeen mukosektomia, todettiin, että EUS:n tarkkuus oli vain 45 prosenttia. Vauriot olivat kuitenkin useimmiten pienempiä kuin 20 mm, ja ultraäänen tarkkuus nousi 66 prosenttiin pahanlaatuisten ja hyvänlaatuisten kasvainten erottamisessa. Koska sonografiset kriteerit voivat olla epätarkkoja, vaikuttaa järkevältä, että meidän olisi mahdollisuuksien mukaan pyrittävä saamaan täsmällinen diagnoosi. Tämä voidaan saavuttaa EUS-FNA:lla tai leesion limakalvoresektiolla, kuten tässä työssä osoitettiin. Mekky ym. tutkivat 141 potilasta, joille tehtiin EUS-FNA, joka tarkistettiin kirurgisesti. He havaitsivat lopputulosten tarkkuudeksi 95,6 % (41).
Monitorointi, pistosbiopsia vai resektio?
Päätös monitoroinnista, käytöstä tai resektiosta riippuu useista tekijöistä, kuten leesion koosta, sen endoskooppisesta ulkonäöstä, alkuperäkerroksesta ja echogeenisistä ominaisuuksista. Jos kyseessä on alle 1 cm:n subepiteliaalinen leesio, useammat tutkimukset eivät ole perusteltuja, mutta seurantaendoskopia on syytä tehdä. Jos leesio on yli 1 cm, EUS on pakollinen. Jos leesio on pieni ja riippuu ensimmäisestä, toisesta tai kolmannesta kaikukerroksesta, voidaan suorittaa diagnostinen limakalvon resektio, joka on myös terapeuttinen. Jos leesio kuitenkin sijaitsee neljännessä kerroksessa ja on alle 2 cm, suositellaan seurantaa pelkällä endoskopialla. Jos se on kooltaan 2-5 cm, EUS-FNA on ihanteellinen. Jos todetaan, että kyseessä on hyvänlaatuinen vaurio, seurantatutkimus voidaan tehdä 6 kuukauden kuluttua. Jos se ei ole kasvanut, lisäseurantaa ei tarvita. Jos se on pahanlaatuinen, sillä on pahanlaatuisen potentiaalia tai se on yli 5 cm:n kokoinen, suositellaan hoitoa (42).
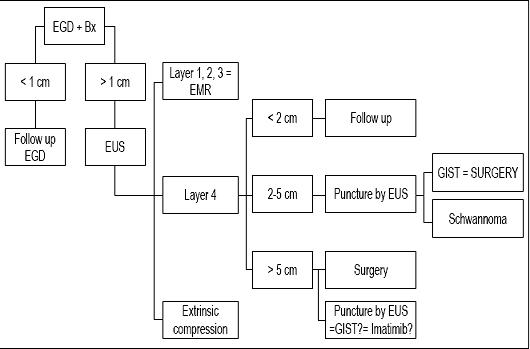
Johtopäätöksenä todettakoon, että koska potilaallamme oli alle 1 cm:n kokoinen leesio, katsomme, että hänen leesionsa ansaitsi vain seurantatutkimuksen endoskopian (ks. algoritmi, kuva 9). Uutta seurantatutkimusta ehdotettiin vuoden kuluttua. Jos leesio ei ole kasvanut, lisäseurantatutkimukset sovitaan 2 tai 3 vuoden välein, mutta jos se kasvaa, ehdotamme EUS-FNA:ta ja immunohistokemiallista tutkimusta.
Kuva 9. Hoitoalgoritmi subepiteliaalisissa leesioissa. EGD: ylempi endoskopia. Bx: Biopsia. EUS: endoskooppinen ultraääni. EMR: endoskooppinen limakalvoresektio.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoskooppinen lähestymistapa ruoansulatuskanavan stroomakasvaimiin. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS submucosaalisissa kasvaimissa. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskooppinen ultraääni ja endoskooppinen ultraääniohjattu ohutneulanäytteenotto pahanlaatuisten submukoottisten kasvainten diagnostiikassa. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Endoskooppisen ultraäänitutkimuksen tarkkuus ylemmän ruoansulatuskanavan submucosal leesioissa: prospektiivinen monikeskustutkimus. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, ym. endosonografiset piirteet mahalaukun ektooppisten haimatulehdusten erotettavissa mesenkymaalisista kasvaimista. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Endoskooppisen ultraäänen rooli ruokatorven ja mahalaukun submukoottisten kasvainten hoidossa. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Mahalaukun duplikaatiokystien ohutneula-aspiraatiobiopsia endoskooppisella ultraääniohjauksella. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoskooppinen limakalvon resektio mahalaukun kasvaimissa. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskooppinen limakalvoresektio. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoskooppinen ultraäänitutkimus ruoansulatuskanavan stroomakasvaimissa (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Tutkimus ruoansulatuskanavan yläosan myogeenisistä kasvaimista endoskooppisella ultraäänitutkimuksella, erityisesti hyvän- ja pahanlaatuisten leesioiden erotusdiagnostiikkaan liittyen. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Submucosaalisten ylemmän ruoansulatuskanavan vaurioiden arviointi endoskooppisella ultraäänellä. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskooppinen ultraäänitutkimus mahalaukun submukoottisen kasvaimen diagnostiikassa. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. gastrointestinaalisten ultraäänikuvien histologiset korrelaatit. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektiivinen arviointi over-the-wire katetrin US-sondista. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskooppinen ultraäänitutkimus sileän lihaksen kasvainten arvioinnissa ylemmässä ruoansulatuskanavassa: kokemus 42 tapauksesta. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoskooppinen ultraäänitutkimus. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Ruoansulatuskanavan kuvantaminen: endoskooppinen ultraääni. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Kudosnäytteenoton tuotto EUS:llä arvioiduista submucosaalisista leesioista. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskooppinen ultraäänitutkimus alkuvaiheessa ja seurannassa potilailla, joilla on lääkkeellisesti hoidettu matala-asteinen mahalaukun lymfooma limakalvoon liittyvästä imukudoksesta. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Eturauhasen duplikaatiokystien diagnostiikka endoskooppisella ultraäänitutkimuksella. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonografinen hyvänlaatuisten ja pahanlaatuisten stroomasolukasvainten erotus. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografiset piirteet, jotka ennustavat hyvän- ja pahanlaatuisia gastrointestinaalisia stroomasolukasvaimia. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Ruoansulatuskanavan stroomasolukasvainten (GIST) patologia ja diagnostiset kriteerit: A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, ym. imatinibmesylaatin teho ja turvallisuus pitkälle edenneissä maha-suolikanavan stroomakasvaimissa. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Gastrointestinaaliset stroomakasvaimet ja muut suolen mesenkymaaliset leesiot. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinaaliset stroomakasvaimet: Kirurgisesta lähestymistavasta molekulaariseen lähestymistapaan. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI:n stroomakasvaimet. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Vaurioiden mittaaminen endoskopialla: yleiskatsaus. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Ruoansulatuskanavan stroomakasvainten kliininen esitys ja leikkauskelpoisen taudin hoito. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Tutkimus ruoansulatuskanavan yläosan myogeenisistä kasvaimista endoskooppisella ultraäänitutkimuksella, erityisesti hyvän- ja pahanlaatuisten leesioiden erotusdiagnostiikkaan liittyen. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. gastrointestinaalisen stroomakasvaimen prognostinen arviointi. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Mahalaukun stroomakasvaimet. Kliinipatologinen tutkimus 77 tapauksesta ja piirteiden korrelaatio ei-aggressiivisen ja aggressiivisen kliinisen käyttäytymisen kanssa. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosal tumors and thick gastric fols. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. EUS:n tarkkuus pienten mahalaukun subepiteelileesioiden arvioinnissa. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. EUS-ohjatun FNA:n diagnostinen hyödyllisyys potilailla, joilla on mahalaukun submukoottisia kasvaimia. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskooppinen ultraääni ja endoskooppinen ultraääniohjattu ohutneula-aspiraatio pahanlaatuisten submukoottisten kasvainten diagnostiikassa. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Endoskooppisen ultraäänitutkimuksen tarkkuus ylemmän ruoansulatuskanavan submucosal leesioissa: prospektiivinen monikeskustutkimus. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, ym. endosonografiset piirteet mahalaukun ektooppisten haimatulehdusten erotettavissa mesenkymaalisista kasvaimista. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Endoskooppisen ultraäänen rooli ruokatorven ja mahalaukun submukoottisten kasvainten hoidossa. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Mahalaukun duplikaatiokystien ohutneula-aspiraatiobiopsia endoskooppisella ultraääniohjauksella. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoskooppinen limakalvoresektio mahalaukun kasvaimissa. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskooppinen limakalvoresektio. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Tutkimus ruoansulatuskanavan yläosan myogeenisistä kasvaimista endoskooppisen ultraäänitutkimuksen avulla, erityisesti hyvän- ja pahanlaatuisten leesioiden erotusdiagnostiikkaan liittyen. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Submucosaalisten ylemmän ruoansulatuskanavan vaurioiden arviointi endoskooppisella ultraäänellä. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskooppinen ultraäänitutkimus mahalaukun submukoottisen kasvaimen diagnostiikassa. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. gastrointestinaalisten ultraäänikuvien histologiset korrelaatit. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektiivinen arviointi over-the-wire katetrin US-sondista. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskooppinen ultraäänitutkimus sileän lihaksen kasvainten arvioinnissa ylemmässä ruoansulatuskanavassa: kokemus 42 tapauksesta. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoskooppinen ultraäänitutkimus. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Ruoansulatuskanavan kuvantaminen: endoskooppinen ultraääni. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Kudosnäytteenoton tuotto EUS:llä arvioiduista submucosaalisista vaurioista. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskooppinen ultraäänitutkimus alkuvaiheessa ja seurannassa potilailla, joilla on lääkkeellisesti hoidettu limakalvoon liittyvän imukudoksen matala-asteinen mahalaukun lymfooma. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Eturauhasen duplikaatiokystien diagnostiikka endoskooppisella ultraäänitutkimuksella. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonografinen hyvänlaatuisten ja pahanlaatuisten stroomasolukasvainten erotus. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografiset piirteet, jotka ennustavat hyvän- ja pahanlaatuisia gastrointestinaalisia stroomasolukasvaimia. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Ruoansulatuskanavan stroomasolukasvainten (GIST) patologia ja diagnostiset kriteerit: A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, ym. imatinibmesylaatin teho ja turvallisuus pitkälle edenneissä maha-suolikanavan stroomakasvaimissa. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Gastrointestinaaliset stroomakasvaimet ja muut suolen mesenkymaaliset leesiot. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinaaliset stroomakasvaimet: From a surgical to a molecular approach. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI:n stroomakasvaimet. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Vaurioiden mittaaminen endoskopialla: yleiskatsaus. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Ruoansulatuskanavan stroomakasvainten kliininen esitys ja leikkauskelpoisen taudin hoito. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Tutkimus ruoansulatuskanavan yläosan myogeenisistä kasvaimista endoskooppisella ultraäänitutkimuksella, erityisesti hyvän- ja pahanlaatuisten leesioiden erotusdiagnostiikkaan liittyen. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, ym. gastrointestinaalisen stroomakasvaimen prognostinen arviointi. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Mahalaukun stroomakasvaimet. Kliinipatologinen tutkimus 77 tapauksesta ja piirteiden korrelaatio ei-aggressiivisen ja aggressiivisen kliinisen käyttäytymisen kanssa. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosal tumors and thick gastric fols. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. EUS:n tarkkuus pienten mahalaukun subepiteelileesioiden arvioinnissa. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. EUS-ohjatun FNA:n diagnostinen hyödyllisyys potilailla, joilla on mahalaukun submukoottisia kasvaimia. Gastrointest Endosc 2010; 71: 913-9.