- Mikä tekee molekyylistä polaarisen?
- Katso hiilidioksidin rakennekaavaa:
- Miksi vesi on polaarista?
Vesi on polaarinen molekyyli, koska sen happi on vahvasti elektronegatiivinen ja vetää näin ollen elektroniparin itseensä päin (poispäin kahdesta vetyatomista), jolloin se saa lievästi negatiivisen varauksen.
Molekyylin polaarisuus ei riipu vain molekyylin muodostavista atomeista, vaan myös siitä, miten ne ovat järjestäytyneet keskeisen atomin ympärille eli näiden atomien avaruudellisesta järjestyksestä. Jotta ymmärtäisimme tämän paremmin, käsittelemme aihetta tarkemmin.
Mikä tekee molekyylistä polaarisen?
Molekyylin polaarisuus liittyy elektronien siirtymiseen tiettyyn suuntaan. Tämä puolestaan riippuu molekyylissä olevien sidosten poolisuudesta, sillä myös nämä sidokset sisältävät elektroneja.
Molekyylissä se atomi, jolla on suurempi voima vetää elektroneja puoleensa (ts, se on elektronegatiivisempi kuin toinen atomi) saa itselleen lievästi negatiivisen varauksen, ja näiden kahden atomin välisestä sidoksesta tulee polaarinen.
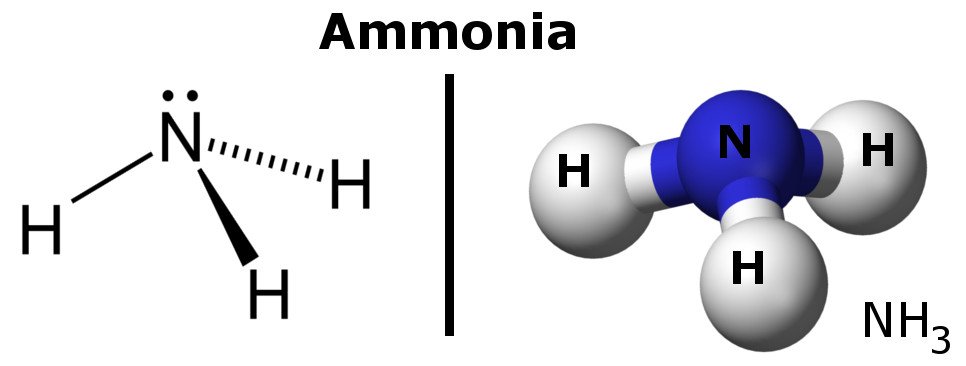
Ammoniakki on polaarinen molekyyli, koska siinä on alueita, joissa on lievästi negatiivisia ja positiivisia varauksia.
Kaiken kaikkiaan voisi sanoa, että polaarisen sidoksen elektronitiheys kasaantuu sidoksen toiseen päähän, minkä seurauksena kyseisellä päädyllä on lievästi negatiivinen varaus, kun taas toisessa päässä on lievästi positiivinen varaus. Tämä tekee molekyylistä polaarisen.
Jos molekyylissä ei ole positiivisen ja negatiivisen varauksen alueita, sitä pidetään ei-polaarisena.
Mutta mielenkiintoista on huomata, että mitä suurempi elektronegatiivisuusero on, sitä polaarisempi sidos on molekyylissä. Karbonyyliyhdisteet ovat poolisia, koska karbonyylihiili on hieman positiivinen. Eikö siis hiilidioksidin, joka sisältää positiivisen hiilen ja kaksi osittain negatiivista happea, pitäisi olla poolinen?
Hiilidioksidi koostuu kahdesta happiatomista, jotka ovat kiinnittyneet hiiliatomiin. Happiatomit ovat paljon elektronegatiivisempia kuin hiiliatomit, ja siksi niillä pitäisi olla osittain negatiivinen varaus, kun taas hiiliatomin pitäisi olla hieman positiivisesti varautunut. Mielenkiintoista kyllä, näin ei kuitenkaan tapahdu.
Katsokaa hiilidioksidin rakennekaavaa:
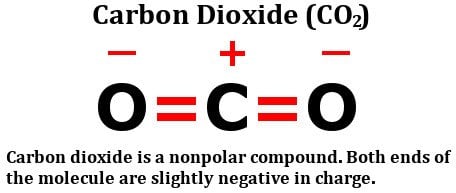
Se koostuu kahdesta yhtä elektronegatiivisesta happiatomista, kyllä, mutta katsokaa, miten nämä atomit ovat sijoittuneet hiiliatomin ympärille. Ne molemmat seisovat täydellisessä 180 asteen kulmassa hiileen nähden. Näin ollen ne vetävät elektronitiheyttä hiilestä yhtä suurella voimalla vastakkaisiin suuntiin. Lopputulos on, että hiiliatomin elektronitiheys pysyy muuttumattomana, mikä tekee hiilidioksidimolekyylistä poolittoman.
Hiilidioksidi on loistava esimerkki siitä, miten molekyylin geometria vaikuttaa ratkaisevasti siihen, onko se poolinen vai pooliton. Tarkastellaan nyt vesimolekyyliä:
Miksi vesi on poolinen?
Veden kemiallinen kaava on H20, mikä tarkoittaa, että se sisältää kaksi vetyatomia ja yhden happiatomin. Vetyatomeilla on kuoressaan vain yksi elektroni, kun taas happiatomilla on 6 valenssielektronia.
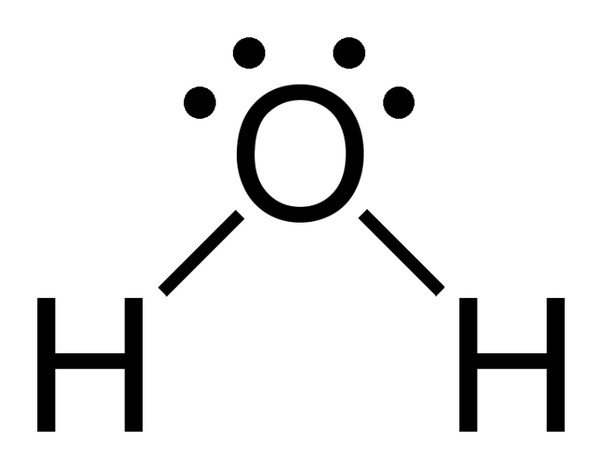
Huomaa, että veden happiatomilla on 2 yksinäistä elektroniparia.
Koska hapella on valenssikuoressaan 6 elektronia, se jakaa elektronin jokaisen vetyatomin kanssa. Näin sille jää 4 sitoutumatonta elektronia 2 orbitaaliinsa. Nämä sidotut ja sitoutumattomat elektroniparit järjestäytyvät tetraedrin muotoon hapen ympärille, minkä vuoksi kaksi sidosta näyttävät olevan taivutettuja.
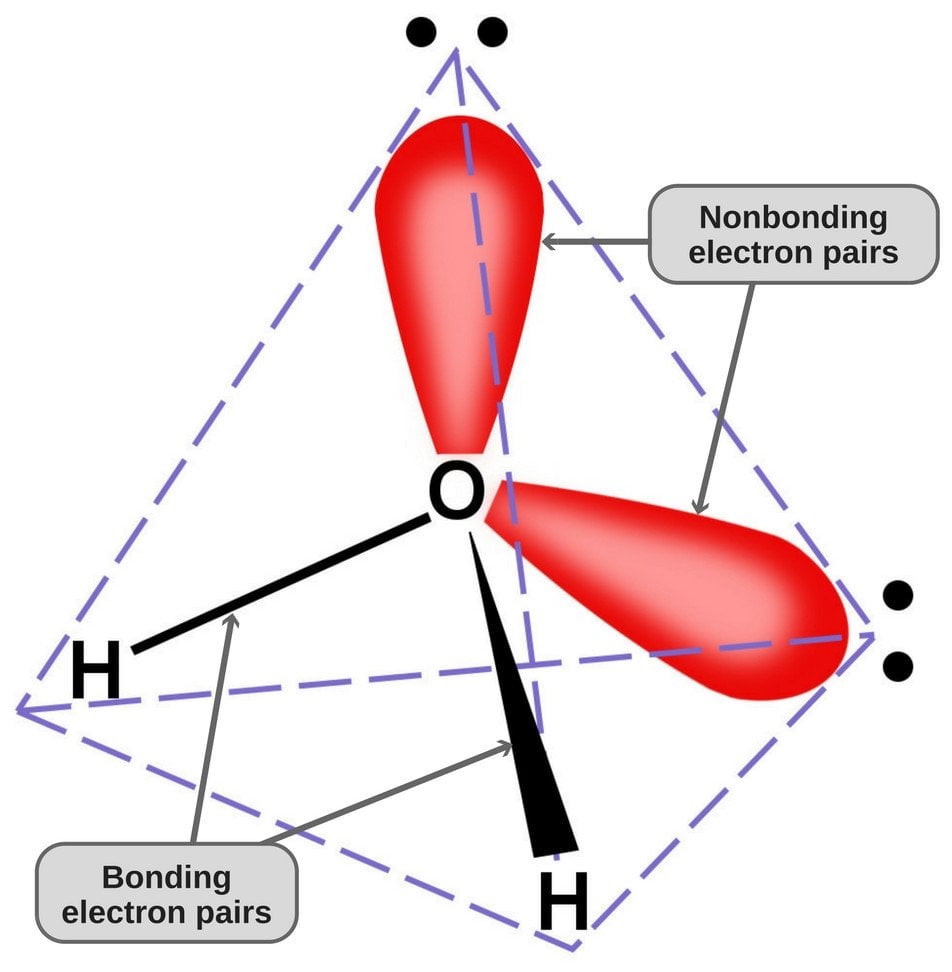
Vesimolekyylin tetraedrinen geometria.
Nyt sekä happi- että vetyatomeilla on erilaiset elektronegatiivisuudet (vedyn elektronegatiivisuusarvo on 2,1, kun taas hapen elektronegatiivisuusarvo on 3,5); siksi molemmat sidokset ovat poolisia. Koska happi on elektronegatiivisempi kuin vety, elektronitiheys siirtyy hapen suuntaan näissä molemmissa sidoksissa, jolloin hapen ympärillä oleva alue on negatiivisempi kuin kahden vetyatomin ympärillä oleva alue.
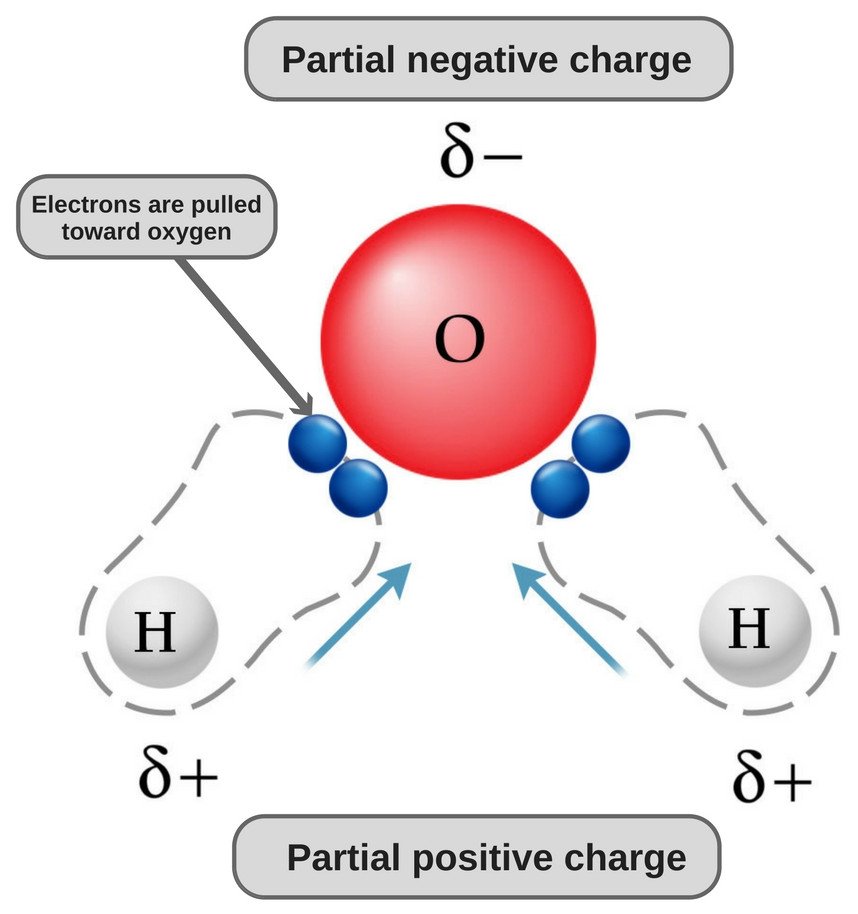
Sentähden vesimolekyylistä tulee polaarinen!