Immunofluoresenssi (IF) on yleinen morfologinen lähestymistapa, jota käytetään subcellulaaristen komponenttien jakautumisen määrittämiseen. IF-määrityksessä tarvitaan vasta-aineita, jotka on konjugoitu fluoresoivilla väriaineilla. Vasta-aine tunnistaa antigeenin spesifisesti sitoutumalla kohteen epitooppiin, ja fluorofori havaitaan fluoresoivalla mikroskoopilla. Näin ollen subcellulaariset komponentit voidaan visualisoida tummalla taustalla. IF:tä voidaan käyttää myös vaihtoehtoisena semikvantitatiivisena analyysimenetelmänä kiinnostuksen kohteen ilmentymisen seurannassa.
IF:tä on kolmea eri tyyppiä: suora IF, epäsuora IF ja yhdistetty IF.
Suorassa IF:ssä käytetään yhtä ainoaa primaarivasta-ainetta, joka on konjugoitu fluoresoivalla väriaineella.
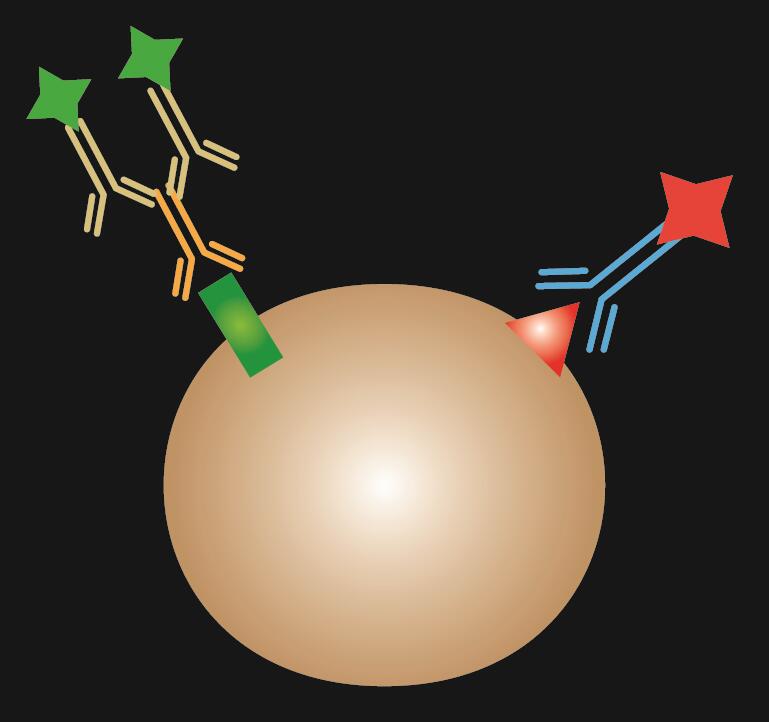
Epäsuorassa IF:ssä käytetään värjäykseen kahta vasta-ainetta: primaarivasta-ainetta, joka sitoutuu spesifisesti epitooppiin, ja sopivaa sekundaarivasta-ainetta, joka on konjugoitu fluoresenssiväriaineella.
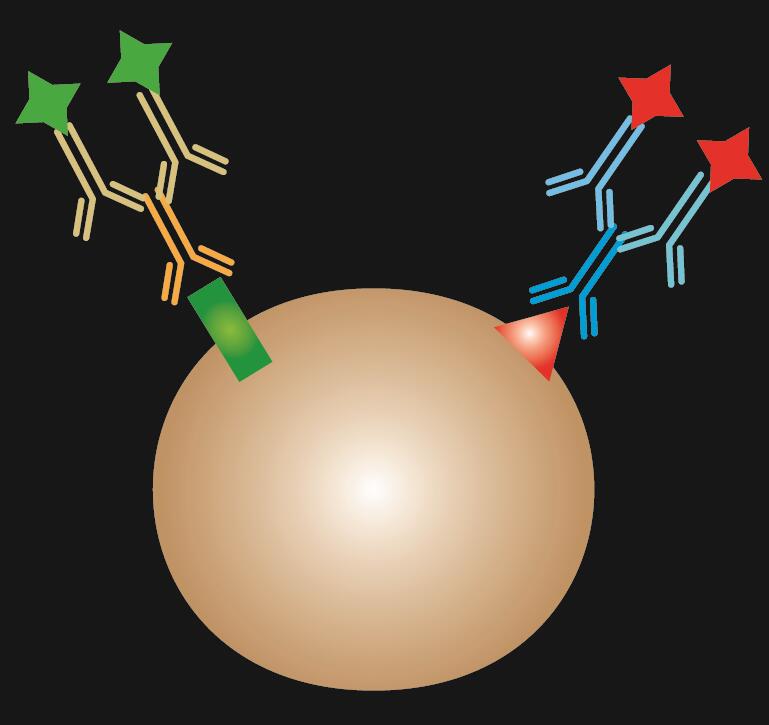
Yhdistetty IF on suoran ja epäsuoran IF-värjäyksen yhdistelmä.
Taulukko 1. IF-värjäys. Suoran, epäsuoran ja yhdistetyn IF:n vertailu.
| IF-tyyppi | Suora | Suora | Epäsuora | Yhdistetty |
|---|---|---|---|---|
| Skeemaattinen kaaviokuva | 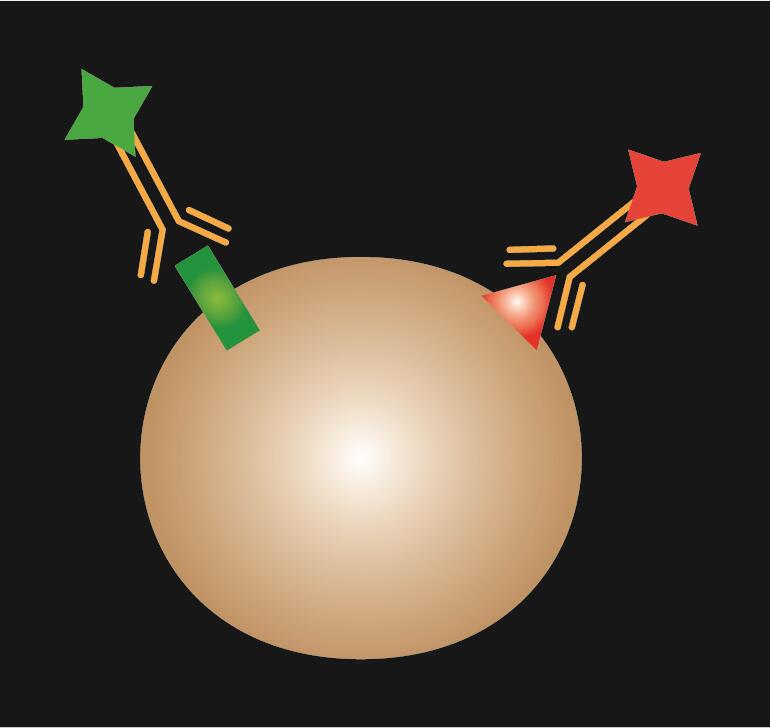 |
 |
 |
|
| Hyötyjä |
|
|
|
|
| Haitat |
|
|
|
Kolme IF-tyyppiä, epäsuora IF-menetelmä on suosituin.
IF-menetelmää voidaan käyttää kudosleikkeisiin, viljeltyihin solulinjoihin ja yksittäisiin soluihin. IF:n prosessi on samanlainen kuin immunohistokemiassa (IHC).
- Näytteiden kerääminen ja fiksaatio
Näytteet on fiksoitava nopeasti kudoksen poiston jälkeen, ja esifiksaatio on parempi suorittaa sydämen infuusiona 4 %:n formaldehydillä tai paraformaldehydillä pienillä eläimillä, kuten jyrsijöillä. On suositeltavaa, että kudokset ovat enintään 10 mm paksuja ja että fiksatiivin tilavuus on vähintään 15-20 kertaa suurempi kuin kudoksen tilavuus. Fiksointi on erittäin tärkeää solun morfologian ja rakenteen sekä antigeenin eheyden säilyttämiseksi. Näin ollen fiksointiliuokset on valittava huolellisesti eri antigeenien ja kudosnäytteiden mukaan.
Taulukko 2. Fiksointiliuokset. Osittaisten antigeenien fiksaatiostrategia.
| Antigeeni | Fiksaatioliuos | Fiksaatio-olosuhteet |
|---|---|---|
| Suurin proteiini | 95~100 %. alkoholi 4% paraformaldehydi |
3~10 min 37℃:ssa 4~24 h 4℃:ssa |
| entsyymi | Asetoni | 15 min RT:ssä |
| Hormoni | 95% alkoholia ja 1~5% jääetikkaa | 30 min 4 ℃:ssa |
| Immuuniglobuliini | 95% alkoholia Hiili tetrakloridi |
10 min 37 ℃:ssa, sitten 15 min 4 ℃:ssa |
| Fibrous protein | 95% alkoholia plus 1~5% jääetikkaa | 10 min 37 ℃:ssa, sitten 15 min 4 ℃:ssa |
| Virus | Asetoni Hiilitetrakloridi Alkoholi |
5~10 min RT:ssä, sitten 30~60 min lämpötilassa 4 ℃ |
| Polysakkaridit ja bakteerit | Asetoni 10% formaldehydi metanoli |
3~10 min RT:ssä sitten 30~60 min 4 ℃:ssa |
| Lipoidi | 10% formaldehydi | 3~10 min RT:ssä |
| Viljelty solu | Lämmitetty 4% paraformaldehydi | 15~20 min. RT:ssä |
- Dehydraatio ja upottaminen
Dehydraatiota tarvitaan kudosleikkeiden valmistuksessa seuraavista syistä:
1. Parafiinileike: Parafiini ei sekoitu veden kanssa.
2. Pakasteleikkaus: Jäädytetyt-sulatetut jääkiteet tuhoaisivat solujen morfologian.
Dehydratointi suoritetaan aina upottamalla kudos vakavasti kasvavan gradientin etanoliliuokseen tai sakkaroosiliuokseen.
Sen jälkeen kudosnäytteet voidaan upottaa lisäämällä sulaa parafiinivahaa parafiinileikkauksia varten, kun taas pakasteleikkauksia varten lisätään OCT-yhdistettä. Tällä vaiheella saadaan pehmeille kudosnäytteille sopiva kovuus ja kudos voidaan leikata helposti.
- Poikkileikkaus ja värjäys
Umputetut kudokset voidaan leikata ohuiksi viipaleiksi mikrotomilla tai pakastusmikrotomilla. Viipaleiden paksuus on päätettävä solujen läpimitan ja IF-määrityksen tarkoituksen mukaan. Ohuemmat viipaleet (≤10 μm) ehdotetaan kiinnitettäväksi suoraan liimakalvoille ennen värjäystä, koska ne on helppo taltuttaa useissa pesuvaiheissa. Paksummilla viipaleilla (10~30 μm) saadaan parempia kuvia käyttämällä vapaasti kelluvaa menetelmää, koska primaarivasta-aine voi tunkeutua viipaleen molemmille puolille. Vapaasti kelluvat leikkeet kiinnitetään objektilasille värjäyksen jälkeen. Vapaasti kelluvat leikkeet pienistä kudoksista, kuten hiiren dorsaaliganglion juuresta (DRG), ovat vaikeita toteuttaa ja näyte katoaa helposti. Näin ollen joidenkin pienten kudosnäytteiden kohdalla suositellaan stick section -menetelmää. Värjäysvaiheet olisi suoritettava pimeässä, kun kyseessä on fluoresoivalla väriaineella konjugoitu vasta-aine.
Otaudu IF-protokolliin:
- Tikkupoikkileikkaus
- Vapaasti kelluva poikkileikkaus
- Viljellyt solut
- Kuvantaminen ja analyysi
Positiivinen merkkivalo virtuaalisestikin fluoresenssimikroskoopilla pimeässä taustan ollessa. Kiinnostuksen kohteena oleva sijainti määritetään yleensä sellaisen proteiinin rinnakkaisvärjäyksellä, jonka sijainti on tiedossa. Vaihtoehtoisesti positiivisten solujen määrä tai positiivisen signaloinnin fluoresenssin intensiteetti voidaan mitata kvantitatiivista analyysia varten. Esimerkiksi voimakkaampi fluoresenssin intensiteetti viittaa kohdeproteiinin suhteellisen korkeaan ekspressioon.
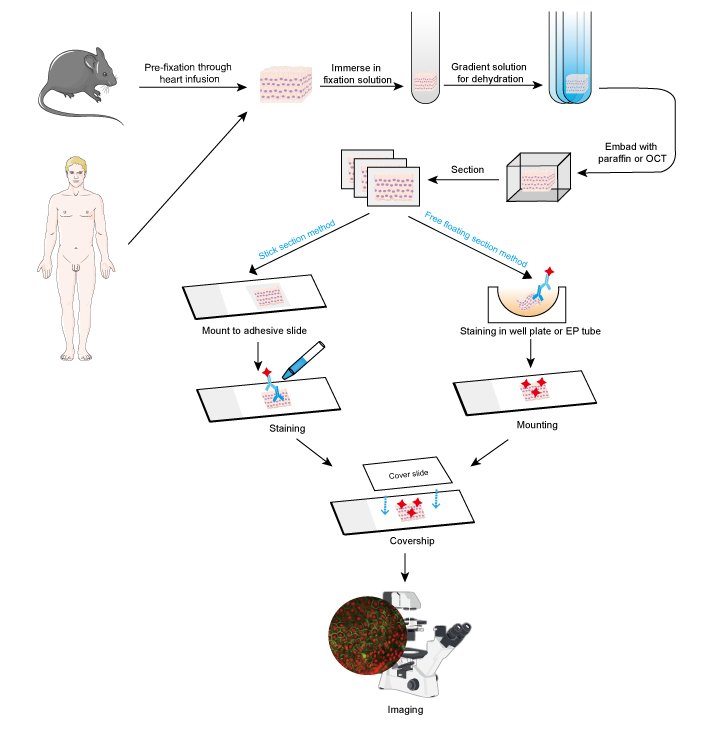
Kuva 1. Kudosleikkeiden IF:n työnkulku. IF:n työnkulku kudosleikkeissä.
IF ja IHC ovat molemmat tehokkaita lähestymistapoja morfologian analysointiin, ja niillä on tärkeitä diagnostisia ja ennusteellisia sovelluksia. Tutkimuksessa on otettava huomioon useita eroja:
Taulukko 3. IHC:n ja IF:n vertailu
| IHC | IF | ||
|---|---|---|---|
| Merkintämenetelmä | Kromogeeninen | fluoresoiva | |
| Käsittelyvaihe | Enemmän kuin substraattia tarvitaan | Vähemmän | |
| Kuva |
|
|
|
| mikroskooppi | valomikroskooppi | fluoresenssimikroskooppi | |
| kestävyys | kestävä | . vuosia | Vähemmän vakaa fotobleachingin vuoksi |
| Esimerkki (hiiren hippokampus) |
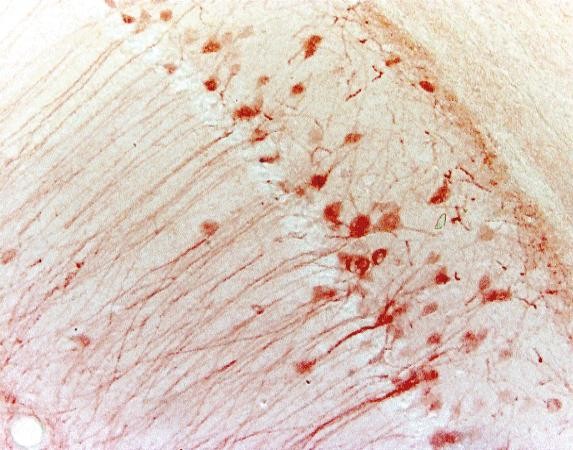 |
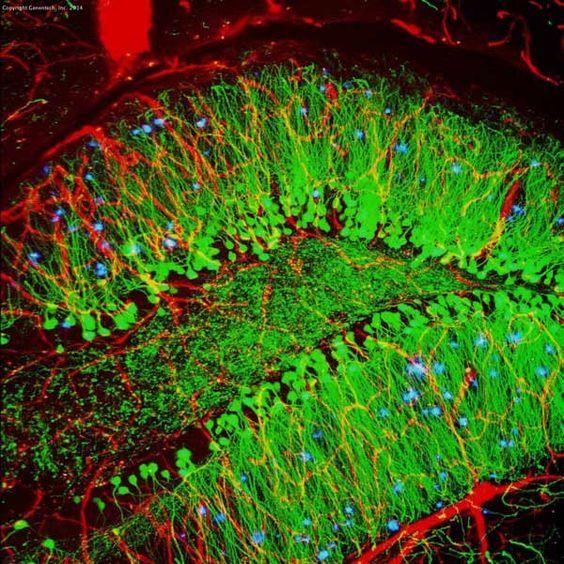 |