Perforiini/gransyymi apoptoosireitti on ensisijainen signaalireitti, jota sytotoksiset lymfosyytit käyttävät eliminoidakseen virustartunnan saaneita ja/tai muuntuneita soluja. Geenihäiriöisillä hiirillä tehdyt tutkimukset osoittavat, että perforiini yhdessä granzyymin kanssa voi indusoida apoptoosia. Se on elintärkeä sytotoksiselle efektoritoiminnalle, ja sillä on välttämätön, mutta määrittelemätön rooli granzyymivälitteisessä apoptoosissa.
Perforiini ja granzyymi
Perforiini on huokosia muodostava proteiini, ja se tunnetaan myös nimellä sytoplasmiset granulotoksiinit. Granzyymi on perhe rakenteellisesti sukua olevia seriiniproteaaseja, jotka varastoituvat sytotoksisten lymfosyyttien (CL) sytotoksisiin granuloihin. Perforiini ja granzyymi indusoivat yhdessä kohdesolujen apoptoosia (kuva 1). Grantsyymi on välttämätön kohdesolujen apoptoosin laukaisemiseksi, mutta ne ovat riippuvaisia siitä, että perforiini toimittaa ne asianmukaisesti. Sekä perforiini että granzyymi sitoutuvat kohdesolun pintaan osana yhtä makromolekyylikompleksia, joka liittyy serglysiiniin, mikä vähentää entisestään granzyymien passiivisen diffuusion todennäköisyyttä.
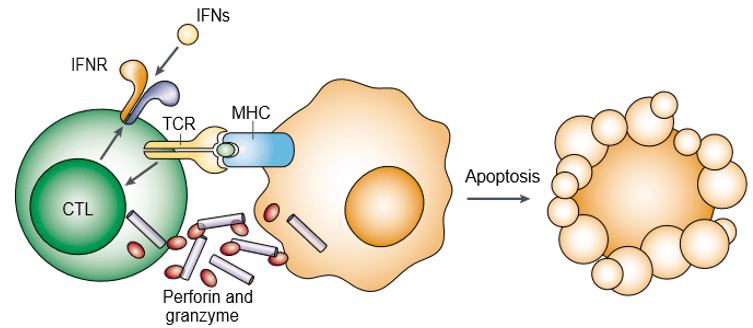
Kuvio 1. Kohdesolun apoptoosin indusointi. Perforiini ja granzyymi indusoivat kohdesolujen apoptoosia yhteistoiminnallisesti.
Ihmisillä on granzyymit A, B, H, K ja M ja hiirillä granzyymit A, B, C, D, D, E, F, G, K, L, M ja N. Granzyymi A (GrA) ja granzyymi B (GrB) ovat granzymeistä runsaimpia ja niitä on tutkittu eniten. Gransyymi A:n ja B:n tehtäviä kohdesolujen apoptoosin indusoimisessa on tutkittu laajasti in vitro, ja ne tunnetaan paremmin kuin perforiinin rooli molekyylitasolla.
Prosessi ja säätely Perforiini/Granzyme Apoptosis Pathway
Sytotoksisten lymfosyyttien erittämänä gransyymit kulkeutuvat kohdesolujen sisään, mikä on elintärkeä vaihe solukuolemassa. Tärkeimpiä lytisiä proteiineja, jotka pakataan granuloihin, ovat erilaiset granzyymit ja huokosta muodostava proteiini perforiini, joka helpottaa granzyymien sisäistämistä soluihin.
Granzyymi B laukaisee kaspaasiaktivaation pääasiassa epäsuorasti, ei niinkään suoran kaspaasiprosessoinnin kautta. Se saavuttaa tämän aktivoimalla suoraan pro-apoptoottisia ”BH3-only” BCL-2-perheen jäseniä, kuten BH3-interacting domain death agonist (Bid). Bid yhdessä pro-apoptoottisten BCL-2-perheen Bax- ja/tai Bak-proteiinien kanssa johtaa pro-apoptoottisten mitokondriaalisten välittäjäaineiden, kuten sytokromi c:n, vuotamiseen sytosoliin. Sytokromi c:n vapautuminen aktivoi pro-kaspaasi-9:n, ja sitoutumalla apoptoottiseen proteaasia aktivoivaan tekijään 1 (Apaf-1) pro-kaspaasi-9 muuttuu kypsäksi kaspaasi-9:ksi, joka jatkaa apoptosomin muodostamista ja aktivoi alempana olevan kaspaasi-3:n. Tämä aktivoi apoptosomin. Aktivoitu kaspaasi-3 pystyy pilkkomaan spesifisiä substraatteja, kuten ICAD:tä (kaspaasin aktivoiman DNaasin inhibiittori, CAD), jolloin CAD voi siirtyä tumaan pirstomaan DNA:ta. Bidin lisäksi granzyymi B voi inaktivoida Mcl-1:n, joka kuuluu anti-apoptoottiseen Bcl-2-perheeseen, ja vapauttaa pro-anti-apoptoottisen Bcl-2-perheen proteiinin Bimin mitokondrioiden ulkokalvolla. Ja granzyymi B voi myös välittää efektori kaspaasi-3:n ja initiaattori kaspaasi-8:n säätelemään apoptoosireittiä.
Kontrastina granzyymi B:hen granzyymi M ei ole riippuvainen mitokondriosta säätelemään, mutta granzyymi M voi aktivoida granzyymi B:n pilkkomalla proteinaasi-inhibiittori 9:n (PI-9), joka on granzyymi B:n estäjä. Granzyymi M voi myös suoraan pilkkoa ICAD:n vapauttaakseen CAD:n kuten granzyymi B.
Granzyymi A aiheuttaa mitokondrioiden sisäisen kalvon potentiaalin menetyksen ja reaktiivisten happilajien (ROS) vapautumisen. Se synnyttää yksijuosteisia DNA-pistoja, ei niinkään oligonukleosomaalisia DNA-fragmentteja. ROS:n vaikutuksesta ER-assosioitunut SET-kompleksi, johon kuuluvat SET, Ape1, pp32, HMG2, NM23-H1 ja TREX1, translokoituu tumaan, jossa granzyymi A pilkkoo kolme SET-kompleksin jäsentä, jotka osallistuvat DNA:n korjaamiseen: HMG2:n, Ape1:n ja SET:n.
Perforiini/Granzyymi Apoptoosireitti sairauksissa
Tutkimukset geenihäiriöisillä hiirillä osoittavat selvästi, että perforiinireitti osallistuu läheisesti puolustautumiseen viruspatogeeneja ja muuntuneita soluja vastaan. Mutta myös in vivo on osoitettu, että perforiinilla on epäilemättä keskeinen rooli spontaanisti transformoituneiden solujen immuunivalvonnan välittäjänä sekä B-solujen homeostaasin ja T-solujen muistin säätelyssä. Paradoksaalista kyllä, perforiini on keskeisessä asemassa tiettyjen autoimmuunisairauksien, kuten insuliiniriippuvaisen diabeteksen patogeneesissä ei-lihavuusdiabeetikoilla (NOD-hiirillä), mutta se saattaa tukahduttaa muita autoimmuunisairauksia, kuten kokeellista autoimmuunienkefalomyeliittiä (EAE).
Määritellään perforiini/grantiini-apoptoosireittejä, jotka säätelevät granulaarista polarisaatiota ja eksosytoosia, ja näitä reittejä saattaa häiritä syöpäsolujen vuorovaikutus joidenkin sytotoksisten lymfosyyttien kanssa. Viimeaikaiset havainnot siitä, että granzyymien pääsy kohdesoluihin edellyttää sitoutumista tiettyihin kalvoreseptoreihin ja että jotkin kasvaimet syntetisoivat seriiniproteaasi-inhibiittoreita, jotka voivat neutraloida granzyymit, ovat viitanneet mahdollisiin uusiin tapoihin, joilla kasvaimet voivat välttyä immuunipuolustuksen hyökkäykseltä.