- Abstract
- Avainsanat
- Sisällysluettelo
- Varhaiset menetelmät pigmentin valmistukseen
- Rikkihappomenetelmä
- Kloorausmenetelmä
- Raudan erottaminen
- Sähköuunimenetelmä
- Hydrometallurginen reitti
- Korkeapainemenetelmä
- Atmosfääriprosessi
- Oksyhydrolyysi
- Fluidisoidun kerroksen oksyhydrolyysi
- Suihkutuspaahtimella tapahtuva oksyhydrolyysi
- Titaanin valmistus
Abstract
Matala-asteinen ilmeniitti voidaan liuottaa väkevällä HCl:llä ilmanpaineessa ja 80oC:ssa. Kun liukenemattoman aineksen erottamiseksi tehty suodatus on suoritettu, TiO2+- ja Fe2+-pitoista liuosta kuumennetaan titaanihydroksidin saostamiseksi ja HCl:n talteenottamiseksi. Titaanihydroksidi kalsinoidaan sitten synteettiseksi rutiiliksi, joka sisältää 95+ % TiO2:ta, kun taas FeCl2 altistetaan oksyhydrolyysille tai leijupetille HCl:n ja Fe2O3:n talteenottamiseksi. Prosessia voidaan luonnollisesti soveltaa korkealaatuiseen ilmeniittiin. Se ohittaa sähköuuniprosessin, jota sovelletaan vain korkealaatuiseen ilmeniittiin, ja se on parempi kuin rikkihappoprosessi, joka on erittäin saastuttava. Tämän prosessin tuotetta voidaan käyttää valkoisen pigmentin sekä titaanimetallin valmistukseen.
Avainsanat
HCl-liuotus, Magpei-prosessi, synteettinen rutiili, oksyhydrolyysi, sähköuuni, klooraus, rikkihappoprosessi
Sisällysluettelo
Pääasialliset titaanimineraalit ovat rutiili, TiO2, ja ilmeniitti, FeTiO3 (kuvat 1 ja 2). Rutiili on helppo jalostaa titaanimetalliksi tai TiO2-pigmentiksi kloorausmenetelmällä, kun taas ilmeniitti on monimutkaisempi sen korkean rautapitoisuuden vuoksi. Koska maailman titaanivarannoista 90 % on ilmeniitin muodossa ja vain 10 % rutiilin muodossa, ilmeniitin käsittely on ilmeisesti tärkeä kysymys metallurgiassa.

Kuva 1: Museonäyte rutiilista, ~ 90 % TiO2

Kuva 2: Museonäyte ilmeniitistä, FeTiO3 (59.4 % TiO2)
Ilmeniittiesiintymät voivat olla massiivisia, kuten Quebecin provinssissa (kuva 3), tai mustaa hiekkaa (kuva 4), johon liittyy magnetiittia, monasiittia ja muita arvokkaita mineraaleja, jotka erotetaan fysikaalisilla menetelmillä (kuva 5). Ensimmäisessä magneettierotuksessa käytetään heikkoa magneettia magnetiitin erottamiseen, kun taas toisessa magneettierotuksessa käytetään suuritehoista magneettia ilmeniitin erottamiseen.

Kuva 3: Näyte massiivisesta ilmeniitistä Quebecistä

Kuva 4: Mustaa rantahiekkaa kuten Intiassa
Varhaiset menetelmät pigmentin valmistukseen
Rikkihappomenetelmä
Vuonna 1916 Niagara Fallsissa, New Yorkissa, toimiva Titaanipigmenttiyhdistys (Titanium Pigment Corporation of Niagara Falls, New York) ja norjalainen Titan Company aloittivat samanaikaisesti uuden valkoisen pigmentin kaupallisen tuotannon. Silloin pääasialliset maaleissa käytetyt valkoiset pigmentit olivat valkoinen lyijy, sinkkivalkoinen ja litoponi. Tässä menetelmässä ilmeniittiä käsiteltiin väkevällä H2SO4:llä 110-120 °C:ssa, jolloin muodostui rauta- ja titanyylisulfaatteja:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
Reaktio suoritetaan suurissa betonisäiliöissä, jotka on vuorattu haponkestävällä tiilellä (kuva 6), ja joita lämmitetään suoralla korkeapaineisen höyryn ruiskutuksella, tai mönkijämyllyssä (kuva 7) . Reaktorissa reaktion lopussa syntynyt jähmettynyt massa poistettiin reaktorista liuottamalla se veteen tai laimeaan happoon. Kun liukenematon jäännös oli poistettu suodattamalla, 120-130 g/l TiO2:ta ja 250-300 g/l FeSO4:ää sisältävä liuos väkevöitiin tyhjiössä 10 °C:ssa FeSO4-7H2O:n kiteyttämiseksi, joka sitten sentrifugoitiin. Titaanioksidi saostetaan sitten liuoksesta laimentamalla ja kylvämällä, jolloin muodostuu laimeaa H2SO4:ää hävitettäväksi (kuvat 8 ja 9). Suurin pigmentin tuottaja Salvadorissa, Brasiliassa, käyttää kuitenkin edelleen tätä tekniikkaa, koska se hävittää jätteet mereen, josta vuorovesi poistaa ne.

Kuva 5: Mustan hiekan jalostus sen arvokkaiden ainesosien talteenottamiseksi

Kuva 6: Suuret betonisäiliöt, jotka on vuorattu happoa kestävällä tiilellä
Kuva 7: Mustan hiekan jalostus: Lämmitetty möllimylly

Kuva 8: TiO2-pigmentin valmistus rikkihappoprosessilla

Kuva 9: Titaanivalkoinen, ~ 100 % TiO2
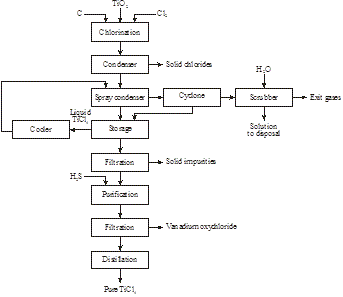
Kloorausmenetelmä
DuPont USA:ssa valmistaa pigmenttiä vuodesta 1950 lähtien klooraamalla suoraan ilmeniittimalmia, erottamalla tuotteet fraktiotislaamalla ja hapettamalla sen jälkeen TiCl4:llä (kuva 10):

Kuva 10. Titaanivalkoinen, ~ 100 % TiO2

: Yksinkertaistettu Du Pontin prosessi pigmentin valmistamiseksi ilmeniitistä
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Prosessin ongelmana on kloorin talteenotto rauta(III)kloridista tai tämän rinnakkaistuotteen suurten määrien markkinointi.
Raudan erottaminen
Laimennetun rikkihapon ja FeSO4:n hävittämiseen liittyvien pilaantumisongelmien vuoksi malmissa oleva rauta erotetaan jo varhaisessa vaiheessa. Tämä tapahtuu kahdella tavalla: sähköuunissa ja hydrometallurgisesti.
Sähköuunimenetelmä
Sähköuunimenetelmä kehitettiin 1950-luvulla . Malmi sekoitettiin tiettyyn määrään antrasiittia, joka riitti juuri ja juuri pelkistämään malmin rautaoksidikomponentin, minkä jälkeen se ladattiin 1 650 °C:n sähköuuniin, jossa rautaoksidi pelkistetään metalliseksi, kun taas titaani erotetaan kuonana (kuva 11). Pelkistyksen aikana tapahtuvat reaktiot ovat seuraavat:

Kuva 11: Raudan erottaminen sähköuunissa
FeTiO3 + C → Fe + CO + TiO2(kuona)
Fe2O3 + 3C → 2Fe + 3CO
Menetelmää käytetään Rio Tinto QIT:n tehtaalla Montrealin lähistöllä sijaitsevassa Sorelissa ja eteläafrikkalaisessa Richards Bayssa. Sitä käytetään myös Neuvostoliitossa Zaporozhjessa (Ukraina) ja Japanissa.
Titaanikuona koostuu pääasiassa rautamagnesiumtitanaatista, (Fe,Mg)Ti4O10, ja pienestä määrästä silikaatteja; tyypilliset analyysit ovat 72-85 % TiO2:n kokonaismäärästä. Pieni osa TiO2:sta pelkistyy Ti2O3:ksi. Rautaoksidien pelkistämistä ei viedä loppuun asti, joten kuonaan jää jonkin verran rautaoksidia, joka alentaa sen sulamispistettä. TiO2:n sulamispiste on 1840 °C ja ilmeniitin 1435 °C.
Kuona sisältää runsaasti titaania ja vähän rautaa (kuva 12), ja siksi se on ilmeniittiä parempi TiO2-pigmentin tai titaanimetallin valmistuksessa. Quebecissä tuotettu kuona ei kuitenkaan sovellu kloorattavaksi, koska sen epäpuhtauspitoisuus on korkea – noin 16,6 % verrattuna muiden kuonien noin 6 %:iin . Nämä epäpuhtaudet kuluttavat tarpeettomia määriä klooria ja aiheuttavat myös hävittämisongelmia. Lisäksi jotkin näistä epäpuhtauksista, esimerkiksi, kalsium ja magnesium häiritsevät itse kloorausprosessia, joka suoritetaan 800 °C:ssa muodostaen sulan faasin (CaCl2 m.p. 770 °C, MgCl2 m.p. 708 °C).

Kuva 12: Jauhettu titaanikuona, FeTi4O10 (70-80 % TiO2)
Näistä syistä titaanikuonaa käytettiin vain pigmentin valmistukseen rikkihappoprosessilla . Kuonaa käsiteltiin samalla tavalla kuin ilmeniittiä sillä poikkeuksella, että rautasulfaattia ei tarvinnut erottaa, koska suurin osa raudasta oli jo erotettu pelkistämällä aiemmassa vaiheessa (kuva 13). Kuonan rikkihappokäsittelyprosessi kärsi kuitenkin edelleen jätehapon hävittämisongelmasta, minkä vuoksi siitä luovuttiin 1980-luvulla ja se korvattiin uudella teknologialla, joka perustui kuonan jalostamiseen 94,5-prosenttiseksi TiO2:ksi liuottamalla suurin osa epäpuhtauksista pois HCl:llä paineen alaisena, jotta se soveltuisi kloorattavaksi.

Kuva 13: Titaanikuonan liuotus TiO2-pigmentin tuotantoa varten, nyt vanhentunut
Hydrometallurginen reitti
Hydrometallurginen reitti kehitettiin 1960-luvulla, ja siinä ilmeniitistä liuotettiin rautaa ja saatiin runsaasti titaania sisältävä jäännös (90-95 % TiO2:ta), jota kutsutaan nimellä ”synteettinen rutiili” . Yhdessä tapauksessa, Altair-prosessissa, saatiin pigmenttilaatuista TiO2:ta. Kaikissa näissä prosesseissa käytetään oksyhydrolyysiprosessia rautakloridin käsittelemiseksi, jolloin saadaan kierrätettävää HCl:ää ja sivutuotteena Fe2O3:a.
Korkeapainemenetelmä
Tässä menetelmässä korkealaatuinen ilmeniitti hajotetaan autoklaavissa 20-prosenttisella HCl:llä 120 °C:n lämpötilassa ja 200 kPa:n paineessa; rauta liukenee rautakloridiksi, jolloin jäljelle jää kiinteä aine, joka sisältää noin 95 % TiO2:ta, jonka kemiallinen analyysi vastaa rutiilia, minkä vuoksi sitä kutsutaan synteettiseksi rutiiliksi (kuva 14):

Kuva 14: Synteettinen rutiili
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Matalaluokkaista ilmeniittiä ei voida käsitellä tällä menetelmällä, koska kaikki silikaatit ja liukenemattomat aineet saastuttavat tuotteen. Synteettinen rutiili käsitellään sitten kloorilla TiCl4:n valmistamiseksi, josta saadaan TiO2:ta tai titaanimetallia ilman saastumisongelmia. Prosessia käytetään Yhdysvalloissa, Englannissa, Japanissa, Taiwanissa ja Australiassa. Hapetushydrolyysi voitaisiin toteuttaa monella eri tavalla, kuten alla on kuvattu.
Atmosfääriprosessi
Kanadalaisen Magpie Incorporationin toimesta todettiin vuonna 2014, että heikkolaatuinen ilmeniitti voidaan liuottaa 80 °C:ssa väkevällä HCl:llä ilmakehän paineessa. Kun liukenematon aines on suodatettu, liuos tislataan HCl:n talteenottamiseksi ja titanyyli-ionin hydrolysoimiseksi TiO2:ksi. Suodatuksen jälkeen jäännös kalsinoidaan synteettisen rutiilin valmistamiseksi (kuva 16):

Kuva 15. Synteettisen rutiilin valmistus ilmeniitistä

Kuva 16. Synteettisen rutiilin valmistus ilmeniitistä: 98+ %:n TiO2:n tuotanto heikkolaatuisesta ilmeniitistä
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
On ilmeistä, että uusi liuotustekniikka huoneenpaineessa on ylivoimainen vanhaan sähköuunisulatus-autoklaaviin perustuvaan jalostukseen verrattuna.
Oksyhydrolyysi
Rautakloridiliuos regeneroidaan HCl:ksi ja Fe2O3:ksi oksyhydrolyysillä:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Samoin kuin suolakurkkuliuoksen käsittelyssä. Käytetään kahta menetelmää
Fluidisoidun kerroksen oksyhydrolyysi
Fluidisoidun kerroksen reaktorissa rautakloridiliuos johdetaan kuuman rautaoksidin suureen kerrokseen, jossa kuuman fluidisoivan polttokaasun lämmitys tapahtuu (kuva 17). Kun palamiskaasu virtaa hyvin sekoitetun oksidipedin läpi, se saavuttaa nopeasti termisen tasapainon pedin kanssa. Liuos syötetään oksidipedin päälle. Nestemäinen syöttö kostuttaa kuumien oksidihiukkasten ulkokerroksen ja haihtuu nopeasti muodostaen sipulinmuotoisen kerroksen uutta kiinteää oksidia olemassa olevan oksidin päälle, jolloin syntyy tiiviitä homogeenisia hiukkasia.

Kuva 17: Leijukerrosreaktori rautakloridin oksyhydrolyysiä varten
Suihkutuspaahtimella tapahtuva oksyhydrolyysi
Tässä oksyhydrolyysipaahtimessa rautakloridiliuos ruiskutetaan tyhjään sylinterimäiseen astiaan, kun taas tarvittava energia saadaan pohjapolttimissa syntyneiden kuumien kaasujen nousevasta virrasta (kuva 18). Suihkutuspaahtimilla on suuri halkaisija, jotta kaasun nopeudet pysyvät alhaisina. Jos kaasun nopeus on suuri, poistokaasun mukana kulkeutuu liikaa hiukkasia, jolloin tuotteen laatu ja paahtimen tehokkuus heikkenevät. Poistokaasu ja oksidit poistuvat paahtimesta vastavirtaan noin 400-500 °C:n lämpötilassa. Ruiskutettujen hiukkasten viipymäaika korkean lämpötilan reaktiovyöhykkeellä on hyvin lyhyt, joten sumuttamalla olisi luotava hyvin pieniä nestepisaroita, jotka voidaan nopeasti lämmittää. Nopea lämpeneminen johtaa kiinteän oksidikuoren muodostumiseen kunkin pisaran pinnalle. Kun pisaran pääosa kuumenee, vesisisältö höyrystyy ja murtautuu oksidikuoren läpi. Näin ollen ruiskupoltettu oksidi koostuu hyvin hienoista ”pörröisistä”, onttoista palloista.

Kuva 18: HCl:n regenerointi rautakloridiliuoksesta oksyhydrolyysillä suihkutuspaahtimessa
Titaanin valmistus
Metallipitoista titaania valmistetaan kloroimalla rutiilista, synteettisestä rutiilista tai titaanikuonasta ja pelkistämällä sen jälkeen TiCl4:n metallotermisessä reaktorissa magnesiumilla titaaniksi (kuvat 19 ja 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
Kuva 19: TiCl4:n valmistus rutiilista, synteettisestä rutiilista tai titaanikuonasta

Kuva 20. Rutiilin, synteettisen rutiilin tai titaanikuonan valmistus: Titaanin valmistus TiCl4:stä
TiCl4 + Mg → Ti + MgCl2
TiCl4 + Mg → Ti + MgCl2
Magnesiumkloridi elektrolysoidaan sen jälkeen magnesiumin ja kloorin saamiseksi takaisin kierrätystä varten. Kuvassa 21 näkyy uunista pelkistyksen jälkeen poistettu metalloterminen reaktori, josta titaanisieni otetaan talteen (kuva 22).

Kuva 21: Metalloterminen reaktori poistetaan uunista

Kuva 22: Titaanisieni (ylhäällä) ja MgCl2 (alhaalla) poistetaan reaktorista
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) ”Titanium”, s. 1129-1179 teoksessa Handbook of Extractive Metallurgy (käsikirja kaivannaismetallurgiasta), toimittanut F. Habashi, julkaissut WILEY-VCH, Weinheim, Saksa.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Kanada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Kanada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reprinted in Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. Titaanimalmien käsittely pigmentin ja metallin tuotantoa varten. Arab Min J 11: 74-84