Sisältö
- 1 Johdanto
- 2 Rakenteelliset kohokohdat
- 3 Toiminta
- 4 Merkitys ihmisen terveydelle & Sairaudet
- 5 Ulkoiset linkit
Johdanto
Human gastric lipase (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) on lipaasi, joka vastaa ravintorasvojen ruoansulatuksen aloittamisesta mahalaukussa . Tämä happostabiili entsyymi erittyy ihmisen mahalaukun päärakkulasoluista, ja se katalysoi 10-20 % kaikista lipolyyttisistä prosesseista (eli prosesseista, joihin liittyy rasvan hajoaminen) terveillä aikuisilla . HGL katalysoi spesifisesti triasyyliglyserolin hydrolyysiä diasyyliglyserolin ja karboksylaattisivutuotteen tuottamiseksi, mikä helpottaa myöhempää rasvan hajoamista haiman lipaasin avulla. Sairausvaikutusten osalta on näyttöä siitä, että HGL:n eritys on muuttunut henkilöillä, joilla on gastriitti (yleisin mahalaukun sairaus, jossa mahalaukun limakalvo on tulehtunut) . Lisäksi henkilöt, joilla haiman toiminta on heikentynyt (ja siten haiman lipaasitasot ovat alentuneet), ovat voimakkaasti riippuvaisia HGL:stä sulattaakseen ravintorasvoja .
Rakenteelliset kohokohdat
HGL, kahdesta 379 aminohappojäännöksen pituisesta alayksiköstä koostuva hydrolaasientsyymi, jolla on a, joka sisältää jäännökset Ser-153, His-353 ja Asp-324. Tämä rakenne on välttämätön lipidien hajottamisen kannalta, ja se on koordinoitu Leu-67:ssä ja Gln-154:ssä olevan a:n kanssa, joka vakauttaa siirtymätilaa. Rakenteellisesti ihmisen mahalaukun lipaasi on kompleksi (beetalevyt esitetty keltaisella, alfahelikit oranssilla, kierteet vihreällä ja erotetut hiilihydraatit violetilla). HGL:n jäännökset 215-244 antavat tilaa (hydrofobisille alueille, jotka on merkitty punaisella) sekä aktiivisen alueen ympärillä että kannen rajapinnassa. Näiden alueiden uskotaan vetävän puoleensa lipidejä ja edistävän telakoitumista .
Toiminta
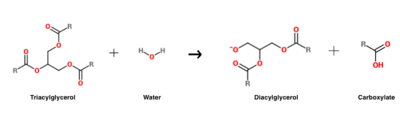
HGL:n katalysoima triasyyliglyserolin hydrolyysireaktio .
HGL toimii optimaalisessa pH:ssa, joka on noin viisi, ja se katalysoi ensisijaisesti lyhytketjuisten triasyyliglyserolien hydrolyysiä .
Esteraasina, jossa on katalyyttisesti aktiivinen seriini, HGL:llä on mekanismi, joka muistuttaa vakiintunutta seriiniesteraasimekanismia. Aktiivisen alueen seriini, joka sijaitsee , helpottaa ensin Asp-136:n ja His-152:n välisen suolasillan muodostumista vierekkäin, mikä saa aikaan protonin ottamisen Ser-153:sta. Nyt erittäin nukleofiilinen Ser-153 hyökkää triasyyliglyserolimolekyylin asetaattiryhmän karbonyylihiileen. Oksianionireikä vakauttaa tetraedrisen lajin. Kuitenkin heti, kun laji hajoaa kovalenttisesti sitoutuneiksi asetaatiksi ja lipaasiksi, seriini käy läpi deasyylaation, jossa vesi toimii nukleofiilinä. Tämä viimeinen vaihe palauttaa Ser-153:n protonoituun tilaansa.
Merkitys ihmisen terveydelle & Sairaudet
HGL:n hydrolyyttinen toiminta on jokseenkin toissijaista terveillä aikuisilla, joilla HGL moduloi korkeintaan 10-20 % ravinnon rasvan hajoamisesta . HGL:n läsnäolo on kuitenkin ratkaisevan tärkeää ennenaikaisilla lapsilla, joilla on usein heikko haiman toiminta, sekä aikuisilla, joilla on patologinen haiman vajaatoiminta (esim. krooninen haimatulehdus) . Nämä henkilöt eivät pysty tuottamaan riittäviä määriä haiman lipaasia, joten heidän on turvauduttava ensisijaisesti HGL:ään ravintorasvojen pilkkomisessa . Näillä henkilöillä HGL vastaa 30-60 % ravinnon triglyseridien hydrolyysistä .
Tomasik ym. (2013) tutkivat HGL:n erityksen hormonaalista säätelyä lapsilla ja nuorilla, joilla on gastriitti. HGL:n aktiivisuutta verrattiin kolmessa ryhmässä: yhdessä koeryhmässä, joka koostui nuorista, joilla oli diagnosoitu Helicobacter pylori -gastriitti (n = 10), toisessa koeryhmässä, joka koostui nuorista, joilla oli muu kuin Helicobacter pylori -indusoima gastriitin muoto (n = 10), ja yhdessä kontrolliryhmässä, joka koostui terveistä nuorista (n = 14). HGL:n aktiivisuutta sekä glukagonin kaltaisen peptidi-1:n, kolekystokiniinin ja glukoosiriippuvaisen insulinotrooppisen peptidin pitoisuuksia plasmassa tarkkailtiin analysoimalla mahalaukun mehunäytteitä, jotka oli kerätty endoskooppisilla mittauksilla jokaiselta potilaalta.
Potilailla, joiden pinnallisen gastriitin olivat aiheuttaneet muut patogeenit kuin H. pylori, oli alhaisempi HGL-aktiivisuus verrattuna sekä terveisiin nuoriin (p < .005) että niihin, joilla oli diagnosoitu H. pylori -gastriitti (p < .005). Glukoosiriippuvaisen insulinotrooppisen peptidin keskimääräiset pitoisuudet plasmassa olivat alhaisemmat terveillä (p < 0,005) kuin niillä, joilla ei ollut H. pylori -gastriittia (p < 0,003) ja niillä, joilla oli H. pylori -gastriitti (p < 0,01). Glukagonin kaltaisen peptidi-1:n (GLP-1) ja kolekystokiniinin (CCK) aiheuttaman HGL-erityksen säätelyn todettiin näin ollen muuttuneen nuorilla, joilla on gastriitti; tämän havainnon tueksi on olemassa olevassa kirjallisuudessa ehdotettu, että GLP-1 ja CCK estävät HGL-eritystä . Lisäksi glukoosiriippuvaisen insulinotrooppisen peptidin todettiin olevan voimakas ihmisen mahalaukun lipaasiaktiivisuuden aktivaattori kaikissa koe- ja kontrolliryhmissä .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG
.