Oikein vastaus on: C. 18F-FDG PET/CT
Keskusteltuamme sydäntiimin kanssa päätimme tehdä ydinkuvantamistutkimuksen selvittääksemme, oliko aortan juuressa absessi. Hätätilanteessa tehdyssä fludeoksiglukoosi F 18 (18F-FDG) -positroniemissiotomografiassa/tietokonetomografiassa (PET/CT) havaittiin aortan juuren kalkkeutumien vieressä voimakas 18F-FDG:n hyväksikäytön keskittymä, jossa tulehdus oli laajentunut aortan juuren oikeaan etuosaan. Nämä löydökset olivat sopusoinnussa fokaalisen aorttiitin kanssa. Lisäksi todettiin perikardiaalinen effuusio, jonka tiheys oli sekoittunut ja jota ympäröi lievä 18F-FDG:n hyväksikäyttö, mikä edustaa effuusion proteiinipitoista/verenvuotokomponenttia ja meneillään olevaa perikardiittia (kuva 1).
Kuva 1
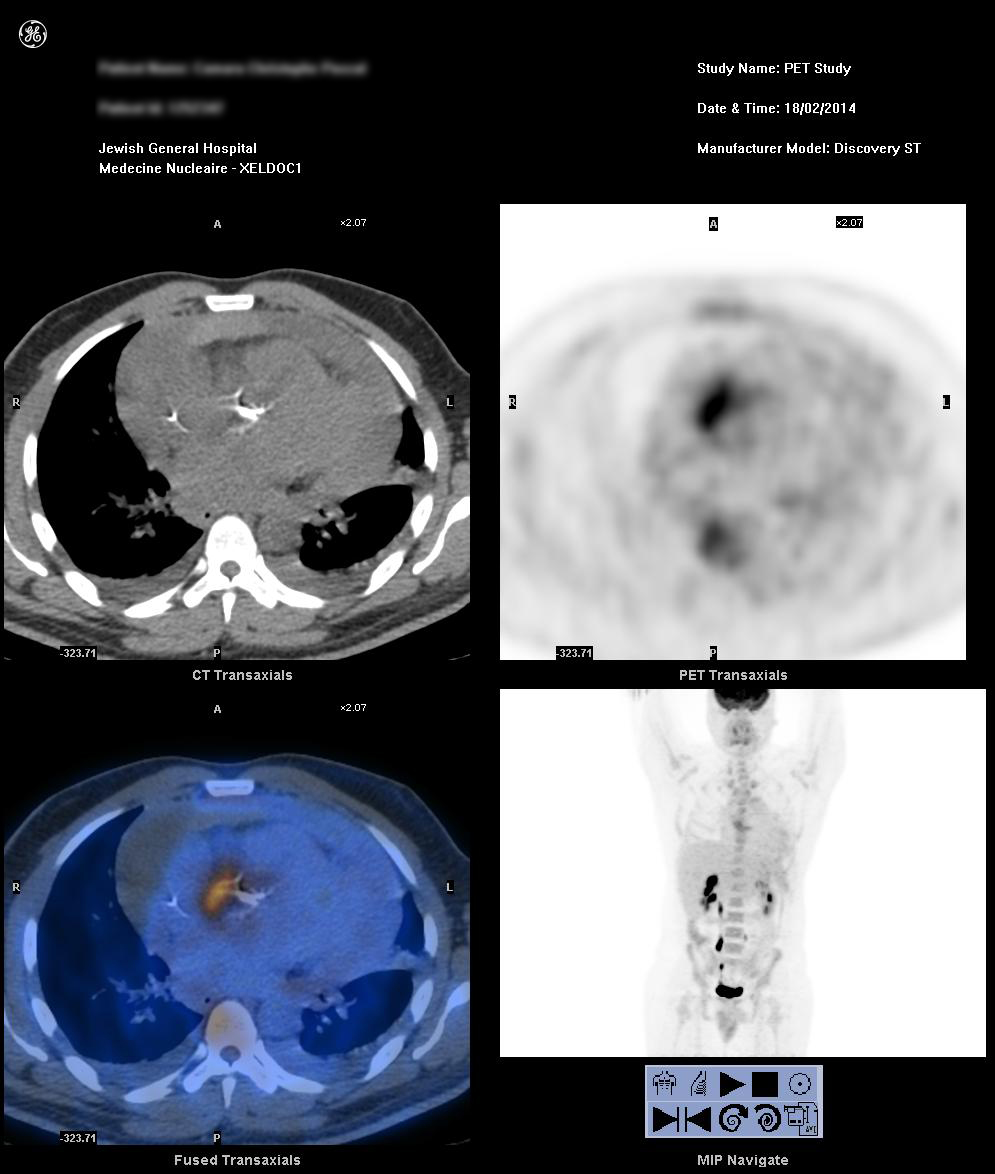
Potilaallamme diagnosoitiin sittemmin akuutti aorttaläppäendokardiitti natiivilla aorttaläpällä, jota mutkisti sekä aortan juuren absessi että suljettu aortan juuren repeämä, mikä johti verenvuotoon johtavaan sydänpussitulehdukseen. Etupuolella sijainnut paise varjosti takautuvasti TEE:ssä voimakkaasti kalkkeutunutta aorttaläppää.
Potilas lähetettiin kiireellisesti leikkaussaliin, jossa kirurgit havaitsivat jännittyneen sydänpussin, jossa oli verta, hemoperikardiumia ja runsaasti verihyytymiä oikean kammion etupuolella. He havaitsivat myös verenvuotoa aiheuttavan sydänpussitulehduksen ja infektoituneen aortan juuren erityisesti oikean sepelvaltimon sinuksen ja ei-sepelvaltimon sinuksen yläpuolella. Vaikka aortan juuren ulkosivulla ei ollut avointa märkää, he havaitsivat alueen, jossa oli repeämä ja seinämäinen paise. Lopuksi aorttaläpän todettiin olevan voimakkaasti kalkkeutunut, mikä oli todennäköisesti reumaattinen sairaus, jonka päällä havaittiin kasvustoja.
IE:n perivalvulaaristen laajentumien esiintyminen liittyy huonoon ennusteeseen. Näitä komplikaatioita ovat muun muassa paiseiden muodostuminen, pseudoaneurysma ja fistelit.1 Koska aortan juuren paise on kiireellinen leikkausindikaatio, sen nopea ja tarkka diagnosointi on pakollista, kun pyritään vähentämään perioperatiivista sairastuvuutta ja kuolleisuutta.2
TEE:llä, jonka kuvanlaatu on parantunut ja joka on yhdessä korkeamman taajuuden antureiden kanssa lähellä kyseisiä eri rakenteita, voidaan saavuttaa yksityiskohtaisempi spatiaalinen ja temporaalinen erottelukyky, jonka avulla voidaan havaita venttiilivartalon kasvustot ja niihin liittyvät komplikaatiot.3 Lisäksi TEE:n, jonka herkkyys on 90 %, katsotaan olevan parempi diagnostinen kuvantamismenetelmä kuin TTE:n (herkkyys noin 50 %), kun komplisoituneessa aorttaläppäendokardiitissa diagnosoidaan paiseet.4,5,5. Tämän vuoksi Euroopan kardiologiyhdistys (ESC) suosittelee TEE:tä, jos TTE on laadultaan huono, jos kyseessä on tekoläppä tai jos epäillään tämän infektioprosessin aiheuttamaa komplikaatiota.
Aortan juuren etupuolen abskessit ovat perinteisesti olleet vaikeampia diagnosoida. Se näkyy paremmin pitkittäistasossa ja vaatii monitasokuvantamista, jotta sen esiintyminen voidaan tunnistaa.2 Lisäksi kalkkeutumien esiintyminen haittaa ultraääniaaltojen kulkua TEE:ssä ja on ilmeinen rajoitus kalkkeutuneen aorttaläpän arvioinnissa.6 Näin ollen tapauksessamme pyrittiin käyttämään vaihtoehtoisia kuvantamismenetelmiä epäillyn infektoituneen endokardiitin diagnoosin selvittämiseksi.
ESC:n endokardiitin diagnosointia ja hoitoa koskevien ohjeiden edellisessä versiossa suositeltiin toistuvaa TEE:tä 7-10 päivän kuluessa esittelystä, kun alkuperäinen kuvantaminen on negatiivinen, mutta kliininen epäilys IE:stä on edelleen olemassa.1,7-10 Viimeaikaiset tutkimukset ovat kuitenkin osoittaneet PET/CT:n diagnostisen lisäarvon sydänläppien ja -teknologian laitteiden ja tekoläppien infektioissa, jolloin diagnoosi on usein vaikea. Saby ja muut havaitsivat, että PET/CT:n herkkyys oli 73 prosenttia ja spesifisyys 80 prosenttia proteesiläppäendokardiitin osalta. Kun PET/CT-tulokset yhdistettiin perinteisiin Duken kriteereihin, herkkyys nousi 70 prosentista 97 prosenttiin ja spesifisyys 52 prosentista 91 prosenttiin IE:n diagnosoinnissa1,10 . Lisäksi PET/CT:n sisällyttäminen muutettuihin Duken kriteereihin mahdollisti varhaisemman diagnoosin erityisesti silloin, kun kaikukardiografia oli normaali tai epäilyttävä, ja mikä vielä tärkeämpää, ennen kuin infektiovaurio tai haittatapahtuma oli ilmennyt.10 Näin ollen ESC:n endokardiitin diagnosointia ja hoitoa koskevien ohjeiden viimeisimpään versioon on sisällytetty 18F-FDG-PET/CT:n käyttö diagnoosin epävarmuustilanteissa. Me ryhmänä ekstrapoloimme näistä tiedoista, että voimakkaan kalkkeutumisen yhteydessä PET/CT:n avulla voisimme vahvistaa epäilymme natiiviläpän endokardiitin tapauksessa.
Johtopäätös
TEE, erityisesti mitraaliläpän endokardiitin tapauksessa, on selvästi parempi kuin TTE IE:n ja siihen liittyvien komplikaatioiden diagnosoinnissa ja arvioinnissa. Aorttaläpän endokardiitti sen sijaan voi joskus osoittautua diagnostiseksi haasteeksi erityisesti arvioitaessa aortan etuosan juurta abskessin esiintymisen varalta. Tällaisissa tilanteissa TTE ja TEE täydentävät toisiaan lopullisen diagnoosin tekemisessä. Tätä diagnostista haastetta voi korostaa, kuten tässä tapauksessa, proteesin tai voimakkaan kalkkeutumisen esiintyminen. Näissä tilanteissa olisi käytettävä vaihtoehtoisia kuvantamismenetelmiä. PET-CT voi mahdollistaa varhaisemman lopullisen diagnoosin ja estää vakavien komplikaatioiden etenemisen, kun epäillään periaortan abskessia.
- Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36:3075-128.
- Leung DY, Cranney GB, Hopkins AP, Walsh WF. Transoesofageaalisen kaikukardiografian rooli aortan juuren abskessin diagnostiikassa ja hoidossa. Br Heart J 1994;72:175-81.
- Karalis DG, Bansal RC, Hauck AJ, et al. Transesofageaalinen kaikukardiografinen subaortan komplikaatioiden tunnistaminen aorttaläppäendokardiitissa. Kliiniset ja kirurgiset vaikutukset. Circulation 1992;86:353-62.
- Habib G, Badano L, Tribouilloy C, et al. Recommendations for the practice of echocardiography in infective endocarditis. Eur J Echocardiogr 2010;11:202-19.
- Daniel WG, Mügge A, Martin RP, et al. Improvement in the diagnosis of abscesses associated with endocarditis by transesophageal echocardiography. N Engl J Med 1991;324:795-800.
- Iung B, Rouzet F, Brochet E, Duval X. Cardiac Imaging of Infective Endocarditis, Echo and Beyond. Curr Infect Dis Rep 2017;19:8.
- Habib G, Hoen B, Tornos P, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). European Society of Clinical Microbiology and Infectious Diseases (ESCMID) ja International Society of Chemotherapy (ISC) for Infection and Cancer hyväksyneet. Eur Heart J 2009;30:2369-413.
- Pérez-Vázquez A, Fariñas MC, García-Palomo JD, Bernal JM, Revuelta JM, González-Macías J. Evaluation of the Duke criteria in 93 episodes of prosthetic valve endocarditis: could sensitivity be improved? Arch Intern Med 2000;160:1185-91.
- Roque A, Pizzi MN, Cuéllar-Calàbria H, Aguadé-Bruix S. 18F-FDG-PET/CT Angiography for the Diagnosis of Infective Endocarditis. Curr Cardiol Rep 2017;19:15.
- Saby L, Laas O, Habib G, et al. Positroniemissiotomografia/tietokonetomografia proteettisen läpän endokardiitin diagnostiikassa: lisääntynyt läpän 18F-fluorodekyylioksiglukoosin uptake uutena pääkriteerinä. J Am Coll Cardiol 2013;61:2374-82.