Molekyylin Lewis-rakenteen tunteminen on tärkeää sen fysikaalisten ominaisuuksien, hybridisaation ja molekyylin muodon ymmärtämiseksi. Tänään käymme läpi I3- eli myös triodidi-ioniksi kutsutun I3-ionin Lewis-rakenteen, koska sillä on negatiivinen varaus. Tässä molekyylissä on kolme jodimolekyyliä, ja siksi yhdisteen nimi on triodidi. Ymmärtääksemme molekyylin Lewis-rakennetta meidän tulisi tuntea jodimolekyylin valenssielektronit.
Lewis-rakenne
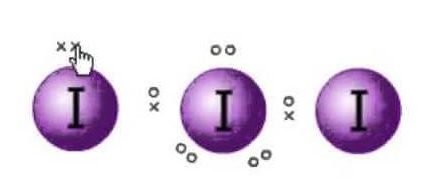
Lewis-rakenne on molekyylien elektronien esitys. Siinä on yksinäisiä pareja ja valenssielektroneita, jotka auttavat määrittämään molekyylin hybridisaation ja muodon. Koska jodimolekyylejä on, yksi jodimolekyyli on keskellä. Lisäksi jodi kuuluu jaksollisen järjestelmän seitsemänteen ryhmään ja sillä on seitsemän valenssielektronia ulkoradallaan.

Meillä on tässä kolme jodimolekyyliä, joilla on yhdessä ylimääräinen elektroni, joka antaa sille negatiivisen varauksen. Valenssielektronien kokonaismäärä on siis : 7×3 + 1= 22.
Tässä molekyylissä on yhteensä 22 valenssielektronia. Nyt on olemassa oktettisääntö, jota jokainen atomi noudattaa. Tämän säännön mukaan jokaisella atomilla pitäisi olla kahdeksan elektronia ulkoradallaan. Jos keskeisen atomin ulkokuoressa on 8 elektronia, kahden muun atomin on täydennettävä oktettinsa. Koska kaikki atomit tarvitsevat kahdeksan elektronia ulkokuoreensa täydentääkseen oktetin, yksi keskimmäisen jodiatomin elektroni menee molempien viereisten jodiatomien käyttöön. Se tarkoittaa 8-1-1=6.
Koska molemmat atomit ottavat elektronit.
Siten jodin keskeisen atomin valenssielektroneita on nyt kuusi. Nämä kuusi elektronia muodostavat yksinäiset elektroniparit, jotka eivät sitoudu. Koska se muodostaa nyt elektroniparin, on kolme yksinäistä elektroniparia ja kaksi sidosparia, koska kullakin jodiatomilla on sidos keskusatomin kanssa, joka jakaa yhden elektronin kumpikin yhteensä on 3 yksinäistä elektroniparia ja 2 sidosparia keskusatomilla.
Hybridisaatio
Minkä tahansa molekyylin hybridisaation tietämiseen voidaan käyttää yksinkertaista kaavaa. Tätä kaavaa käytetään hybridisaatioluvun selvittämiseen, joka auttaa tietämään molekyylin hybridisaation.
Hybridisaatioluvut ja sen määrittelemä hybridisaatio ilmoitetaan seuraavasti:
- 2: sp-hybridisaatio
- 3: sp2-hybridisaatio
- 4: sp3-hybridisaatio
- 5: hybridisaatio
Luvun selvittämisen kaava on,
Hybridisaation numero: Valenssielektronin määrä + monovalentti + (negatiivinen varaus) – (positiivinen varaus)/2
Jodiatomien valenssielektronit ovat 7, koska uloimmassa kuoressa on seitsemän elektronia. Monovalenttisen atomin määrä on kaksi, koska kaksi kolmesta jodiatomista on monovalenttisia. Nyt kun tulemme I3-ionin varaukseen, sillä on negatiivinen varaus, joten tämän negatiivisen varauksen arvo on 1.
Sijoitetaan nyt kaikki arvot kaavan mukaisesti,
7+1+2/2
=10/2
=5
Siten hybridisaatioluku on 5, mikä tarkoittaa, että sen hybridisaatio on sp3d.
Toinen tapa löytää tietyn molekyylin hybridisaatio on yksinäisten parien ja valenssielektronien avulla. Tässä molekyylissä yksinäisten parien määrä on 3 ja valenssielektronien jakavien atomien määrä on 2.
Siten 3+2=5, mikä määrittää myös sp3d-hybridisaation.
I3-ionin muoto

Molekyylin I3- muoto on lineaarinen. Jodiatomeja on kolme, joista yhdellä on ylimääräinen negatiivinen varaus. Tämän yhden ylimääräisen elektronin vuoksi siinä on 3 yksinäistä elektroniparia ja 2 sidosparia, joten sen steriililuku on 5. Koska keskeisellä jodidiatomilla on kolme yksinäistä paria, nämä parit pyrkivät hylkimään toisiaan mahdollisimman paljon. Jotta parit olisivat kauempana toisistaan, ne asettuvat päiväntasaajan asentoon, ja kaksi muuta jodiatomia ovat 180 asteen etäisyydellä toisistaan. Näin ollen I3-ionin kokonaismuoto on lineaarinen.
Polariteetti
Tässä on siis tämän ionin hankala puoli, ensinnäkin koska sillä on varaus, voimme kutsua sitä moniatomiseksi ioniksi sen sijaan, että kutsuisimme sitä molekyyliksi. Ionit ovat varauksia, joita näemme molekyyleissä. Koska I3-:llä on yksi elektroni, tällä ionilla on kokonaisuudessaan negatiivinen varaus. Molekyyleillä on polariteetti, koska niillä on molemmat varaukset eli osittain positiivisesti varautunut pää ja osittain negatiivisesti varautunut pää. Molekyyleissä on dipolimomentti, joka riippuu molekyylin varausten erotuksesta. Jos molempien varausten välinen etäisyys on suurempi, myös dipolimomentti on suurempi.
Mutta kun puhutaan I3-ionista, se on negatiivisesti varautunut ioni. Jopa piirtäessämme sen Lewisin rakenteen emme näe siinä dipolimomenttia tai polaarisia sidoksia, koska kokonaisvaraus itsessään on negatiivinen ionissa. Se ei siis ole poolinen eikä pooliton. Jos kuitenkin joudut kuvaamaan ionia, voit käyttää sanontaa ” kuin polaarinen molekyyli”, koska I3- liukenee veteen.
Loppuhuomautuksena koko tämän artikkelin yhteenvetona voidaan todeta, että I3- on moniatominen ioni, jolla on 22 valenssielektronia, 3 yksinäistä elektroniparia, 2 sidosparia ja sp3d-hybridisaatio. Se on muodoltaan lineaarinen eikä sillä ole polariteettia.