Glykogeeni ja tärkkelys, megadaltonikokoiset glukoosipolymeerit, ovat useimmissa elävissä organismeissa helposti saatavilla olevan energian ja hiiliyhdisteiden tärkein varasto. Nisäkkäillä glukoosin saanti ja käyttö ovat tiukasti hallinnassa. Glukoosin normaalin käsittelyn häiriöt liittyvät useisiin ihmisen sairauksiin, kuten glykogeenin varastointisairauksiin ja diabetekseen, joissa jatkuva hyperglykemia korreloi sairauden varhaisen puhkeamisen ja lisääntyneen vakavuuden kanssa. Glykogeenin katalyyttiseen muuntamiseen liittyy useita entsyymejä, joista glykogeenisyntaasi katalysoi a(1,4)-linkittyneiden glukaanien pidentymistä ja glykogeenifosforylaasi niiden hajoamista. Glykogeenin ja maltodekstriinifosforylaasien biokemiallisilla ja rakenteellisilla tutkimuksilla on saatu runsaasti tietoa glykogeenin hajoamisesta viimeisten 30 vuoden aikana. Nämä tutkimukset ovat osoittaneet, että glykogeenifosforylaasin säätely on kiehtova esimerkki kovalenttisesta ja ei-kovalenttisesta allosterismista, jota hormonaalinen ohjaus koordinoi erinomaisesti. Käytännöllisesti katsoen kaikista glykogeenin prosessointiin suoraan osallistuvista entsyymeistä on nyt saatavilla tertiääri- ja kvaternäärirakenteita kuvaavia tietoja. Yllättävän vähän rakennetietoa on raportoitu glykogeenisyntaasista, joka katalysoi glykogeenin pidentymistä lisäämällä peräkkäin ![]() -(1,4)-linkittyneitä glukoosijäännöksiä polymeerin pelkistämättömään päähän käyttäen ADP/UDP-glukoosia glukoosin luovuttajana.
-(1,4)-linkittyneitä glukoosijäännöksiä polymeerin pelkistämättömään päähän käyttäen ADP/UDP-glukoosia glukoosin luovuttajana.
Olemme nyt määritelleet Agrobacterium tumefaciensin glykogeenisyntaasin (AtGS) kiderakenteen 2,3 Å:n resoluutiolla sekä apo-muodossaan että ADP:n läsnä ollessa. Tiedot kerättiin ID29:llä, ja rakenne ratkaistiin SAD-tekniikalla (yhden aallonpituuden anomaalinen diffraktio), jota seurasivat tiheysmodifikaatiomenetelmät. Proteiini esiintyy dimeerinä epäsymmetrisessä yksikössä, jossa kumpikin monomeeri koostuu kahdesta ”Rossmann-kertaisesta” domeenista (kuva 81), jotka ovat järjestäytyneet kuten glykogeenifosforylaasin ja muiden GT-B-superperheen glykosyylitransferaasien rakenteissa. Molempien domeenien välinen syvä halkeama sisältää katalyyttisen keskuksen. Merkittävä ero nisäkkäiden (perhe GT3) ja bakteerien (GT5) glykogeenisyntaasien välillä on se, että vain GT3-entsyymejä säädellään tiukasti fosforylaatiolla ja ei-kovalenttisella allosterisella modulaatiolla. GT3-, GT5- ja glykogeenifosforylaasisekvenssien rakennepohjaisten monisekvenssikohdistusten mukaan ihmisen glykogeenisyntaasin säätelyyn liittyvät fosforylaatiokohdat sijaitsevat todennäköisesti 25-residuen N-terminaalisessa ja 120-residuen C-terminaalisessa insertissä, bakteerien glykogeenisyntaasien sääntelemättömän GT-B-ytimen ulkopuolella. Mutageneesitutkimuksissa oli aiemmin tunnistettu kaksi konservoitunutta Arg-klusteria GT3-entsyymeissä sekä fosfo-Ser/Thr-jäämien että ei-kovalenttisen aktivaattorin Glc-6P:n allosterikohdan (-kohtien) osana. AtGS:ssä vastaavat jäännökset sijaitsevat C-terminaalisen domeenin toisessa päässä kaukana reaktiokeskuksesta, mikä viittaa pitkän matkan säätelyyn.
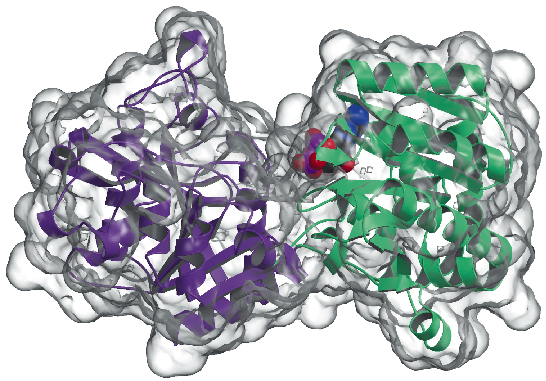
Kuva 81: Glykogeenisyntaasin rakenne: liuottimelle avoin pinta on esitetty läpinäkyvänä. Huomaa sidottu ADP-molekyyli (piirretty VDW-palloina).
AtGS:n rakenteessa on silmiinpistävää topologista samankaltaisuutta glykogeeni-/maltodekstriinifosforylaasien (perhe GT35) ydinrakenteiden kanssa (kuva 82a), vaikka sekvenssi-identiteetit ovat vähäisiä (~14 %). AtGS:n jokaisen Rossmann-kertaisen domeenin rakenne on huomattavasti lähempänä GT35-perheen fosforylaasien kuin minkään muun nukleotidiriippuvaisen glykosyylitransferaasin rakenteita. Glykogeenisyntaasit ja fosforylaasit muistuttavat voimakkaasti toisiaan myös katalyyttisissä kohdissa (kuva 82b). ADP-riboosi ja pyridoksaaliryhmät sijaitsevat vastaavissa paikoissa, samoin kuin ADP:n distaalinen fosfaatti AtGS:ssä ja epäorgaaninen fosfaattisubstraatti fosforylaaseissa. Lisäksi kriittiset aminohapot, jotka ovat vuorovaikutuksessa substraattien glukoosiryhmien kanssa, ovat myös konservoituneet. Glykogeenisyntaasien ja fosforylaasien käyttämä katalyyttinen mekanismi on siis todennäköisesti samankaltainen, ja hienovaraiset muutokset rakenteessa selittävät niiden kaiken kaikkiaan erilaiset toiminnalliset ominaisuudet.
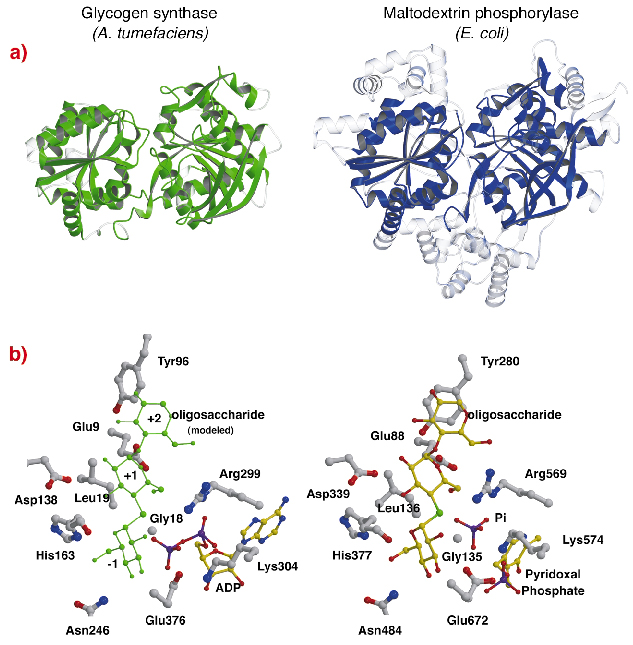
Kuva 82: Homologia glykogeenifosforylaasin kanssa: (a) rakenteellisen kohdistamisen jälkeen AtGS:n ja E. coli -maltodekstriinifosforylaasin MalP:n väliset päällekkäiset vastaavat jäännökset on esitetty kiinteällä aineistolla (kohdistamattomat alueet läpinäkyvällä); (b) AtGS:n ja MalP:n katalyyttiset paikat.
Alun perin esitetty käsitys, jonka mukaan glykogeenisynteesi edusti yksinkertaisesti sen hajottavan fosforolyysin kääntymistä, osoittautui virheelliseksi, kun Leloir osoitti, että polysakkaridien pidentymisestä vastasivat UDP-Glc ja glykogeenisyntaasi, eivät Glc-1-P ja glykogeenifosforylaasi . Työmme osoittaa nyt kuitenkin, että glukoosin ja glykogeenin välisessä muuntumisessa tapahtuvia vastakkaisia, toisistaan riippumattomia reaktioita katalysoivat läheisesti sukua olevat homologiset entsyymit.