- Introduction: Aiemmat tiedot Cannabiksen taksonomiasta käytiin aiemmin läpi (Russo, 2007), ja tässä esitetään yhteenveto ja täydennys. Cannabis on kaksikotinen yksivuotinen kasvi Cannabaceae-suvusta, johon perinteisesti kuuluu humala, Humulus spp. Vaihtoehtoisesti Cannabis on myös luokiteltu Moraceae-, Urticaceae- tai jopa Celtidaceae-sukuun kloroplastin restriktiokohtien karttojen (Weigreffe et al., 1998) ja kloroplastin mat K-geenisekvenssien (Song et al., 2001) perusteella. Viime aikoina Cannabaceae-sukuihin on sisällytetty kahdeksan sukua: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema ja Parasponia, joihin kuuluu 170 paritonta lajia (McPartland, 2018), ja tätä havaintoa tukee neljän plastidilokuksen geneettinen analyysi (Yang et al., 2013). Nykyiset tutkimukset fossiilisista siitepölynäytteistä, jotka liittyvät Cannabiksen ekologisiin assosiaatioihin arojen seuralaislajien (Poaceae, Artemisia, Chenopodiaceae) kanssa ja Humuluksen (humala) ekologisiin assosiaatioihin metsäisten sukujen (Alnus, Salix, Populus) kanssa, ovat osoittaneet, että vaikka Cannabis näyttäisi saaneen alkunsa Tiibetin ylängöltä vähintään 19,6 miljoonaa vuotta sitten, se on ollut myös Euroopassa alkuperäiskasvi vähintään miljoonan vuoden ajan (McPartland ym, 2018), ja ne ovat kumonneet perinteisen käsityksen, jonka mukaan tämä ”leirin seuraaja” olisi ihmisen tuoma sinne.
- Cannabiksen genomi ja vaihtoehtoinen isännän biokemiallinen tuotanto
- Kannabiksen synergia
- Tekijän panos
- Itsekäyttöristiriitoja koskeva lausunto
- Kiitokset
Introduction: Aiemmat tiedot Cannabiksen taksonomiasta käytiin aiemmin läpi (Russo, 2007), ja tässä esitetään yhteenveto ja täydennys. Cannabis on kaksikotinen yksivuotinen kasvi Cannabaceae-suvusta, johon perinteisesti kuuluu humala, Humulus spp. Vaihtoehtoisesti Cannabis on myös luokiteltu Moraceae-, Urticaceae- tai jopa Celtidaceae-sukuun kloroplastin restriktiokohtien karttojen (Weigreffe et al., 1998) ja kloroplastin mat K-geenisekvenssien (Song et al., 2001) perusteella. Viime aikoina Cannabaceae-sukuihin on sisällytetty kahdeksan sukua: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema ja Parasponia, joihin kuuluu 170 paritonta lajia (McPartland, 2018), ja tätä havaintoa tukee neljän plastidilokuksen geneettinen analyysi (Yang et al., 2013). Nykyiset tutkimukset fossiilisista siitepölynäytteistä, jotka liittyvät Cannabiksen ekologisiin assosiaatioihin arojen seuralaislajien (Poaceae, Artemisia, Chenopodiaceae) kanssa ja Humuluksen (humala) ekologisiin assosiaatioihin metsäisten sukujen (Alnus, Salix, Populus) kanssa, ovat osoittaneet, että vaikka Cannabis näyttäisi saaneen alkunsa Tiibetin ylängöltä vähintään 19,6 miljoonaa vuotta sitten, se on ollut myös Euroopassa alkuperäiskasvi vähintään miljoonan vuoden ajan (McPartland ym, 2018), ja ne ovat kumonneet perinteisen käsityksen, jonka mukaan tämä ”leirin seuraaja” olisi ihmisen tuoma sinne.
Cannabiksen lajinmäärityksestä itsessään käydään paljon keskustelua. Cannabis sativa, joka tarkoittaa ”viljeltyä kannabista”, nimettiin näin muun muassa Fuchsin toimesta vuonna 1542 (Fuchs, 1999), mikä oli lajinmääritys 211 vuotta ennen kasvitieteellisten binomien systematisointia Linnaeuksen teoksessa Species Plantarum (Linnaeus, 1753). Lamarck ehdotti sittemmin Cannabis indicaa, pienikokoisempaa Intiasta peräisin olevaa huumaavaa intialaista kasvia, erilliseksi lajiksi (Lamarck, 1783). Kysymys on jäänyt ratkaisematta seuraavina vuosisatoina kahden vastakkaisen filosofian myötä. Ernest Small on puolustanut yhden lajin käsitettä (Small ja Cronquist, 1976). Cannabiksen polytyyppikäsittelyt saivat myös kannattajia (Schultes et al., 1974; Anderson, 1980) morfologisten kriteerien perusteella, jotka viittaavat Cannabis sativa L:n, Cannabis indica Lam:n ja Cannabis ruderalis Jan:n erottamiseen toisistaan, ja tätä järjestelmällistä kemotaksonomiaa tukee järjestelmä. Pääkomponenttianalyysi (PCA) 157:stä eri puolilta maailmaa peräisin olevasta Cannabis-lajikkeesta, jossa arvioitiin allotsyymifrekvenssejä 17 geenilokuksessa, viittasi jakoon (Hillig, 2005b). Itä-Euroopan ruderaattinäytteistä saadut ”sativa”-geenipoolit yhdistettiin kapealehtisiin eurooppalaisiin ja keskiaasialaisiin kuitu- ja siemenkasveihin, kun taas ”indica”-ryhmittymä käsitti Kaukoidän siemen- ja kuitukasvit ja leveälehtiset huumekasvit suurimmasta osasta muuta maailmaa sekä luonnonvaraiset lajikkeet Intian niemimaalta. Keski-Aasian tienvarsinäytteiden (Cannabis ruderalis) uskottiin edustavan kolmatta ryhmää. Kaasukromatografia- (GC) ja tärkkelysgeelielektroforeesitutkimukset viittasivat myös sativan ja indican lajierotteluun (Hillig ja Mahlberg, 2004).
Agronomiset tekijät 69 näytteessä viittasivat siihen, että itäiset hamppu- ja huumekasvit sisällytettiin Cannabis indica -lajiin (Hillig, 2005a), ja jakoa tukivat fragmenttipituuspolymorfismit (Datwyler ja Weiblen, 2006).
Viime aikoina PCA näytti viittaavan terpenoidipitoisuuteen vakuuttavimpana erottavana kemotaksonomisena markkerina oletettujen sativa- ja indica-lajien välillä (Elzinga et al., 2015). Samoin PCA:n katsottiin erottelevan huumekannabiksen hampusta (Sawler et al., 2015). Tuore tutkimus osoitti huume-Cannabiksen ja hamppulajikkeiden erottamisen toisistaan 13 mikrosatelliittilokin genotyypityksen avulla koko genomissa, ei pelkästään kannabinoidien tai kuitujen tuotantoon vaikuttavien geenien avulla (Dufresnes et al., 2017). Professori Giovanni Appendino on raportoinut cis-Δ9-THC-stereoisomeerin esiintymisestä ainoastaan hamppulajikkeissa (Giovanni Appendino, henkilökohtainen tiedonanto). Nämä erot saattavat kuitenkin mennä ohi, kun otetaan huomioon nykyinen suuntaus risteyttää hamppua huumelajikkeiden kanssa THC-pitoisuutta koskevien lainsäädännöllisten rajoitusten välttämiseksi.
Kannabiksen lajikekohtainen kiista, Cannabis sativa vs. indica vs. afghanica, on jatkunut hellittämättömänä nykypäivään asti, ja päähenkilöt ovat esittäneet kiihkeitä väitteitä (Clarke ja Merlin, 2013, 2016; Small, 2015; McPartland ja Guy, 2017; Small, 2017). Tämä kirjoittaja, joka on joskus ollut asian jokaisella puolella, on päättänyt välttää sovittamatonta taksonomista keskustelua tarpeettomana häiriötekijänä (Piomelli ja Russo, 2016) ja korostaa pikemminkin sitä, että vain biokemialliset ja farmakologiset erot Cannabis-liitosten välillä ovat merkityksellisiä. McPartland oli hiljattain ilmestyneessä seminaalisessa katsauksessaan samaa mieltä: ”Cannabiksen luokittelusta joko ’Sativaksi’ tai ’Indicaksi’ on tullut turhaa puuhaa. Kaikkialla tapahtuva risteytyminen ja hybridisaatio tekevät niiden erottelun merkityksettömäksi.” (McPartland, 2018) (s. 210).
Ylimääräinen järjenvastainen nomenklatuurikiista koskee yleisessä kielenkäytössä Cannabiksen ”kantoja”, nimitystä, joka sopii bakteereille ja viruksille, mutta ei kasveille (Bailey ja Bailey, 1976; Usher, 1996; Brickell et al., 2009), erityisesti Cannabiksen kohdalla, jossa kemiallinen lajike, lyhennettynä ”chemovar”, on sopivin nimitys (Lewis et al., 2018).
Cannabiksen genomi ja vaihtoehtoinen isännän biokemiallinen tuotanto
2011 oli Cannabiksen genomiikan merkkivuosi, kun Medical Genomics ja Nimbus Informatics julkaisivat verkkoraportin täydellisestä 400 miljoonan emäsparin genomisekvenssistä, johon pian liittyi myös genomi- ja transkriptomiluonnos (van Bakel ym., 2011).
Kehitys herätti näkyvää julkisuutta ja kiistoja sen mahdollisista seurauksista. Siinä missä ihmisen genomi analysoitiin noin 20 vuotta aiemmin, kannabikseen kohdistuvat vaikutukset herättivät runsaasti spekulaatioita.
Uutiset saivat aikaan uuden tutkimuksen vyöryn, mutta kannabiksen soveltavassa genetiikassa oli jo saavutettu huomattavaa edistystä. Δ9-tetrahydrokannabinolin (THC) tunnistaminen ja synteesi onnistui Israelissa vuonna 1964 (Gaoni ja Mechoulam, 1964), mutta vasta paljon myöhemmin onnistuttiin kloonaamaan sen biosynteettistä entsyymiä, tetrahydrokannabinolihapposyntaasia (THCA-syntaasia) (Sirikantaramas et al., 2004; Kuva 1). Seuraavaksi entsyymi kiteytettiin (Shoyama et al., 2005). Kannabidiolihapon syntaasi, joka katalysoi kannabidiolihappoa (CBDA), kannabidiolin (CBD) esiastetta, oli aiemmin tunnistettu ja tuotettu puhtaassa muodossa (Taura et al., 1996; kuva 1). Tämä kehitys vauhditti lisähavaintoja, mukaan lukien THCA-syntaasin arkeologinen fytokemiallinen löytyminen 2700 vuotta vanhasta kannabiskätköstä Keski-Aasiassa sijaitsevasta haudasta sekä kaksi aiemmin raportoimatonta yhden nukleotidin polymorfismia (SNP) entsyymin geenisekvenssissä (Russo ym., 2008).
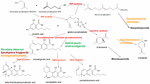
KUVA 1. THCA-syntaasi. Cannabis sativan biosynteettiset polut ja entsyymit (punaisella), osoituksena luonnollinen laji Helichrysum umbraculigerum ja vaihtoehtoiset lajit (värillisinä), jotka on geneettisesti muunnettu tuottamaan myöhempiä tuotteita .
Vuoteen 2011 mennessä tärkeimpien fytokannabinoidien tuotantoon tarvittavat entsyymit oli tunnistettu. Vastaavasti valikoivalla kehittyneellä mendeljalostuksella saatiin aikaan Cannabis-lajikkeita, joissa on runsaasti tiettyjä yksittäisiä komponentteja. Näin tuotettiin runsaasti THC:tä ja CBD:tä sisältäviä kasveja lääkekehitystä varten (de Meijer ym., 2003; de Meijer, 2004), ja vastaavasti jalostettiin runsaasti kannabikigeerolia (CBG) sisältäviä linjoja (de Meijer ja Hammond, 2005) ja kannabikromia (CBC) sisältäviä linjoja (de Meijer ym., 2009a). Valikoiva jalostus ulottui myös propyyli-fytokannabinoidianalogeihin, tetrahydrokannabivariniin (THCV), kannabidivariniin (CBDV), kannabigerivariniin (CBGV) ja kannabikromivariniin (CBCV) (de Meijer, 2004). Sellaisten kasvien saatavuus, joilla on korkeat titterit näitä ”pieniä kannabinoideja”, ennakoi mielenkiintoisia uusia farmaseuttisia sovelluksia (Russo, 2011; Russo ja Marcu, 2017).
Kannabiksen genomin saatavuus saattaa yksinkertaistaa THC-knockout-kasvien tuottamista CRISPR-teknologian (klusteroidut säännöllisesti väliin sijoittuvat lyhyet palindromiset toistot) avulla. Vaikka tämä voisi olla houkuttelevaa teollisen hampun jalostuksen kannalta, aikaisemman sukupolven kasvinjalostus on jo tuottanut hamppulajikkeita, jotka täyttävät helposti kansainväliset rajoitukset, jotka edellyttävät enintään 0,1 prosentin THC-pitoisuutta (Wirtshafter, 1997; McPartland et al., 2000; Small ja Marcus, 2003). Itse asiassa kannabinoidivapaata kannabista, jossa ei ole toimivaa kannabigerolihapposyntaasia (kuva 1), on tuotettu myös perinteisesti (de Meijer et al., 2009b). Näin ollen on edelleen epäselvää, onko Cannabiksen geenitekniikka edes tarpeen tälle kasville, jonka uskomaton plastisuus osoittaa jo nyt runsasta biokemiallista monimuotoisuutta. Muuntogeenisen kannabiksen käyttöönotto herättäisi huomattavia kiistoja tietyissä väestöryhmissä ja todennäköisesti aiheuttaisi patentti- ja jalostusoikeuksia koskevia oikeudellisia riitoja.
Voidaan helposti kuvitella erilaisia muita tieteiskirjallisuuden skenaarioita. 1990-luvulla Internet-huijaus levitti huhua, jonka mukaan apokryfinen professori Nanofsky olisi tuonut appelsiineihin (Citrus x. sinensis (L.) Osbeck) THC:n tuotantogeenejä. Vaikka tämä voisikin olla teknisesti mahdollista, tällainen yritys olisi pelkkä laboratoriokarnevaali, kun otetaan huomioon itse kannabiksen valtava kannabinoidituotanto. Salamyhkäinen piparminttu (Menthax piperita Lamiaceae), jonka lehtien rauhasmaisissa trikomeissa on laittomia fytokannabinoideja, saattaisi olla loogisempi valinta tällaisiin maanalaisiin kumouksellisiin päiväunelmiin, ja se voisi lähettää juurakoita ja juoksupyöriä pitkin vesistöjä maailmanlaajuisesti.
Edelliset väitteet kannabidiolin tuottamisesta humalasta (Humulus lupulus L. Cannabaceae) ja pellavasta (Linum usitatissimum L. Linaceae) eivät ole perusteltuja, mutta kannabigerolihappoa ja kannabigerolia havaittiin eteläafrikkalaisessa Helichrysum umbraculigerum Less. Asteraceae (Bohlmann ja Hoffmann, 1979; Appendino et al., 2015; Russo, 2016; kuva 1), mutta ilman viittausta niiden pitoisuuteen. Tämä väite vahvistettiin hiljattain, kun antenniosien kuivatuista näytteistä havaittiin pieniä määriä (Mark Lewis, henkilökohtainen tiedonanto).
Koska kannabinoidien puhtaasti de novo -biokemiallisen synteesin monimutkaisuutta on pidetty ei-kustannustehokkaana (Carvalho et al., 2017), on ehdotettu vaihtoehtoisia mikrobiologisia isäntiä (Zirpel et al., 2017). Vuonna 2004 saavutettiin THCA-syntaasin cDNA-kloonaus, joka mahdollisti kannabigerolihapon (CBGA) muuntamisen THC:ksi (Sirikantaramas et al., 2004), ja tupakan karvaisten juurien (Nicotiana tabacum cv.Xanthi Solanaceae) 8 prosentin THCA-tuotanto osoitettiin CBGA-ruokinnalla (kuva 1). Entsyymiä ekspressoitiin myös hyönteisessä, Spodoptera frugiperda (J.E. Smith) Noctuidae (syyspistiäinen), rekombinanttisen baculoviruksen avulla. Myöhemmin tämä tutkimusryhmä siirtyi hiivoihin, Pichia pastoris (nykyisin Komagataella phaffii Phaff Saccharomycetaceae) (Taura et al., 2007; kuva 1), ja saavutti CBGA:n muuntumisen THCA:ksi 98-prosenttisesti 24 tunnin aikana, ja saanto oli 32,6 mg/l väliaineesta. THCA-syntaasin rekombinanttimuoto osoittautui 4,5X tehokkaammaksi kuin Cannabiksessa ja 12X tehokkaammaksi kuin S. frugiperdassa. Prosessi optimoitiin sittemmin, jolloin aktiivisuus parani 64,5-kertaiseksi (Zirpel et al., 2018), ja K. phaffii:ssä raportoitiin tuotettavan 3,05 g/l THCA:ta 8 tunnin inkubaation jälkeen 37 °C:ssa. Yksinkertaisen laskelman mukaan tämä saanto voitaisiin saavuttaa myös uuttamalla vain 15 g 20-prosenttista THCA:ta kasviperäisestä Cannabiksesta.
Cannabiksen terpenoidituotanto on vastaavalla tavalla mahdollista vaihtoehtoisissa isännissä. Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae -mutantit, joilla on farnesyylidifosfaattisyntaasientsyymin puutos, keräävät sen sijaan geranyyli-pyrofosfaattia, joka ohjataan lääketieteellisesti hyödyllisen terpenoidin, linaloolin, tuotantoon (Oswald et al., 2007; kuva 1). Vastaavasti muut tutkijat ovat valjastaneet S. cerevisiaen mitokondrioiden biosynteettiset kyvyt lisäämään farnesyylidifosfaatin avulla seskiterpenoidien tuotantoa (Farhi et al., 2011), vaikkakaan ei Cannabikselle yhteisten seskviterpenoidien tuotantoa.
Olemassa olevia Cannabiksen genomisekvenssejä ei ole tällä hetkellä täysin annotoitu. Näin ollen tarvitaan soveltavaa ennakkotietoa ja salapoliisityötä, jotta voidaan hankkia käytännön tietoa Cannabiksen geneettisestä toiminnasta. Suurin potentiaali tällaisessa tutkimuksessa on epigenetiikassa, joka on kasvin geeniekspression tai fenotyypin periytyvien muutosten taustalla. Merkittävin puute on tietämättömyys kannabinoidien tuotannon säätelystä. Cannabiksen terpenoideja tuottavien terpeenisyntaasien biosynteettisten polkujen ja säätelyn ymmärtämistä ei ole juuri aloitettu (Booth et al., 2017), ja ne ovat edelleen kypsiä lisätutkimuksen kohteita (Russo, 2011).
Cannabiksen viljelyn lisäongelmana on edelleen voucher-näytteiden puute (jotka Yhdysvaltain huumausainevirasto (US Drug Enforcement Administration, Drug Enforcement Administration, USDA) kieltää ilman Schedule I -lisenssilupaa) ja kemovariotyyppisten liittymäkertymien viralliset tallettaminen siemeniä ja kudoksia sisältäviin arkistoihin. Jälkimmäisen on toteuttanut GW Pharmaceuticals ja itsenäisesti NaPro Research (Lewis et al., 2018) Skotlannissa sijaitsevassa National Collection of Industrial, Food and Marine Bacteria (NCIMB) -kokoelmassa. Monet yksityiset yritykset ovat välttäneet ituplasman jakamista oikeudellisten rajoitusten ja immateriaalioikeuksien menettämisen pelon vuoksi.
Kannabiksen synergia
Professorit Raphael Mechoulam ja Shimon Ben-Shabat esittivät vuonna 1998, että endokannabinoidijärjestelmä osoitti ”saattovaikutusta”, jossa erilaiset ”inaktiiviset” aineenvaihduntatuotteet ja läheisesti toisiinsa liittyvät molekyylit lisäsivät selvästi ensisijaisten endogeenisten kannabinoidien, anandamidin ja 2-arachidonoyyliglyserolin, aktiivisuutta (Ben-Shabat ym, 1998). He myös väittivät, että tämä auttoi selittämään, miksi kasviperäiset lääkkeet olivat usein tehokkaampia kuin niiden eristetyt komponentit (Mechoulam ja Ben-Shabat, 1999). Vaikka yksittäisen molekyylin synteesi on edelleen vallitseva malli lääkekehityksessä (Bonn-Miller et al., 2018), kasviperäisen synergian käsite on osoitettu runsaasti samanaikaisesti vetoamalla ”vähäisten kannabinoidien” ja Cannabis-terpenoidien farmakologiseen panokseen kasvin farmakologisessa kokonaisvaikutuksessa (McPartland ja Pruitt, 1999; McPartland ja Mediavilla, 2001; McPartland ja Russo, 2001, 2014; Russo ja McPartland, 2003; Wilkinson et al., 2003; Russo, 2011). Useita asiaankuuluvia esimerkkejä seurueilmiöstä kannabiksessa on havainnollistavia:
Satunnaistetussa kontrolloidussa tutkimuksessa oromucosaalisista kannabispohjaisista uutteista potilailla, joilla oli vaikeasti hoidettavissa olevaa kipua optimoidusta opioidihoidosta huolimatta, THC-painotteinen uute ei erottunut suotuisasti lumelääkkeestä, kun taas kokokasviuute (nabiximols, vide infra), jossa oli sekä THC:tä että kannabidiolia (CBD:tä), osoittautui tilastollisesti merkitsevästi paremmaksi kuin kumpikin näistä (Johnson et al., Ainoa merkittävä ero oli CBD:n esiintyminen jälkimmäisessä.
Eläinkokeissa, joissa tutkittiin analgesiaa, puhdas CBD tuottaa bifaasisen annos-vastekäyrän siten, että pienemmät annokset vähentävät kipuvasteet, kunnes saavutetaan huippu, jonka jälkeen annoksen jatkuva lisääminen ei ole tehokasta. Mielenkiintoista on, että täysspektrisen kannabisuutteen ja vastaavien CBD-annosten käyttö poistaa kaksivaiheisen vasteen lineaarisen annos-vastekäyrän hyväksi siten, että kasviuute on analgeettinen millä tahansa annoksella ilman havaittua kattovaikutusta (Gallily et al., 2014).
Tuore tutkimus, jossa tutkittiin useita ihmisen rintasyöpäsolulinjoja viljelyssä ja istutettuja kasvaimia, osoitti kannabisuutehoidon paremmuuden puhtaaseen THC:hen verrattuna, mikä näyttäisi johtuvan ensin mainitussa pienistä cannabigeroli- (CBG) ja tetrahydrokannabinolihappopitoisuuksista (THCA) (Blasco-Benito ym, 2018).
Kannabidiolin antikonvulsiiviset vaikutukset havaittiin eläimillä 1970-luvulla, ja ensimmäiset ihmiskokeet tehtiin vuonna 1980 (Cunha ym., 1980). Tuoreessa kokeessa hiirillä, joilla pentylenetetratsoli aiheutti kouristuksia, käytettiin viittä erilaista kannabisuutetta, joissa oli samat CBD-pitoisuudet (Berman ym., 2018). Vaikka kaikki uutteet osoittivat hyötyjä verrattuna käsittelemättömiin kontrolleihin, huomattavia eroja havaittiin muiden kuin CBD-kannabinoidien biokemiallisissa profiileissa, mikä puolestaan johti merkittäviin eroihin tonis-kloonisia kohtauksia saavien hiirten lukumäärissä (21,5-66,7 %) ja eloonjäämisprosenteissa (85-100 %), mikä korostaa näiden ”pienten” komponenttien merkitystä. Tämä tutkimus korostaa standardoinnin välttämättömyyttä lääkekehityksessä, ja vaikka sen voidaan tulkita tukevan yhden molekyylin terapeuttista mallia (Bonn-Miller et al., 2018), se vaatii korostamaan, että monimutkaiset kasviperäiset aineet voivat täyttää amerikkalaiset FDA-standardit (Food and Drug Administration, 2015). Erityisesti kaksi kannabispohjaista lääkettä on saavuttanut viranomaishyväksynnän, Sativex® (nabiximols, Yhdysvalloissa hyväksytty nimi) 30 maassa ja Epidiolex® Yhdysvalloissa.
Tällöin herää kysymys: Voiko kannabisvalmiste tai yksittäinen molekyyli olla liian puhdas, jolloin synergistinen potentiaali vähenee? Viimeaikaiset tiedot tukevat tätä selvänä mahdollisuutena. Korkean CBD-pitoisuuden omaavia kannabisuutteita vaikean epilepsian, kuten Dravetin ja Lennox-Gastautin oireyhtymien, hoitoon käyttävien kliinikkojen anekdoottiset tiedot osoittivat, että heidän potilaansa osoittivat huomattavaa parannusta kohtausten esiintymistiheydessä (Goldstein, 2016; Russo, 2017; Sulak et al., 2017) annoksilla, jotka olivat paljon pienempiä kuin ne annokset, jotka raportoitiin 97-prosenttisesti puhtaasta CBD-valmisteesta, josta on poistettu THC, valmisteella tehdyissä muodollisissa kliinisissä tutkimuksissa, jotka koskivat Epidiolex-valmistetta, josta on poistettu THC (Devinsky et al., 2016, 2017, 2018; Thiele et al., 2018). Tästä havainnosta tehtiin äskettäin meta-analyysi 11 tutkimuksesta, joissa oli yhteensä 670 potilasta (Pamplona et al., 2018). Nämä tulokset osoittivat, että 71 % potilaista parani CBD-painotteisilla kannabisuutteilla vs. 36 % puhdistetulla CBD:llä (p < 0,0001). Vasteprosentti 50 %:n paranemisessa kohtaustiheydessä ei ollut tilastollisesti erilainen näissä kahdessa ryhmässä, ja molemmat ryhmät saavuttivat kohtauksettoman tilan noin 10 %:lla potilaista. Ryhmien keskimääräiset vuorokausiannokset poikkesivat kuitenkin huomattavasti toisistaan: 27,1 mg/kg/d puhdistetulla CBD:llä vs. vain 6,1 mg/kg/d. CBD-rikkailla kannabisuutteilla, mikä on vain 22,5 % pelkän CBD:n annoksesta. Lisäksi lievien ja vakavien haittatapahtumien esiintyvyys oli todistettavasti suurempi puhdistettua CBD:tä saaneilla potilailla kuin runsaasti CBD:tä sisältävää uutetta saaneilla potilailla (p < 0,0001), tuloksen, jonka kirjoittajat katsoivat johtuvan käytetystä pienemmästä annoksesta, joka saavutettiin heidän mielestään muiden lähiyhdisteiden synergistisellä vaikutuksella. Tällaiset havainnot tukevat hypoteesia sellaisten kannabisuutteiden suuremmasta tehosta, jotka yhdistävät useita kouristuksia ehkäiseviä komponentteja, kuten CBD:tä, THC:tä, THCA:ta, THCV:tä, CBDV:tä, linaloolia ja jopa karyofylleeniä (Lewis et al., 2018).
Nämä ja muut tutkimukset tarjoavat vankan perustan kannabiksen synergialle ja tukevat kasviperäisten lääkkeiden kehittämistä verrattuna yksittäisten komponenttien kehittämiseen (Bonn-Miller et al., 2018) tai tuotantoon käymismenetelmillä hiivassa tai muissa mikro-organismeissa. Esimerkkinä tavanomaisen valikoivan jalostuksen voimasta on havainnollistettu (kuva 2) Cannabiksen kemovari, joka on nimetty CaryodiolTM:ksi sen CB2-agonistina toimivan kohonneen karyofyleenipitoisuuden (0,83 %) sekä erittäin suotuisan tyypin III THC:n ja CBD:n suhdeluvun 1:39,4 vuoksi. Tällaista valmistetta voidaan soveltaa lukuisten kliinisten sairauksien hoitoon, mukaan lukien kipu, tulehdus, fibroottiset häiriöt, riippuvuus, ahdistus, masennus, autoimmuunisairaudet, dermatologiset sairaudet ja syöpä (Pacher ja Mechoulam, 2011; Russo, 2011; Xi et al., 2011; Russo ja Marcu, 2017; Lewis et al., 2018). Tällaisen yhdistelmän tuottaminen mikrobilähteistä saattaisi vaatia useista hiivalajeista peräisin olevien kannabinoidien yhdistelmiä, minkä vuoksi se edustaisi yhdistelmätuotetta, johon sovellettaisiin vaikeaa sääntelypolkua verrattuna yhden lajin uutteista valmistettuihin kannabisvalmisteisiin (esim. nabiksimoli), joka on hyväksytty yhtenäisenä valmisteena 30 maassa eri puolilla maailmaa (Food and Drug Administration, 2015).
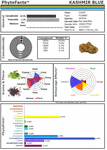
KUVIO2. PhytoFactsTM -kuvaus kannabinoidi- ja terpenoidipitoisuudesta CaryodiolTM:ssä, joka tunnetaan myös nimellä ”Kashmir Blue”, tyypin III, kannabidioli- ja karyofylleeni-predominantti kemovar. Katso (Lewis et al., 2018) yksityiskohtaiset tiedot PhytoFactsista ja perinteisestä jalostusmenetelmästä. Copyright© 2016 BHC Group, LLC. Kaikki oikeudet pidätetään. Tämän asiakirjan tai yllä olevien kuvien tai merkkien luvaton käyttö voi rikkoa tekijänoikeuksia, tavaramerkkejä ja muita sovellettavia lakeja.
Tässä artikkelissa on hahmoteltu lyhyesti viimeaikaisia teknologisia yrityksiä ”keksiä fytokannabinoidipyörä uudelleen”. Vakuuttavat argumentit tukisivat sitä, että se voidaan tehdä, mutta pitäisikö se tehdä? Tiedot, jotka tukevat kannabiksen synergian olemassaoloa ja kannabiksen genomin hämmästyttävää plastisuutta, viittaavat todellisuuteen, joka tekee tarpeettomaksi vaihtoehtoiset isännät tai jopa Cannabis sativan geenitekniikan, mikä todistaa, että ”kasvi tekee sen paremmin”.”
Tekijän panos
Tekijä vahvistaa olevansa tämän työn ainoa tekijä ja on hyväksynyt sen julkaistavaksi.
Itsekäyttöristiriitoja koskeva lausunto
Olen Kansainvälisen kannabis- ja kannabinoidi-instituutin tutkimusjohtaja. Palvelemme kannabiksen kauppaa harjoittavia asiakkaita.
Kiitokset
Tekijä arvostaa Montanan yliopiston Mansfieldin kirjaston kirjastojenvälisen lainaustoimiston henkilökunnan apua tutkimusaineiston toimittamisessa.
Anderson, L. C. (1980). Lehtien vaihtelu Cannabis-lajien välillä kontrolloidussa puutarhassa. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum: Välimeren yrttilääketieteen nukkuva jättiläinen. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., and Bailey, E. Z. (1976). Hortus Third: A Concise Dictionary of Plants Cultivated in the United States and Canada. New York, NY: Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). Kokonaisvaikutus: inaktiiviset endogeeniset rasvahappojen glyseroliesterit tehostavat 2-arachidonoyyli-glyseroli-kannabinoidien aktiivisuutta. Eur. J. Pharmacol. 353, 23-31. doi: 10.1016/S0014-2999(98)00392-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). Uusi ESI-LC/MS-lähestymistapa kannabiksen fytokannabinoidien kattavaan metaboliseen profilointiin. Sci. Rep. 8:14280. doi: 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). ”Kokonaisvaikutuksen” arviointi: puhtaan kannabinoidin ja kasviperäisen lääkevalmisteen kasvainvastainen vaikutus rintasyövän prekliinisissä malleissa. Biochem. Pharmacol. 157, 285-293. doi: 10.1016/j.bcp.2018.06.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohlmann, F., ja Hoffmann, E. (1979). Cannabigerol-ahnliche verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi: 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S., ja Vandrey, R. (2018). Kannabiksen ja kannabinoidien lääkekehitys: kasvitieteellisten vs. yhden molekyylin lähestymistapojen arviointi. Int. Rev. Psychiatry 30, 277-284. doi: 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E., and Bohlmann, J. (2017). Terpeenisyntaasit Cannabis sativasta. PLoS One 12:e0173911. doi: 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). International Code of Nomenclature for Cultivated Plants. Leuven: International Society for Horticultural Science.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S., and Stehle, F. (2017). Mikro-organismien suunnittelu kannabinoidien heterologista biosynteesiä varten. FEMS Yeast Res. 17:fox037. doi: 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., and Merlin, M. D. (2013). Kannabis: Evolution and Ethnobotany. Berkeley, CA: University of California Press.
Google Scholar
Clarke, R. C., and Merlin, M. D. (2016). Kannabiksen kesyttäminen, jalostushistoria, nykyinen geneettinen monimuotoisuus ja tulevaisuuden näkymät. Crit. Rev. Plant Sci. 35, 293-327. doi: 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Kannabidiolin krooninen anto terveille vapaaehtoisille ja epilepsiapotilaille. Pharmacology 21, 175-185. doi: 10.1159/000137430
PubMed Abstract | CrossRef Full Text | Google Scholar
Datwyler, S. L., ja Weiblen, G. D. (2006). Hampun ja marihuanan (Cannabis sativa L.) geneettinen vaihtelu monistettujen fragmenttipituuspolymorfismien mukaan. J. Forensic Sci. 51, 371-375. doi: 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). ”The breeding of cannabis cultivars for pharmaceutical end uses,” in Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, and P. Robson (London: Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P., Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M., and Hammond, K. M. (2005). Kemiallisen fenotyypin periytyminen Cannabis sativa L:ssä (II): kannabigerolia hallitsevat kasvit. Euphytica 145, 189-198. doi: 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M., Hammond, K. M., ja Micheler, M. (2009a). Kemiallisen fenotyypin periytyminen Cannabis sativa L:ssä (III): Cannabichromen osuuden vaihtelu. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Sutton, A. (2009b). Kemiallisen fenotyypin periytyminen Cannabis sativa L:ssä (IV): kannabinoidittomat kasvit. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). Kannabidiolin kokeilu lääkkeille resistenttien kohtausten hoitoon Dravetin oireyhtymässä. N. Engl. J. Med. 376, 2011-2020. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Kannabidioli potilailla, joilla on hoitoresistentti epilepsia: avoin interventiotutkimus. Lancet Neurol. 15, 270-278. doi: 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Thiele, E. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). Satunnaistettu, annosteleva kannabidiolin turvallisuustutkimus Dravetin oireyhtymässä. Neurology 90, e1204-e1211. doi: 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J. ja Fumagalli, L. (2017). Kannabiksen laajamittainen geneettinen monimuotoisuus rikosteknisiä sovelluksia varten. PLoS One 12:e0170522. doi: 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R. ja Raber, J. C. (2015). Kannabinoidit ja terpeenit kannabiksen kemotaksonomisina merkkiaineina. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Hiivan alisoluisten osastojen valjastaminen kasviperäisten terpenoidien tuotantoon. Metab. Eng. 13, 474-481. doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Food and Drug Administration (2015). Botanical Drug Development Guidance for Industry, toim. U.S.D.o.H.a.H. Services (Washington, DC: Food and Drug Administration). doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). Leonhart Fuchsin suuri yrtti: De Historia Stirpium Commentarii Insignes, 1542 (Huomionarvoisia kommentteja kasvien historiasta). Stanford, CA: Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., and Hanus, L. (2014). Kannabidiolin kellonmuotoisen annosvasteen ylittäminen käyttämällä kannabidiolilla rikastettua kannabisuutetta. Pharmacol. Pharm. 6, 75-85. doi: 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., ja Mechoulam, R. (1964). Hasiksen aktiivisen ainesosan eristäminen, rakenne ja osasynteesi. J. Am. Chem. Soc. 86, 1646-1647. doi: 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Kannabis lasten epilepsian hoidossa. Chicago, IL: O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). Yhdistetty analyysi agronomisista ominaisuuksista ja allotsyymiallelien frekvensseistä 69 Cannabis-lajikkeen osalta. J. Ind. Hemp 10, 17-30. doi: 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Geneettiset todisteet lajinmuodostuksesta Cannabiksessa (Cannabaceae). Genet. Resour. Crop Evol. 52, 161-180. doi: 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., and Mahlberg, P. G. (2004). Cannabiksen (Cannabaceae) kannabinoidivaihtelun kemotaksonominen analyysi. Am. J. Bot. 91, 966-975. doi: 10.3732/ajb.91.6.966
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R. ja Fallon, M. T. (2010). Monikeskuksinen, kaksoissokkoutettu, satunnaistettu, lumekontrolloitu, rinnakkaisryhmätutkimus THC:CBD-uutteen ja THC-uutteen tehosta, turvallisuudesta ja siedettävyydestä potilailla, joilla on vaikeasti hoidettavissa oleva syöpään liittyvä kipu. J. Pain Symptom Manage. 39, 167-179. doi: 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris: Chez Panckoucke.
Lewis, M. A., Russo, E. B., and Smith, K. M. (2018). Kannabiksen kemovarien farmakologiset perusteet. Planta Med. 84, 225-233. doi: 10.1055/s-0043-122240
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnaeus, C. (1753). Species Plantarum. Holmiae: Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., and Hegman, W. (2018). Kannabis on Euroopan alkuperäiskasvi ja viljely alkoi kupari- tai pronssikaudella: fossiilisten siitepölytutkimusten probabilistinen synteesi. Veg. His. Archaeobot. 27, 635-648. doi: 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). Kannabiksen systematiikka suvun, suvun ja lajin tasolla. Cannabis Cannabinoid Res. 3, 203-212. doi: 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., and Watson, D. P. (2000). Hemp Diseases and Pests: Management and Biological Control. Wallingford: CABI. doi: 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., and Guy, G. W. (2017). Kannabiksen taksonomian mallit, kulttuuriset ennakkoluulot ja ristiriidat tieteellisten ja kansanomaisen nimien välillä. Bot. Rev. 83, 327-381. doi: 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., ja Mediavilla, V. (2001). ”Non-cannabinoids in cannabis,” in Cannabis and Cannabinoids, eds F. Grotenhermen and E. B. Russo (Binghamton, NY: Haworth Press), 401-409.
Google Scholar
McPartland, J. M., and Pruitt, P. L. (1999). Lääkkeiden sivuvaikutukset, joita vertailukelpoiset kasviperäiset lääkkeet eivät aiheuta: tetrahydrokannabinolin ja marihuanan tapaus. Altern. Ther. Health Med. 5, 57-62.
Google Scholar
McPartland, J. M., and Russo, E. B. (2001). Kannabis ja kannabisuutteet: enemmän kuin osiensa summa? J. Cannabis Ther. 1, 103-132. doi: 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., ja Russo, E. B. (2014). ”Non-phytocannabinoid constituents of cannabis and herbal synergy,” in Handbook of Cannabis, ed. R. G. Pertwee (Oxford: Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., and Ben-Shabat, S. (1999). Gan-zi-gun-nusta anandamidiin ja 2-arachidonoyyliglyseroliin: kannabiksen jatkuva tarina. Nat. Prod. Rep. 16, 131-143. doi: 10.1039/a703973e
PubMed Abstract | CrossRef Full Text | Google Scholar
Oswald, M., Fischer, M., Dirninger, N. ja Karst, F. (2007). Monoterpenoidien biosynteesi Saccharomyces cerevisiaessa. FEMS Yeast Res. 7, 413-421. doi: 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P., and Mechoulam, R. (2011). Onko lipidien signalointi kannabinoidi 2 -reseptorien kautta osa suojaavaa järjestelmää? Prog. Lipid Res. 50, 193-211. doi: 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., ja Coan, A. C. (2018). CBD-rikkaiden kannabisuutteiden mahdolliset kliiniset hyödyt puhdistettuun CBD:hen verrattuna hoitoresistentissä epilepsiassa: havainnointitietojen meta-analyysi. Front. Neurol. 9:759. doi: 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., ja Russo, E. B. (2016). Cannabis sativa versus Cannabis indica -keskustelu: Ethan Russon, MD:n haastattelu. Cannabis Cannabinoid Res. 1, 44-46. doi: 10.1089/can.2015.29003.ebr
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2007). Kannabiksen ja sen valmisteiden historia saagassa, tieteessä ja sananlaskussa. Chem. Biodivers. 4, 1614-1648. doi: 10.1002/cbdv.200790144
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2011). THC:n kesyttäminen: potentiaalinen kannabiksen synergia ja fytokannabinoidi-terpenoidien entourage-vaikutukset. Br. J. Pharmacol. 163, 1344-1364. doi: 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2016). Beyond Kannabis: Kasvit ja endokannabinoidijärjestelmä. Trends Pharmacol. Sci. 37, 594-605. doi: 10.1016/j.tips.2016.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2017). Kannabis ja epilepsia: muinainen hoito palaa etualalle. Epilepsy Behav. 70(Pt B), 292-297. doi: 10.1016/j.yebeh.2016.09.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., Jiang, H. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Keski-Aasian muinaisen kannabiksen fytokemialliset ja geneettiset analyysit. J. Exp. Bot. 59, 4171-4182. doi: 10.1093/jxb/ern260
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., and Marcu, J. (2017). Kannabisfarmakologia: tavalliset epäillyt ja muutama lupaava johtolanka. Adv. Pharmacol. 80, 67-134. doi: 10.1016/bs.apha.2017.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., ja McPartland, J. M. (2003). Kannabis on muutakin kuin pelkkää Delta(9)-tetrahydrokannabinolia. Psychopharmacology 165, 431-432. doi: 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). Marihuanan ja hampun geneettinen rakenne. PLoS One 10:e0133292. doi: 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., and Lockwood, T. (1974). Kannabis: esimerkki taksonomisesta laiminlyönnistä. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). Delta1-tetrahydrokannabinolihapon (THCA) syntaasin kiteyttäminen Cannabis sativasta. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 61(Pt 8), 799-801. doi: 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., ym. et al. (2004). Marihuanan psykoaktiivisuutta kontrolloiva geeni: Delta1-tetrahydrokannabinolihapon syntaasin molekyylikloonaus ja heterologinen ilmentyminen Cannabis sativa L:stä J. Biol. Chem. 279, 39767-39774. doi: 10.1074/jbc.M403693200
PubMed Abstract | CrossRef Full Text | Google Scholar
Small, E. (2015). Cannabis sativan (marihuana, hamppu) evoluutio ja luokittelu suhteessa ihmisen käyttöön. Bot. Rev. 81, 189-294. doi: 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis: A Complete Guide. Boca Raton, FL: CRC Press.
Google Scholar
Small, E., and Cronquist, A. (1976). Kannabiksen käytännöllinen ja luonnollinen taksonomia. Taxon 25, 405-435. doi: 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., and Marcus, D. (2003). Tetrahydrokannabinolipitoisuudet hampun (Cannabis sativa) ituvaroissa. Econ. Bot. 57, 545-558. doi: 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., and Hong, D.-Y. (2001). Furnter evidence for the paraphyly of the Celtidaceae from the chloroplast gene mat K. Plant Syst. Evol. 228, 107-115. doi: 10.1007/s006060170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., and Goldstein, B. (2017). Epilepsian hoitoon käytettävän käsityökannabiksen nykytila Yhdysvalloissa. Epilepsy Behav. 70(Pt B), 328-333. doi: 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y., ja Morimoto, S. (2007). Delta(1)-tetrahydrokannabinolihapon tuotanto biosynteettisellä entsyymillä, joka erittyy siirtogeenisestä Pichia pastoriksesta. Biochem. Biophys. Res. Commun. 361, 675-680. doi: 10.1016/j.bbrc.2007.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S., ja Shoyama, Y. (1996). Cannabidiolihapposyntaasin puhdistus ja karakterisointi Cannabis sativa L:stä. Biokemiallinen analyysi uudesta entsyymistä, joka katalysoi kannabigerolihapon oksitosyklisoitumista kannabidiolihapoksi. J. Biol. Chem. 271, 17411-17416. doi: 10.1074/jbc.271.29.17411
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Kannabidioli potilailla, joilla on Lennox-Gastautin oireyhtymään liittyviä kohtauksia (GWPCARE4): satunnaistettu, kaksoissokkoutettu, lumekontrolloitu vaiheen 3 tutkimus. Lancet 391, 1085-1096. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). The Wordsmith Dictionary of Botany. Ware: Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). Cannabis sativan genomin ja transkriptomin luonnos. Genome Biol. 12:R102. doi: 10.1186/gb-2011-12-10-r102
PubMed Abstract | CrossRef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J., and Guries, R. P. (1998). Ulmaceae, yksi vai kaksi sukua? Todisteet kloroplastin DNA:n restriktiokohtien kartoituksesta. Plant Syst. Evol. 210, 249-270. doi: 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Lääkekannabis: tarvitaanko delta9-tetrahydrokannabinolia kaikkien sen vaikutusten aikaansaamiseksi? J. Pharm. Pharmacol. 55, 1687-1694. doi: 10.1211/0022357022304
PubMed Abstract | CrossRef Full Text | Google Scholar
Wirtshafter, D. (1997). ”Nutritional value of hemp seed and hemp seed oil,” in Cannabis in Medical Practice, ed. M. L. Mathre (Jefferson, NC: McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Aivojen kannabinoidi CB(2) -reseptorit moduloivat kokaiinin vaikutuksia hiirillä. Nat. Neurosci. 14, 1160-1166. doi: 10.1038/nn.2874
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z., and Yi, T.-S., ja Yi, T.-S. (2013). Cannabaceae-heimon molekulaarinen fylogenetiikka ja ominaisuuksien kehitys. Taxon 62, 473-485. doi: 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., and Stehle, F. (2017). Hiivojen muokkaaminen alustajärjestöinä kannabinoidien biosynteesiä varten. J. Biotechnol. 259, 204-212. doi: 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). Delta(9)-tetrahydrokannabinolihapposyntaasin tuotannon optimointi Komagataella phaffii:ssa posttranslationaalisen pullonkaulan tunnistamisen avulla. J. Biotechnol. 272-273, 40-47. doi: 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text