- Serum Albumin
- Structure
- Toiminta
- Jakaantuminen
- Albumiinin kertyminen kasvaimen interstitiumiin
- Sellulaariset albumiinia sitovat proteiinit
- Albondiini/gp60
- gp18 ja gp30
- SPARC
- hnRNP:t ja kalretikuliini
- FcRn
- Kubiliini ja megaliini
- Albumiini lääkeaineen kuljettajana onkologiassa
- Tulokset
- Kiinnostusristiriitoja koskeva lausunto
- Kiitokset
Serum Albumin
Structure
Serum albumin on kaikkien selkärankaisten veriplasman runsain proteiini, jonka pitoisuus ihmisen seerumissa on 35-50 mg/ml (Peters, 1996). Ihmisen seerumin albumiinin (HSA) molekyylimassa on 66 348 Da, ja se koostuu kolmesta homologisesta domeenista, jotka on numeroitu I, II ja III (kuva 1) (He ja Carter, 1992; Peters, 1996; Sugio ym., 1999). Kukin domeeni on ryhmitelty osa-alueisiin A ja B, joilla on yhteisiä rakenteellisia motiiveja. Kaksi tärkeintä aluetta, jotka vastaavat ligandin sitoutumisesta HSA:han, tunnetaan nimillä Sudlow’s Site I ja II, jotka sijaitsevat aladomeenissa IIA ja IIIA (kuva 1) (Sudlow et al., 1976; Peters, 1996). Albumiinia koodaa yksi geeni, joka ilmentyy yhteispainotteisesti siten, että molemmat alleelit transkriboituvat ja translatoituvat (Hawkins ja Dugaiczyk, 1982; Peters, 1996). Ihmisen albumiinigeeni sijaitsee kromosomin 4 pitkällä haaralla paikassa q13.3.
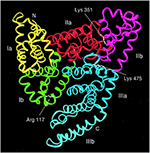
KUVIO 1. Ihmisen albumiinigeenin sijainti. Ihmisen seerumialbumiinin rakenne, joka koostuu kolmesta domeenista, jotka on ryhmitelty osa-alueisiin A ja B (osa-alue Ia, keltainen; Ib, vihreä; IIa, punainen; IIb, magenta; IIIa, sininen; ja IIIb, syaani). Sugio ym. (1999) Oxford University Pressin luvalla.
Toiminta
Albumiinia syntetisoidaan ensisijaisesti maksassa, ja ihmisen maksa tuottaa ~13,9 g HSA:ta päivässä (Peters, 1996). HSA:n puoliintumisaika on noin 19 päivää, ja se hajoaa tehokkaammin, jos se on denaturoitu tai rakenteellisesti muuttunut (Peters, 1996). Albumiinilla on monia tärkeitä tehtäviä, ja se vastaa 80 prosentista veren kolloidisesta osmoottisesta paineesta (Peters, 1996). Merkittävää on, että albumiini pystyy sitomaan erilaisia endogeenisiä molekyylejä, kuten pitkäketjuisia rasvahappoja, steroideja, L-tryptofaania jne. (Kragh-Hansen, 1981; Peters, 1996; Evans, 2002). Lisäksi albumiini osallistuu myös ionien kuljetukseen verenkierrossa, mukaan lukien kupari, sinkki, kalsium jne. (Peters, 1996).
Lisäksi tämä elintärkeä proteiini pystyy sitomaan eksogeenisia yhdisteitä ja lääkkeitä, kuten varfariinia, ibuprofeenia, klooripromatsiinia ja naprokseenia, ja niiden sitoutumisen affiniteetti vaikuttaa merkittävästi niiden aktiivisuuteen ja puoliintumisaikaan (Kragh-Hansen, 1981; Peters, 1996; Evans, 2002). Lisäksi albumiini toimii myös toksisen jätteen kuljettajana sitomalla hemin hajoamistuotteena syntyvää bilirubiinia ja toimittamalla sitä maksaan maksan erittymistä varten (Peters, 1996). Mielenkiintoista on, että albumiinin uskotaan toimivan myös antioksidanttina, koska se kykenee: (1) suojella sidottuja aineita peroksidatiivisilta vaurioilta (esim. rasvahapot ja lipoproteiinit) ja (2) sitoa vapaata kuparia rajoittaen sen redox-aktiivisuutta ja vapaiden radikaalien tuotantoa (Peters, 1996; Evans, 2002). Lopuksi albumiini on tiolien lähde, jotka ovat innokkaita reaktiivisten happi- ja typpilajien pelastajia (Peters, 1996; Evans, 2002).
Jakaantuminen
Huomionarvoista on, että albumiinia on pääasiassa ekstravaskulaarisessa tilassa (~242 g) eikä intravaskulaarisessa tilassa (~118 g) (Peters, 1996; Evans, 2002). Itse asiassa valkuaisainetta esiintyy pääasiassa solunulkoisissa tiloissa, kuten ihossa, suolistossa, lihaksissa, muissa nesteissä (esim. aivo-selkäydinnesteessä, keuhkopussinesteessä jne.) ja eritteissä (esim. hiki, kyyneleet ja maito) (Peters, 1996). Albumiinia on kuitenkin hyvin pieniä pitoisuuksia solunsisäisesti (Peters, 1996). Albumiini palaa ekstravaskulaarisesta tilasta verenkiertoon lymfaattisen järjestelmän kautta tehden elinaikanaan ~28 ”matkaa” lymfaattiseen järjestelmään ja sieltä pois (Peters, 1996; Evans, 2002).
Hepatosyyttien erittymisen jälkeen albumiini pääsee verenkiertoon ja siirtyy solunulkoiseen tilaan sinusoidisen tai fenestroituneen endoteelin huokosten kautta tietyissä elimissä, kuten maksassa, haimassa, ohutsuolessa ja luuytimessä (Peters, 1996). Kuitenkin elimissä, joissa vallitsee yhtenäinen endoteeli, uskotaan nykyään, että albumiini voi läpäistä endoteelin aktiivisten transsytoottisten mekanismien kautta, mukaan lukien reseptorivälitteiset mekanismit (esim, albondiini; ks. kohta ”Solujen albumiinia sitovat proteiinit”).
Albumiinin kertyminen kasvaimen interstitiumiin
Kiinteissä kasvaimissa on yleisesti epäkypsä, hyvin läpäisevä verisuonisto, johon vaikuttavat verisuonten läpäisevyyttä lisäävät tekijät (esim, typpioksidi) (Carmeliet ja Jain, 2000; Maeda ym., 2000; Greish, 2007; van der Veldt ym., 2008). Tästä huolimatta imunesteen poistuminen on yleensä riittämätöntä (Carmeliet ja Jain, 2000; Maeda ym., 2000; Greish, 2007). Tämä johtaa myöhemmin makromolekyylien (>40 kDa) kertymiseen kasvaimen interstitiumiin, ja tätä kutsutaan tehostuneeksi permeaatio- ja retentiovaikutukseksi (kuva 2) (Maeda ym., 2000; Greish, 2007). Mielenkiintoista on, että Matsumura ja Maeda (1986) osoittivat, että suonensisäisesti injisoitu Evans blue-albumiinikompleksi kerääntyi ddY-hiirten sarkooma 180 -kasvaimiin. Albumiinin pidättyminen kasvaimissa on sittemmin havaittu useissa kokeellisissa kiinteissä kasvaimissa (esim. sarkooma, munasarjakarsinooma, Novikofin hepatooma jne.) käyttämällä radiomerkittyä tai väriainekompleksilla varustettua seerumin albumiinia (Peterson ja Appelgren, 1973; Sinn ym., 1973), 1990; Andersson et al., 1991; Schilling et al., 1992; Stehle et al., 1997; Wunder et al., 1997).
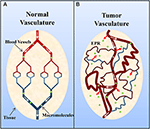
Kuvio 2. Kaavamainen esitys (A) normaalista ja (B) kasvaimen verisuonistosta. Normaali kudos koostuu kypsistä, järjestäytyneistä verisuonista, kun taas kasvainkudos koostuu epäkypsistä, vuotavista ja mutkittelevista verisuonista. Kasvaimen verisuoniston muuttunut järjestäytyminen ja epäjärjestäytynyt lymfaattinen verkosto johtavat verisuonten vuotoon ja makromolekyylien (>40 kDa) kertymiseen interstitiumiin, ja sitä kutsutaan tehostetuksi permeaatio- ja retentioilmiöksi (enhanced permeation and retention, EPR). Mukailtu luvalla lähteestä Macmillan Publishers Ltd: Nature Medicine (Jain, 2001), copyright (2001).
Lisäksi useissa tutkimuksissa on ehdotettu, että kasvaimet ovat albumiinikatabolian paikka (Hradec, 1958; Andersson ym., 1991; Schilling ym., 1992; Stehle ym., 1997). Esimerkiksi hiiren sarkoomamallissa (C57/RL6J), johon injektoitiin 3H-raffinoosilla leimattua albumiinia, kasvainten lysosomeissa havaittiin vähintään 2-3-kertainen 3H-pitoisuus verrattuna normaalin kudoksen lysosomeihin (Andersson ym., 1991). Lisäksi tutkimukset ovat osoittaneet, että albumiinin puoliintumisaika on lyhyempi ja vaihtuvuus suurempi kasvainta kantavilla hiirillä, vaikka maksan albumiinisynteesi on kompensoivasti lisääntynyt, verrattuna ei-kasvainta kantaviin hiiriin (Hradec, 1958). Näin ollen on ehdotettu, että kasvaimet käyttävät albumiinia energialähteenä hajottamalla albumiinia lysosomeissa aminohapoiksi, joita syöpäsolut käyttävät kiihtyvään kasvuunsa (Stehle ym., 1997). Lisäksi tutkimuksissa on esitetty, että syöpäpotilailla ilmenevä hypoalbuminiemia on seurausta kasvaimen suorittamasta albumiinikataboliasta (Stehle ym., 1997).
Joissakin näistä aikaisemmista tutkimuksista on kuitenkin useita kokeellisia rajoituksia. Esimerkiksi puhtaiden lysosomaalisten fraktioiden saaminen on vaikeaa, ja siksi on tarpeen toistaa nämä tutkimukset ja testata fraktioiden puhtaus käyttäen vakiintuneita kalvo- ja organellimarkkereita (Graham, 2002; Yamagishi ym., 2013). Lisäksi useat muut in vivo -tekijät voivat vaikuttaa albumiinin hajoamiseen ja kataboliaan (esim. kortikosteroiditasot) (Peters, 1996). Näin ollen selkeää yhteyttä ei ole pystytty osoittamaan, ja tarvitaan lisää in vivo -tutkimuksia tukemaan albumiinin solunsisäistä jakautumista ja kataboliaa kasvaimissa.
Viime aikoina Commisso ym. havaitsivat, että syöpäsoluilla, joissa on endogeenisia onkogeenisiä Ras-mutaatioita, on lisääntynyt makropinosytoosi in vitro ja in vivo (Commisso ym., 2013). Lisäksi osoitettiin, että FITC-merkitty albumiini internalisoitui makropinosytoosin kautta ja johti sen jälkeen lisääntyneisiin glutamaatti- ja α-ketoglutaraattipitoisuuksiin onkogeenisen Ras-mutaation saaneissa soluissa (Commisso ym., 2013). Mielenkiintoista on, että onkogeenistä Rasia ilmentävien solujen proliferaation vähenemisen glutamiinin puutteen jälkeen osoitettiin pelastuvan solunulkoisen albumiinin lisäyksellä (Commisso et al., 2013). Nämä havainnot viittaavat siihen, että albumiinin makropinosytoosi tarjoaa ravintoaineita syöpäsolujen proliferaation ylläpitämiseksi (Commisso ym., 2013).
Sellulaariset albumiinia sitovat proteiinit
Albumiinin merkityksen vuoksi on tunnistettu useita oletettuja albumiinia sitovia proteiineja ja reseptoreita erilaisissa kudoksissa ja solulinjoissa (taulukko 1), mukaan lukien munuaiset (Zhai ym., 2000; Amsellem ym., 2010), endoteelissä (Schnitzer ja Bravo, 1993), fibroblasteissa (Porter ym., 1995) ja kasvainsolujen pinnoilla (Fritzsche ym., 2004). Erityisesti on löydetty seitsemän membraaniin assosioitunutta albumiinia, nimittäin: albondiini/glykoproteiini 60 (gp60) (Schnitzer ym., 1988), glykoproteiini 18 (gp18) (Ghinea ym., 1988), glykoproteiini 30 (gp30) (Ghinea ym., 1988), 1988), vastasyntyneiden Fc-reseptori (FcRn) (Roopenian ja Akilesh, 2007), heterogeeniset ydinribonukleoproteiinit (hnRNP:t) (Fritzsche ym., 2004), kalretikuliini (Fritzsche ym., 2004), kubiliini (Zhai ym., 2000; Amsellem ym., 2010) ja megaliini (Zhai ym., 2000; Amsellem ym., 2010). Lisäksi on tunnistettu erittynyt albumiinia sitova proteiini, joka tunnetaan nimellä secreted protein, acidic and rich in cysteine (SPARC) (Schnitzer ja Oh, 1992). Ottaen huomioon niiden merkityksen albumiinin ottamisessa soluihin kukin näistä proteiineista kuvataan yksityiskohtaisesti jäljempänä.

Taulukko 1. Proteiinien merkitys albumiinin ottamisessa soluihin. Albumiinia sitovien proteiinien ja reseptorien lokalisaatio.
Albondiini/gp60
Albondiini (gp60) on 60 kDa:n glykoproteiini, joka toimii albumiinireseptorina, joka on laajalti levinnyt, mutta ekspressoituu valikoivasti jatkuvan endoteelin plasmamembraanissa (aivoja lukuun ottamatta), jossa se toimii lisäämällä kapillaarien läpäisevyyttä (Ghinea ym, 1988, 1989; Schnitzer et al., 1988; Schnitzer, 1992; Schnitzer ja Oh, 1994; Tiruppathi et al., 1996). Albondiini ei ainoastaan sido spesifisesti natiivia albumiinia, vaan myös helpottaa sen internalisaatiota ja sitä seuraavaa transsytoosia (Milici ym., 1987; Schnitzer, 1992; Schnitzer ja Oh, 1994; Tiruppathi ym., 1996).
On ehdotettu, että ~50 % albumiinista poistuu kapillaarien luumenista albondiinin välityksellä, ja loppuosa läpäisee tämän esteen solujen välisten yhteyksien ja / tai nestemäisen faasin mekanismien kautta (Schnitzer, 1993; Schnitzer ja Oh, 1994). Lisäksi on osoitettu, että albondiinin internalisaatio tapahtuu kaveoliini-riippuvaisen endosytoottisen prosessin kautta, joka johtaa transsytoosiin eikä näytä pääsevän hajoavaan endosomi-lysosomijärjestelmään (Schnitzer, 1993; Schnitzer ja Bravo, 1993; Schnitzer ym., 1995; Tiruppathi ym., 1997; Iancu ym., 1997), 2011).
gp18 ja gp30
Kumpikin gp18 ja gp30 sitovat innokkaasti konformaatiomodifioitua albumiinia (ts, kultaleimattua albumiinia, formaldehydillä tai maleiinianhydridillä käsiteltyä albumiinia), eivätkä ne ole ensisijaisesti vuorovaikutuksessa natiivialbumiinin kanssa samaan tapaan kuin muut tunnetut scavenger-reseptorit (Ghinea et al., 1989; Schnitzer ja Oh, 1992, 1994; Schnitzer et al., 1992; Schnitzer ja Bravo, 1993). Toisin kuin albondiinia, gp18:aa ja gp30:aa esiintyy erilaisissa soluissa, kuten makrofageissa ja fibroblasteissa, sekä erilaisissa endoteeleissa (Schnitzer ym., 1992). Lisäksi gp18:n on havaittu ilmentyvän ihmisen MDA-MB-453-rintasyöpäsoluissa (Wang et al., 1994). Nämä scavenger-reseptorit sitovat ja ohjaavat modifioituja albumiineja hajotettavaksi, ehkä osana proteiinikataboliaa tai suojareittinä, joka poistaa muuttuneet, vanhat, vaurioituneet tai mahdollisesti haitalliset albumiinit (Schnitzer, 1993; Schnitzer ja Bravo, 1993). Albumiini voi muuttua hapettumisen, ei-entsymaattisen glykaation, maleylaation jne. kautta normaalin vanhenemisen seurauksena tai suojaavana tai patologisena reaktiona (Schnitzer, 1993; Peters, 1996). Denaturoitu tai modifioitu albumiini hajoaa nopeammin ja tehokkaammin kuin natiivialbumiini, mikä viittaa siihen, että nämä muutokset valitsevat albumiinimolekyylit hajotettaviksi (Peters, 1996).
SPARC
SPARC tunnetaan myös nimillä osteonektiini ja BM-40, ja sitä erittävät useat solutyypit (Brekken ja Sage, 2001). Mielenkiintoista on, että SPARC:n on havaittu ilmentyvän voimakkaasti pahanlaatuisissa soluissa ja stroomasoluissa, jotka liittyvät neoplasiaan (Porter ym., 1995; Podhajcer ym., 2008). SPARC:llä on albumiinia sitovia ominaisuuksia, ja se on spesifisesti vuorovaikutuksessa natiivialbumiinin kanssa samalla tavalla kuin albondiini, mutta eroaa 18 gp30:stä, joka sitoo konformaatiomuutoksessa olevaa albumiinia (Schnitzer ja Oh, 1992). Erityisesti SPARC-vasta-aineet tunnistavat myös albondiinia, mutta eivät 18:aa tai gp30:aa, mikä viittaa siihen, että SPARC:llä ja albondiinilla on yhteinen natiivia albumiinia sitova domeeni (Schnitzer ja Oh, 1992). Ei kuitenkaan ole todisteita siitä, että SPARC välittäisi albumiinin ottoa kasvaimiin. On esitetty, että SPARC:n kyky sitoa albumiinia kasvaimen interstitiumissa lisää albumiiniin sitoutuneiden lääkkeiden kertymistä kasvaintilaan (Desai ym., 2008, 2009). Lisäksi alustava kliininen tutkimus osoitti, että SPARC:n ilmentyminen korreloi vasteen kanssa paklitakselilla ladatun albumiini-nanohiukkasen (nab-paklitakseli tai Abraxane®) hoitoon, ja SPARC-positiivisilla potilailla oli parempi kliininen lopputulos (Desai ym., 2009). Ristiriitaiset tiedot KPfC-hiirimallissa ovat kuitenkin kyseenalaistaneet tämän hypoteesin, sillä SPARC-puutos ei muuttanut Abraxane®:n kasvainsisäisiä pitoisuuksia (Neesse ym., 2014). Näin ollen tarvitaan lisätutkimuksia tämän hypoteesin validoimiseksi, mukaan lukien suuremmat kliiniset tutkimukset, joihin osallistuu suurempi määrä potilaita. Parhaillaan arvioidaan National Cancer Instituten vaiheen III tutkimuksessa (NCT00785291) sitä, ennustaako SPARC:n ilmentyminen seerumissa potilaiden vastetta Abraxane® -valmisteelle, ja tämä voi lisätä ymmärrystämme SPARC:n roolista albumiinin kertymisessä kasvaimiin.
hnRNP:t ja kalretikuliini
Viisi erilaista albumiiniin sitoutunutta proteiinia on tunnistettu ihmisen syöpäsolulinjojen plasmamembraaneista (esim, CCRF-CEM T-soluleukemia, MV3 melanooma ja MCF7 rintasyöpä) (Fritzsche et al., 2004). Neljä näistä proteiineista tunnistettiin hnRNP-perheen jäseniksi, mukaan lukien hnRNP A2/B1, hnRNP C1, hnRNP A1 ja hnRNP A3, ja viidennen proteiinin todettiin olevan kalretikuliini (Fritzsche et al., 2004). Kalretikuliini kuvattiin ensin endoplasmisen retikulumin chaperoniksi ja kalsiumsignaaliproteiiniksi, mutta sittemmin sen on osoitettu osallistuvan useisiin solutoimintoihin, kuten solujen adheesioon, verihiutaleiden ja kollageenin vuorovaikutuksen modulointiin (haavan paraneminen) ja apoptoosiin (Mendlovic ja Conconi, 2010). hnRNP-perheen tehtävät eivät ole hyvin tunnettuja. Useimmat hnRNP-perheen jäsenet on kuitenkin kuvattu ydin-RNA:ta sitoviksi proteiineiksi, jotka osallistuvat pre-mRNA:n prosessointiin, kuten RNA:n pilkkomiseen, vientiin ja stabiilisuuteen (Chaudhury ym., 2010). Mielenkiintoista on, että hnRNP:llä on ehdotettu olevan rooli karsinogeneesissä, jossa niiden yli-ilmentyminen toimii biomarkkereina kasvainten varhaisessa havaitsemisessa (Han et al., 2013). Näiden löydösten merkitys on tällä hetkellä epäselvä, ja on vielä selvitettävä, ovatko nämä proteiinit osallisina albumiinivälitteisessä imeytymisessä.
FcRn
FcRn ilmentyy useissa solutyypeissä ja kudoksissa, mukaan lukien antigeenejä esittelevissä soluissa, verisuonten endoteelissä, suolistossa, keuhkoissa, munuaisissa ja veri-aivoesteessä (BBB, blood-brain barrier) (ks. esim, endoteeli ja suonikalvopleksus) (Roopenian ja Akilesh, 2007). Tämä reseptori suojaa albumiinia ja IgG:tä hajoamiselta sitoutumalla molempiin proteiineihin suurella affiniteetilla vain matalassa pH:ssa (pH < 6,5) happamissa endosomeissa, estäen niiden hajoamisen lysosomaalisen reitin kautta ja palauttamalla ne solunulkoiseen tilaan (pH 7,4) (Chaudhury ym., 2003; Ober ym., 2004; Anderson ym., 2006; Andersen ym., 2012). Tämä pidentää näin ollen seerumin albumiinin puoliintumisaikaa (Chaudhury et al., 2003; Anderson et al., 2006; Sarav et al., 2009). Tämän reseptorin rooli albumiinin ottamisessa kasvaimiin on edelleen epäselvä.
Kubiliini ja megaliini
Kubiliini on moniliigaattorireseptori, joka on tunnetuin siitä, että se osallistuu B12-vitamiinikompleksin intrinsic factor -kompleksin imeytymiseen suolistoon (Seetharam ym., 1997). Lisäksi kubilinin on osoitettu osallistuvan lukuisten ligandien, kuten albumiinin, endosytoosiin ja transsolulaariseen kuljetukseen (Birn ym., 2000). Kubiliini on lokalisoitunut imukykyisiin suolistosoluihin, istukkaan, viskeraalisiin keltarauhassoluihin ja munuaisten proksimaalisiin tubuluksiin (Christensen ja Birn, 2002). Megalin on suuri transmembraaninen proteiini, jonka on myös osoitettu sitovan albumiinia (Cui ym., 1996). Tämä proteiini ilmentyy laajemmin kuin kubiliini, sillä sitä esiintyy mm. suonikalvopleksuksessa, munuaisten proksimaalisissa tubulussoluissa ja kilpirauhassoluissa. (Taulukko 1) (Christensen ja Birn, 2002).
Mielenkiintoista on, että megaliini sitoutuu kubiliiniin suurella affiniteetilla, ja on ehdotettu, että megaliini edistää kubiliini-ligandi-kompleksien sisäistymistä yhteisreseptorina (Moestrup ym., 1998; Christensen ja Birn, 2002). Lisäksi kubiliini sitoo myös amnionless-proteiinia, joka on välttämätön kubiliinin ilmentymiselle solukalvolla (Amsellem ym., 2010). Kubilinilla on yhdessä megaliinin kanssa olennainen rooli albumiinin ottamisessa (eli takaisinimeytymisessä) munuaisten proksimaalisiin tubuluksiin (Zhai ym., 2000; Amsellem ym., 2010). Kubiliinin ja/tai megaliinin puutteen hiirillä ja koirilla on osoitettu aiheuttavan albumiinin imeytymisen vähenemistä proksimaalisessa tubuluksessa, mikä johtaa albumiinuriaan (Birn ym., 2000; Amsellem ym., 2010). Lisäksi potilaat, joilla on Imerslund-Gräsbeckin oireyhtymä, joka johtuu mutaatiosta kubiliinigeenissä, kärsivät yleensä proteinureasta, mikä osoittaa kubiliinin merkityksen proteiinien reabsorptiossa munuaisissa (Grasbeck, 2006).
Albumiini lääkeaineen kuljettajana onkologiassa
Valbumiinin tehostettu permeaatio- ja retentiovaikutus sekä albumiinin kertyminen kasvaimen interstitiumiin huomioon ottaen albumiinin kehittämistä lääkeaineen kuljettajana on yhä tärkeämpää harkita syöpähoidon kohdennetun annostelun kannalta (Kratz, 2008, 2010). On myös ehdotettu, että albumiinikantajat hyödyntävät albumiinin läsnäoloa endoteelissä ja SPARC:n läsnäoloa kasvainten välitilassa ja lisäävät lääkkeiden kertymistä kasvaintilaan (Desai ym., 2009; Kratz, 2010). Albumiinilla on kehitetty erilaisia lääkeainejakelujärjestelmiä, kuten albumiini-nanohiukkasia, lääkealbumiinikonjugaatteja, albumiinia sitovia lääkeainejohdannaisia ja aihiolääkkeitä (katsaukset ks. Kratz, 2008, 2010).
Paklitakselilla ladatun albumiini-nanohiukkasen, nab-paklitakselin tai Abraxane®:n, kehittäminen ja markkinahyväksyntä oli merkittävä läpimurto albumiinikantoaineiden kehittämisen alalla. Abraxane® hyväksyttiin alun perin kliiniseen käyttöön Yhdysvalloissa vuonna 2005 (Kudlowitz ja Muggia, 2014). Tämä albumiini-nanohiukkanen on tarkoitettu metastaattisen rintasyövän hoitoon yhdistelmäkemoterapian epäonnistuttua (Kudlowitz ja Muggia, 2014). Viime aikoina Abraxane® on kuvattu myös haiman metastaattista adenokarsinoomaa sairastavien potilaiden ensilinjan hoitoon yhdessä gemsitabiinin kanssa ja paikallisesti edennyttä tai metastaattista ei-pienisoluista keuhkosyöpää sairastavien potilaiden hoitoon yhdessä karboplatiinin kanssa (Kudlowitz ja Muggia, 2014). Abraxane®:lla on suurempi terapeuttinen indeksi kuin pelkällä paklitakselilla, sillä sitä voidaan antaa suurempina annoksina pienemmällä toksisuudella ja paremmalla teholla kuin perinteistä paklitakselihoitoa (Gradishar ym., 2005; Socinski ym., 2012; Iwamoto, 2013). Abraxane®-valmistetta arvioidaan parhaillaan edelleen kliinisissä tutkimuksissa muiden kasvainten, kuten virtsarakon syövän (NCT00583349) ja multippelin myelooman (NCT02075021), hoidossa.
Lisäksi arvioidaan albumiiniin sitoutumista yleisenä lääkkeiden farmakokinetiikkaa parantavana strategiana. Perinteisesti lääkkeen sitoutumisen albumiiniin uskotaan vähentävän vapaan lääkkeen määrää, joka on käytettävissä sen terapeuttisen vaikutuksen toteuttamiseen (Lancon ym., 2004; Vuignier ym., 2010). Tutkimukset ovat kuitenkin osoittaneet myös mekanismeja, joilla albumiini vaikuttaa tehokkaasti terapeuttista käyttöä parantavasti tai nopeaa puhdistumaa vähentävästi (Dennis ym., 2002; Merlot ja Richardson, 2014). Esimerkiksi kokeellisen syövänvastaisen tiosemikarbatsonin, nimittäin di-2-pyridyyliketoni-4,4-dimetyyli-3-tiosemikarbatsonin (Dp44mT) (Merlot ym., 2013a), on osoitettu internalisoituvan syöpäsoluihin oletetun kantaja/reseptorin kautta (Merlot ym., 2013b; Merlot ja Richardson, 2014). Mielenkiintoista on, että Dp44mT:n imeytyminen, toksisuus ja apoptoottinen aktiivisuus tehostuvat huomattavasti HSA:n läsnäollessa (Merlot ja Richardson, 2014). Kun otetaan huomioon, että Dp44mT kohdistuu lysosomeihin apoptoosin indusoimiseksi (Lovejoy ym., 2011) ja että HSA käy mahdollisesti läpi lysosomaalisen katabolian kasvaimissa (Andersson ym., 1991; Stehle ym., 1997), voidaan olettaa, että HSA helpottaa Dp44mT:n kulkeutumista lysosomeihin, mikä lisää sen syöpää ehkäisevää vaikutusta (Merlot ja Richardson, 2014). Vaikka tutkimuksissa ei ole vielä tunnistettu HSA:n stimuloiman ottoprosessin tarkkaa mekanismia, albumiiniin sitoutuminen voi tarjota etua tuotettaessa kasvaimiin kohdistuvia aineita, ja tämä vaatii edelleen intensiivistä tutkimusta.
Tulokset
Albumiini on monipuolinen ja kiehtova proteiini. Kun otetaan huomioon albumiinin suuri sulkeutuminen verisuoni- ja interstitiaaliseen tilaan, albumiinin solunsisäinen jakautuminen on pysynyt huonosti karakterisoituna monien vuosien ajan. Voi olla mahdollista, että tietyissä olosuhteissa tai solustressin aikana albumiinia kulkeutuu normaaleihin soluihin matalina ja kasvainsoluihin korkeina pitoisuuksina, mikä johtuu niiden aineenvaihduntanopeudesta. Joidenkin puutteellisesti karakterisoitujen albumiinia sitovien proteiinien (esim. hnRNP:t ja kalretikuliini) tarkka rooli albumiinin ottamisen välittäjinä on vielä selvittämättä. Albumiinia sitovien proteiinien etsiminen ja karakterisointi erityisesti syöpäsoluissa on kuitenkin erittäin kiinnostavaa, kun otetaan huomioon albumiinin kehittäminen tehokkaaksi lääkeaineen kuljettajaksi kasvaimiin kohdistamiseksi.
Kiinnostusristiriitoja koskeva lausunto
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Angelica M. Merlot on saanut Sydneyn yliopiston myöntämän varhaisen uran tutkimusapurahan. Des R. Richardson on National Health and Medical Research Councilin (NHMRC) Senior Principal Research Fellowship -apurahan ja projektiavustusten saaja. Danuta S. Kalinowski on saanut NHMRC:n hankeapurahan (1048972) ja Sydneyn yliopiston Sydneyn lääketieteellisen koulun säätiön Helen and Robert Ellis Fellowship -apurahan.
Amsellem, S., Gburek, J., Hamard, G., Nielsen, R., Willnow, T. E., Devuyst, O., et al. (2010). Kubiliini on välttämätön albumiinin takaisinimeytymiselle munuaisten proksimaalisessa tubuluksessa. J. Am. Soc. Nephrol. 21, 1859-1867. doi: 10.1681/ASN.2010050492
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Andersen, J. T., Dalhus, B., Cameron, J., Daba, M. B., Plumridge, A., Evans, L., et al. (2012). Rakenteeseen perustuva mutageneesi paljastaa vastasyntyneen Fc-reseptorin albumiinia sitovan paikan. Nat. Commun. 3, 610. doi: 10.1038/ncomms1607
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Anderson, C. L., Chaudhury, C., Kim, J., Bronson, C. L., Wani, M. A. ja Mohanty, S. (2006). Perspektiivi-FcRn kuljettaa albumiinia: merkitys immunologian ja lääketieteen kannalta. Trends Immunol. 27, 343-348. doi: 10.1016/j.it.2006.05.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Andersson, C., Iresjo, B. M., and Lundholm, K. (1991). Albumiinin lisääntyneen hajoamisen kudospaikkojen tunnistaminen sarkoomaa kantavilla hiirillä. J. Surg. Res. 50, 156-162. doi: 10.1016/0022-4804(91)90240-M
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Birn, H., Fyfe, J. C., Jacobsen, C., Mounier, F., Verroust, P. J., Orskov, H., et al. (2000). Cubilin on albumiinia sitova proteiini, joka on tärkeä munuaisten tubulaariselle albumiinin takaisinimeytymiselle. J. Clin. Invest. 105, 1353-1361. doi: 10.1172/JCI8862
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brekken, R. A., and Sage, E. H. (2001). SPARC, matriksellulaarinen proteiini: solun ja matriisin välisen kommunikaation risteyskohdassa. Matrix Biol. 19, 816-827. doi: 10.1016/S0945-053X(00)00133-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Carmeliet, P., ja Jain, R. K. (2000). Angiogeneesi syövässä ja muissa sairauksissa. Nature 407, 249-257. doi: 10.1038/35025220
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chaudhury, A., Chander, P., and Howe, P. H. (2010). Heterogeeniset ydinribonukleoproteiinit (hnRNP:t) soluprosesseissa: keskittyminen hnRNP E1:n monitoimisiin säätelyrooleihin. RNA 16, 1449-1462. doi: 10.1261/rna.2254110
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chaudhury, C., Mehnaz, S., Robinson, J. M., Hayton, W. L., Pearl, D. K., Roopenian, D. C., et al. (2003). Päähistokompatibiliteettikompleksiin liittyvä IgG:n Fc-reseptori (FcRn) sitoo albumiinia ja pidentää sen elinikää. J. Exp. Med. 197, 315-322. doi: 10.1084/jem.20021829
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christensen, E. I., and Birn, H. (2002). Megalin ja cubilin: monitoimiset endosyyttiset reseptorit. Nat. Rev. Mol. Cell Biol. 3, 256-266. doi: 10.1038/nrm778
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Commisso, C., Davidson, S. M., Soydaner-Azeloglu, R. G., Parker, S. J., Kamphorst, J. J., Hackett, S., et al. (2013). Proteiinin makropinosytoosi on aminohappojen toimitusreitti Ras-transformoituneissa soluissa. Nature 497, 633-637. doi: 10.1038/nature12138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | CrossRef Full Text
Cui, S., Verroust, P. J., Moestrup, S. K., and Christensen, E. I. (1996). Megalin/gp330 välittää albumiinin ottoa munuaisten proksimaalisessa tubuluksessa. Am. J. Physiol. 271, F900-F907. doi: 10.1038/nature12138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dennis, M. S., Zhang, M., Meng, Y. G., Kadkhodayan, M., Kirchhofer, D., Combs, D., et al. (2002). Albumiinin sitoutuminen yleisenä strategiana proteiinien farmakokinetiikan parantamiseksi. J. Biol. Chem. 277, 35035-35043. doi: 10.1074/jbc.M205854200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Desai, N., Trieu, V., Damascelli, B. ja Soon-Shiong, P. (2009). SPARC-ekspressio korreloi kasvainvasteen kanssa albumiiniin sitoutuneelle paklitakselille pään ja kaulan alueen syöpäpotilailla. Transl. Oncol. 2, 59-64. doi: 10.1593/tlo.09109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Desai, N. P., Trieu, V., Hwang, L. Y., Wu, R., Soon-Shiong, P. ja Gradishar, W. J. (2008). Nanohiukkasalbumiiniin sitoutuneen (nab) paklitakselin parempi teho verrattuna polysorbaattipohjaiseen doketakseliin useissa ksenotransplanteissa HER2- ja SPARC-statuksen funktiona. Anticancer Drugs 19, 899-909. doi: 10.1097/CAD.0b013e32830f9046
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Evans, T. W. (2002). Katsausartikkeli: albumiini lääkkeenä – albumiinin biologiset vaikutukset, jotka eivät liity onkoottiseen paineeseen. Aliment. Pharmacol. Ther. 16(Suppl. 5), 6-11. doi: 10.1046/j.1365-2036.2002.00190.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fritzsche, T., Schnolzer, M., Fiedler, S., Weigand, M., Wiessler, M. ja Frei, E. (2004). Heterogeenisten ydinribonukleoproteiinien (hnRNP) eristäminen ja tunnistaminen ihmisen kasvainsolulinjojen puhdistetuista plasmakalvoista albumiinia sitovina proteiineina. Biochem. Pharmacol. 67, 655-665. doi: 10.1016/j.bcp.2003.09.027
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ghinea, N., Eskenasy, M., Simionescu, M. ja Simionescu, N. (1989). Endoteelin albumiinia sitovat proteiinit ovat solun pinnalla altistuvia kalvoassosioituneita komponentteja. J. Biol. Chem. 264, 4755-4758.
Pubmed Abstract | Pubmed Full Text
Ghinea, N., Fixman, A., Alexandru, D., Popov, D., Hasu, M., Ghitescu, L., et al. (1988). Albumiinia sitovien proteiinien tunnistaminen kapillaarien endoteelisoluissa. J. Cell Biol. 107, 231-239.
Pubmed Abstract | Pubmed Full Text
Gradishar, W. J., Tjulandin, S., Davidson, N., Shaw, H., Desai, N., Bhar, P., et al. (2005). Vaiheen III tutkimus nanohiukkasalbumiiniin sitoutuneella paklitakselilla verrattuna polyetyloituun risiiniöljypohjaiseen paklitakseliin rintasyöpää sairastavilla naisilla. J. Clin. Oncol. 23, 7794-7803. doi: 10.1200/JCO.2005.04.937
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Graham, J. M. (2002). Raakojen alisolufraktioiden valmistaminen differentiaalisella sentrifugoinnilla. ScientificWorldJournal 2, 1638-1642. doi: 10.1100/tsw.2002.851
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Grasbeck, R. (2006). Imerslund-Grasbeckin oireyhtymä (selektiivinen B(12)-vitamiinin imeytymishäiriö ja proteinuria). Orphanet. J. Rare Dis. 1:17. doi: 10.1186/1750-1172-1-17
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Greish, K. (2007). Makromolekulaaristen lääkkeiden tehostunut läpäisevyys ja pidättyminen kiinteissä kasvaimissa: kuninkaallinen portti kohdennetuille syövänvastaisille nanomedikaaleille. J. Drug Target. 15, 457-464. doi: 10.1080/10611860701539584
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Han, N., Li, W., and Zhang, M. (2013). RNA:ta sitovan proteiinin hnRNP:n tehtävä syövän metastaasissa. J. Cancer Res. Ther. 9(Suppl.), S129-S134. doi: 10.4103/0973-1482.122506
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hawkins, J. W., and Dugaiczyk, A. (1982). Ihmisen seerumin albumiinigeeni: ainutlaatuisen lokuksen rakenne. Gene 19, 55-58. doi: 10.1016/0378-1119(82)90188-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
He, X. M., and Carter, D. C. (1992). Ihmisen seerumin albumiinin atomirakenne ja kemia. Nature 358, 209-215. doi: 10.1038/358209a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hradec, J. (1958). Seerumin albumiinin aineenvaihdunta kasvaimia kantavilla rotilla. Br. J. Cancer 12, 290-304. doi: 10.1038/bjc.1958.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Iancu, C., Mocan, L., Bele, C., Orza, A. I., Tabaran, F. A., Catoi, C., et al. (2011). Tehostettu laserlämpöablaatio maksasyövän in vitro -hoidossa toimittamalla spesifisesti moniseinäisiä hiilinanoputkia, jotka on funktionalisoitu ihmisen seerumin albumiinilla. Int. J. Nanomed. 6, 129-141. doi: 10.2147/IJN.S15841
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Iwamoto, T. (2013). Lääkeannostelujärjestelmien kliininen käyttö syövän kemoterapiassa: katsaus hyväksyttyjen lääkkeiden tehoon ja sivuvaikutuksiin. Biol. Pharm. Bull. 36, 715-718. doi: 10.1248/bpb.b12-01102
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jain, R. K. (2001). Kasvaimen verisuoniston normalisointi anti-angiogeenisellä hoidolla: uusi paradigma yhdistelmähoidolle. Nat. Med. 7, 987-989. doi: 10.1038/nm0901-987
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kragh-Hansen, U. (1981). Molekulaarisia näkökohtia ligandien sitoutumisesta seerumin albumiiniin. Pharmacol. Rev. 33, 17-53. doi: 10.1038/nm0901-987
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kratz, F. (2008). Albumiini lääkkeen kantajana: aihiolääkkeiden, lääkekonjugaattien ja nanohiukkasten suunnittelu. J. Control. Release 132, 171-183. doi: 10.1016/j.jconrel.2008.05.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kratz, F. (2010). Albumiini, monipuolinen kantaja onkologiassa. Int. J. Clin. Pharmacol. Ther. 48, 453-455. doi: 10.5414/CPP48453
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kudlowitz, D., and Muggia, F. (2014). Nanopartikkelialbumiiniin sitoutunut paklitakseli (nab-paklitakseli): käyttöaiheiden laajentaminen. Expert Opin. Drug Saf. 13, 681-685. doi: 10.1517/14740338.2014.910193
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lancon, A., Delmas, D., Osman, H., Thenot, J. P., Jannin, B., and Latruffe, N. (2004). Ihmisen maksasolujen resveratrolin imeytyminen: sekä passiivisen diffuusion että kuljettajavälitteisen prosessin osallistuminen. Biochem. Biophys. Res. Comm. 316, 1132-1137. doi: 10.1016/j.bbrc.2004.02.164
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lovejoy, D. B., Jansson, P. J., Brunk, U. T., Wong, J., Ponka, P. ja Richardson, D. R. (2011). Metalleja koteloivan Dp44mT-yhdisteen kasvainvastainen aktiivisuus välittyy lysosomeihin kertyvän redox-aktiivisen kuparikompleksin muodostumisen kautta. Cancer Res. 71, 5871-5880. doi: 10.1158/0008-5472.CAN-11-1218
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maeda, H., Wu, J., Sawa, T., Matsumura, Y. ja Hori, K. (2000). Kasvaimen verisuonten läpäisevyys ja EPR-ilmiö makromolekyyliterapioissa: katsaus. J. Control. Release 65, 271-284. doi: 10.1016/S0168-3659(99)00248-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Matsumura, Y., and Maeda, H. (1986). Uusi konsepti makromolekyyliterapeuttisille lääkkeille syövän kemoterapiassa: proteiinien ja kasvainvastaisen aineen smancsin kasvaintrooppisen kertymisen mekanismi. Cancer Res. 46, 6387-6392.
Pubmed Abstract | Pubmed Full Text
Mendlovic, F., and Conconi, M. (2010). Kalretikuliini: monipuolinen proteiini. Nature Educ. 4, 1.
Merlot, A. M., Kalinowski, D. S., ja Richardson, D. R. (2013a). Uudet kelaattorit syövän hoidossa: missä mennään nyt? Antioxid. Redox Signal. 18, 973-1006. doi: 10.1089/ars.2012.4540
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Merlot, A. M., Pantarat, N., Menezes, S. V., Sahni, S., Richardson, D. R. ja Kalinowski, D. S. (2013b). Kasvainvastainen aine Dp44mT:n solukäyttöönotto tapahtuu kantaja/reseptorivälitteisen mekanismin kautta. Mol. Pharmacol. 84, 911-924. doi: 10.1124/mol.113.088393
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Merlot, A. M., and Richardson, D. R. (2014). Reseptoritunnistus ja lysosomaalinen kohdentaminen rautaa ja kuparia sitovien uusien syöpälääkkeiden sytotoksisuuden parantamiseksi. Vitam. Miner. 3:e125. doi: 10.4172/vms.1000e125
CrossRef Full Text
Milici, A. J., Watrous, N. E., Stukenbrok, H., ja Palade, G. E. (1987). Albumiinin transsytoosi kapillaarien endoteelissä. J. Cell Biol. 105, 2603-2612.
Pubmed Abstract | Pubmed Full Text
Moestrup, S. K., Kozyraki, R., Kristiansen, M., Kaysen, J. H., Rasmussen, H. H., Brault, D., et al. (1998). Intrinsic factor-vitamin B12 -reseptori ja teratogeenisten vasta-aineiden kohde on megaliinia sitova perifeerinen kalvoproteiini, jolla on homologiaa kehitysproteiineille. J. Biol. Chem. 273, 5235-5242. doi: 10.1074/jbc.273.9.5235
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Neesse, A., Frese, K. K., Chan, D. S., Bapiro, T. E., Howat, W. J., Richards, F. M., et al. (2014). SPARC-riippumaton lääkeannostelu ja nab-paklitakselin kasvainvastainen vaikutus geneettisesti muunnetuissa hiirissä. Gut 63, 974-983. doi: 10.1136/gutjnl-2013-305559
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ober, R. J., Martinez, C., Lai, X., Zhou, J., and Ward, E. S. (2004). IgG:n eksosytoosi reseptorin, FcRn:n välittämänä: analyysi yhden molekyylin tasolla. Proc. Natl. Acad. Sci. U.S.A. 101, 11076-11081. doi: 10.1073/pnas.0402970101
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Peters, T. (1996). Kaikki albumiinista: Biokemia, genetiikka ja lääketieteelliset sovellukset. San Diego, CA: Academic Press Limited.
Peterson, H. I., and Appelgren, K. L. (1973). Kokeelliset tutkimukset leimattujen proteiinien imeytymisestä ja vuokrautumisesta rotan kasvaimessa. Eur. J. Cancer 9, 543-547. doi: 10.1016/0014-2964(73)90142-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Podhajcer, O. L., Benedetti, L. G., Girotti, M. R., Prada, F., Salvatierra, E., and Llera, A. S. (2008). Matrisellulaarisen proteiinin SPARC rooli kasvaimen ja isännän välisessä dynaamisessa vuorovaikutuksessa. Cancer Metastasis Rev. 27, 691-705. doi: 10.1007/s10555-008-9146-7
CrossRef Full Text
Porter, P. L., Sage, E. H., Lane, T. F., Funk, S. E., ja Gown, A. M. (1995). SPARC:n jakautuminen normaalissa ja neoplastisessa ihmiskudoksessa. J. Histochem. Cytochem. 43, 791-800. doi: 10.1177/43.8.7622842
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roopenian, D. C., and Akilesh, S. (2007). FcRn: vastasyntyneen Fc-reseptori tulee täysi-ikäiseksi. Nat. Rev. Immunol. 7, 715-725. doi: 10.1038/nri2155
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sarav, M., Wang, Y., Hack, B. K., Chang, A., Jensen, M., Bao, L., et al. (2009). Munuaisten FcRn ottaa albumiinia takaisin, mutta helpottaa IgG:n eliminaatiota. J. Am. Soc. Nephrol. 20, 1941-1952. doi: 10.1681/ASN.2008090976
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schilling, U., Friedrich, E. A., Sinn, H., Schrenk, H. H., Clorius, J. H. ja Maier-Borst, W. (1992). Yhdisteiden suunnittelu, joilla on tehostettu kasvainten imeytyminen, käyttäen seerumin albumiinia kantaja-aineena – Osa II. In vivo -tutkimukset. Int. J. Rad. Appl. Instrum. B 19, 685-695. doi: 10.1016/0883-2897(92)90103-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E. (1992). gp60 on albumiinia sitova glykoproteiini, jota ilmentää jatkuva endoteeli ja joka on osallisena albumiinin transsytoosissa. Am. J. Physiol. 262, H246-H254. doi: 10.1016/1050-1738(93)90012-U
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E. (1993). Päivitys kapillaarien läpäisevyyden solu- ja molekyyliperustasta. Trends Cardiovasc. Med. 3, 124-130. doi: 10.1016/1050-1738(93)90012-U
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E., Allard, J., and Oh, P. (1995). NEM estää transsytoosia, endosytoosia ja kapillaarien läpäisevyyttä: caveolae-fuusion merkitys endoteelissa. Am. J. Physiol. 268, H48-H55.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., and Bravo, J. (1993). Korkean affiniteetin sitoutuminen, endosytoosi ja konformatiivisesti muunnettujen albumiinien hajoaminen. gp30:n ja gp18:n mahdollinen rooli uusina scavenger-reseptoreina. J. Biol. Chem. 268, 7562-7570.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., Carley, W. W., and Palade, G. E. (1988). Albumiini vuorovaikuttaa spesifisesti 60 kDa:n mikrovaskulaarisen endoteelin glykoproteiinin kanssa. Proc. Natl. Acad. Sci. U.S.A. 85, 6773-6777. doi: 10.1073/pnas.85.18.6773
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E., and Oh, P. (1992). SPARC-vasta-aineet estävät albumiinin sitoutumista SPARC:iin, gp60:een ja mikrovaskulaariseen endoteeliin. Am. J. Physiol. 263, H1872-H1879.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., and Oh, P. (1994). Albondiinivälitteinen kapillaarien läpäisevyys albumiinille. Reseptorien erilainen rooli natiivien ja modifioitujen albumiinien endosytoosissa ja endosytoosissa endoteelissä. J. Biol. Chem. 269, 6072-6082.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., Sung, A., Horvat, R., and Bravo, J. (1992). Albumiinia sitovien proteiinien, gp30:n ja gp18:n, etuoikeutettu vuorovaikutus konformatiivisesti muunnettujen albumiinien kanssa. Esiintyminen monissa soluissa ja kudoksissa ja mahdollinen rooli kataboliassa. J. Biol. Chem. 267, 24544-24553.
Pubmed Abstract | Pubmed Full Text
Seetharam, B., Christensen, E. I., Moestrup, S. K., Hammond, T. G., and Verroust, P. J. (1997). Teratogeenisten vasta-aineiden rotan keltarauhasen kohdeproteiinin, gp280:n, tunnistaminen intrinsic factor-kobalamiinireseptoriksi. J. Clin. Invest. 99, 2317-2322. doi: 10.1172/JCI119411
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sinn, H., Schrenk, H. H., Friedrich, E. A., Schilling, U. ja Maier-Borst, W. (1990). Yhdisteiden suunnittelu, joilla on tehostettu kasvainten imeytyminen, käyttäen seerumialbumiinia kantaja-aineena. Osa I. Int. J. Rad. Appl. Instrum. B 17, 819-827. doi: 10.1016/0883-2897(92)90103-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Socinski, M. A., Bondarenko, I., Karaseva, N. A., Makhson, A. M., Vynnytshenko, I., Okamoto, I., et al. (2012). Viikoittainen nab-paklitakseli yhdessä karboplatiinin kanssa verrattuna liuotinpohjaiseen paklitakseliin ja karboplatiiniin ensilinjan hoitona potilailla, joilla on pitkälle edennyt ei-pienisoluinen keuhkosyöpä: vaiheen III tutkimuksen lopulliset tulokset. J. Clin. Oncol. 30, 2055-2062. doi: 10.1200/JCO.2011.39.5848
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stehle, G., Sinn, H., Wunder, A., Schrenk, H. H., Stewart, J. C., Hartung, G., et al. (1997). Plasman proteiinien (albumiinin) katabolia kasvaimen itsensä toimesta – vaikutukset kasvaimen aineenvaihduntaan ja kakeksian syntyyn. Crit. Rev. Oncol. Hematol. 26, 77-100. doi: 10.1016/S1040-8428(97)00015-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sudlow, G., Birkett, D. J., and Wade, D. N. (1976). Ihmisen seerumin albumiinin spesifisten lääkeaineiden sitoutumiskohtien tarkempi karakterisointi. Mol. Pharmacol. 12, 1052-1061.
Pubmed Abstract | Pubmed Full Text
Sugio, S., Kashima, A., Mochizuki, S., Noda, M. ja Kobayashi, K. (1999). Ihmisen seerumin albumiinin kiderakenne 2,5 A:n resoluutiolla. Protein Eng. 12, 439-446. doi: 10.1093/protein/12.6.439
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiruppathi, C., Finnegan, A., ja Malik, A. B. (1996). Solupinnan albumiinia sitovan proteiinin eristäminen ja karakterisointi verisuonten endoteelisoluista. Proc. Natl. Acad. Sci. U.S.A. 93, 250-254. doi: 10.1073/pnas.93.1.250
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiruppathi, C., Song, W., Bergenfeldt, M., Sass, P., ja Malik, A. B. (1997). Gp60:n aktivaatio välittää albumiinin transsytoosia endoteelisoluissa tyrosiinikinaasi-riippuvaisella reitillä. J. Biol. Chem. 272, 25968-25975. doi: 10.1074/jbc.272.41.25968
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
van der Veldt, A. A., Luurtsema, G., Lubberink, M., Lammertsma, A. A., ja Hendrikse, N. H. (2008). Yksilöllinen hoidon suunnittelu onkologiassa: PET:n ja radioleimattujen syöpälääkkeiden merkitys kasvaimen resistenssin ennustamisessa. Curr. Pharm. Des. 14, 2914-2931. doi: 10.2174/138161208786404344
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vuignier, K., Schappler, J., Veuthey, J. L., Carrupt, P. A., and Martel, S. (2010). Lääkkeiden ja proteiinien sitoutuminen: kriittinen katsaus analyysivälineisiin. Anal. Bioanal. Chem. 398, 53-66. doi: 10.1007/s00216-010-3737-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, J., Ueno, H., Masuko, T., and Hashimoto, Y. (1994). Seerumin albumiinin sitoutuminen kasvainsoluihin ja albumiinia sitovan proteiinin karakterisointi. J. Biochem. 115, 898-903.
Pubmed Abstract | Pubmed Full Text
Wunder, A., Stehle, G., Sinn, H., Schrenk, H., Hoffbiederbeck, D., Bader, F., et al. (1997). Rottien kasvainten lisääntynyt albumiinin otto. Int. J. Oncol. 11, 497-507. doi: 10.3892/ijo.11.3.497
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yamagishi, T., Sahni, S., Sharp, D. M., Arvind, A., Jansson, P. J. ja Richardson, D. R. (2013). P-glykoproteiini välittää lääkeresistenssiä uuden mekanismin kautta, johon liittyy lysosomaalinen sekvestraatio. J. Biol. Chem. 288, 31761-31771. doi: 10.1074/jbc.M113.514091
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhai, X. Y., Nielsen, R., Nielsen, R., Birn, H., Drumm, K., Mildenberger, S., Freudinger, R., et al. (2000). Kubiliinin ja megaliinin välityksellä tapahtuva albumiinin otto opossumin munuaisten viljellyissä proksimaalisissa tubulussoluissa (Cubilin- and megalin-mediated uptake of albumin in cultured proximal tubule cells of opossum kidney). Kidney Int. 58, 1523-1533. doi: 10.1046/j.1523-1755.2000.00314.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text