- Introduction
- Materiaalit ja menetelmät
- Osallistujat
- Magneettiresonanssikuvaus
- Tietojen hankinta ja käsittely
- Atlaksen louhinta
- Statistinen analyysi
- Tulokset
- Potilaat, joilla on SCA3, paljastivat merkittäviä vaurioita tyypillisillä infratentoriaalisilla vaurioalueilla
- Potilailla, joilla SCA3 paljasti aivojen lateralisoituneita supratentoriaalisia leesioita
- Keskustelu
- Johtopäätökset
- Data Availability Statement
- Etiikan lausunto
- Author Contributions
- Rahoitus
- Interintäristiriita
- Kiitokset
- Lisäaineisto
Introduction
Spinocerebellar ataksia tyyppi 3 (SCA3) on perinnöllinen hermoston rappeutumissairaus, jonka aiheuttaa CAG-laajentuminen koodaavalla alueella kromosomissa 14q32.1 (1, 2). Kliinisesti SCA3-potilailla esiintyy pikkuaivo-oireyhtymää, parkinsonismia, ataksista kävelyä, dysartriaa, dysmetriaa, nystagmusta, perifeeristä neuropatiaa, pyramidaalisia ja ekstrapyramidaalisia oireita (3-5). SCA3-potilaat kärsivät myös tunne-elämän häiriöistä, kuten masennuksesta ja ahdistuneisuudesta (6, 7). Nämä SCA3:n korkeamman asteen toimintahäiriöt viittaavat siihen, että neurodegeneraation tavanomaisen ”olivopontocerebellar”-mallin sijaan myös pikkuaivojen ulkopuoliset rakenteet ovat osallisina (8-12). Lisäksi SCA3-häiriö on kuvattu pikkuaivojen kognitiivis-aivovaikutukselliseksi oireyhtymäksi (CCAS, cerebellar cognitive affective syndrome) (6, 8).
Tutkimuksissa on käytetty positroniemissiotomografiaa (PET) ja yhden fotonin emissiotietokonetomografiaa subkliinisten poikkeavuuksien tunnistamiseksi aivokuorella (13, 14). Näissä tutkimuksissa raportoitiin kuitenkin, että aivo-pikkuaivoradan häiriö ei voi täysin selittää SCA3-potilaiden kognitiivisia ja affektiivisia häiriöitä. Esimerkiksi visuospatiaaliset puutteet SCA3-potilailla liittyvät selvästi parietaalilohkoon ja ovat vähemmän yhteydessä pikkuaivoihin. Vain harvoissa tutkimuksissa on keskitytty supratentoriaalisten alueiden rooliin SCA3:ssa. Supratentoriaalisten alueiden rappeutumisen kvantifiointi voi olla ratkaisevan tärkeää SCA3-potilaiden toimintahäiriöiden arvioinnissa. Neurokuvantamistutkimuksissa alueellisen kortikaalisen atrofian mittaaminen on ratkaisevan tärkeää arvioitaessa sen yhteyttä kognitiivisiin häiriöihin ja emotionaalisiin toimintahäiriöihin.
Diffuusiotensorikuvantaminen (DTI) voi helpottaa valkean aineen (WM) visualisointia ja karakterisointia, ja DTI on myös tehokas menetelmä SCA3:n tutkimiseen (15). SCA3 oli todennettu WM-dominoivaksi atrofian neurodegeneratiiviseksi sairaudeksi (16). Aiemmat tutkimukset osoittivat, että SCA3-potilailla fraktionaalinen anisotropia (FA) pienenee pikkuaivojen ja aivorungon alueilla, mutta radiaalinen diffuusiokyky (RD) kasvaa pikkuaivoissa, aivorungossa, talamuksessa sekä otsa- ja ohimolohkoissa (17). Toisessa DTI-tutkimuksessa havaittiin laajalle levinnyttä FA:n vähenemistä molemminpuolisessa aivojen otsa-, parietaali-, ohimo- ja takaraivolohkojen WM:ssä, pikkuaivojen WM:ssä, talamuksessa ja aivorungossa potilailla, joilla oli SCA3 (16). Lisäksi keskimääräisen diffusiviteetin (MD) lisääntymistä havaittiin samankaltaisessa, laajalti päällekkäisessä kuviossa kahdenvälisessä aivo-frontaalisessa, -parietaalisessa, -temporaalisessa ja -occipitaalisessa WM:ssä, pikkuaivojen WM:ssä, talamuksessa ja aivorungossa (16).
Tässä tutkimuksessa arvioimme atrofiaa suhteellisen fokusoituneilla alueilla ja selitimme supratentoriaalisen osallisuuden SCA3:ssa. Tässä tutkimuksessa käytettiin fraktaaliulottuvuusmenetelmää (FD), jonka etuna on tuottaa tuloksia, joiden vaihtelu on minimaalista (18), kortikaalisten morfologisten muutosten kvantifioimiseksi ja supratentoriaalisten alueiden alueellisen kortikaalisen atrofian mittaamiseksi. Tässä tutkimuksessa mittasimme kunkin osallistujan koko aivojen harmaan aineen 97 segmentin 3D-FD-arvot. Vertaamme edelleen näitä harmaan aineen vaurioiden tuloksia DTI-analyysiin valkean aineen vaurioista SCA3:ssa äskettäisessä tutkimuksessamme. Odotimme, että tässä tutkimuksessa arvioidut GM-vaurioalueet liittyvät DTI-tutkimuksen WM-vaurioalueisiin, ja tulos voi todentaa motoriikkaan liittyvän heikkenemisen ja supratentoriaalisten alueiden atrofian välisen yhteyden SCA3-potilailla.
Materiaalit ja menetelmät
Osallistujat
Tutkimukseen osallistui kaikkiaan 48 potilasta, joilla oli SCA3-oireyhtymää, ja 50 sukupuoleen ja ikään rinnastettua tervettä yksilöä, jotka olivat kontrolliryhmä. Tämä tutkimus suoritettiin Helsingin julistuksen mukaisesti, ja Taipein veteraanien yleissairaalan institutionaalinen arviointilautakunta hyväksyi sen. Kaikki osallistujat antoivat kirjallisen tietoon perustuvan suostumuksen ennen tutkimukseen osallistumista. Kaikki osallistujat rekrytoitiin Taipein veteraanisairaalan radiologian osastolta. SARA-asteikkoa (scale for the assessment and rating of ataxia) käytettiin SCA3-potilaiden ataksian kliiniseen arviointiin (19). Parkinsonin taudin etenemisen oireet SCA3:ssa mitattiin käyttäen modifioitua Hoehnin ja Yahrin vaiheistusta (20). SARA-pistemäärää, joka oli ataksiaoireiden vaikeusasteen luokitus, joka vaihteli välillä 0-40, käytettiin vertailukohtana osoittamaan kliinisen vaikeusasteen etenemistä verrattuna pikkuaivojen rappeutumiseen. Jokaiselta potilaalta kerättiin itse ilmoitettu puhkeamisikä eli ikä, jolloin potilaalla ilmeni ensimmäisen kerran jokin ataksian oire, (21). Kunkin SCA3-potilaan CAG-toiston pituus määritettiin polymeraasiketjureaktiolla aiemmin kuvatulla tavalla (22). Taulukossa 1 esitetään molempien ryhmien demografiset, kliiniset ja MR-kuvantamistiedot. SCA3-potilaat täyttivät sisäänottokriteerit, jos heillä oli etenevä ja muuten selittämätön ataksia ja SCA3-genotyypin testi oli positiivinen. SCA3-potilaiden taudin kesto oli 8,89 ± 6,432 vuotta. Kontrolliryhmään kuuluvilla potilailla ei ollut keskushermostosairautta eikä heillä ollut neurologisia poikkeavuuksia tutkimusjakson aikana. Kokenut neuroradiologi tutki kontrolliryhmän T1- ja T2-painotteiset kuvat varmistaakseen, ettei niissä ollut peittämättömiä merkkejä muusta neurologisesta sairaudesta tai odottamattomia poikkeavuuksia.
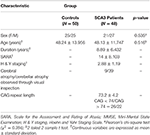
TAULUKKO 1. Kontrolliryhmän ja potilasryhmän demografiset, kliiniset ja MR-kuvatiedot.
Magneettiresonanssikuvaus
Tietojen hankinta ja käsittely
Aksiaaliset ihmisen aivojen MR-kuvat, jotka kattavat koko aivot ja pikkuaivot, otettiin 1,5-T Vision Siemens -skannerilla (Erlangen, Saksa). Osallistujat skannattiin ympyräpolarisoidulla pääkoolilla T1-painotettujen kuvien saamiseksi (TR = 14,4 ms; TE = 5,5 ms; matriisikoko: 256 × 256; 1,5 mm:n aksiaaliset viipaleet; FOV = 256 × 256 mm2; vokselikoko, 1,0 × 1,0 × 1,5 mm3, viipaleiden lukumäärä = 128). Kunkin osallistujan T1-painotetut kuvat muotoiltiin uudelleen aksiaaliseksi kuvaksi ja muunnettiin analyysimuotoon MRIcro-ohjelmistolla (Chris Rorden, Nottinghamin yliopisto, Yhdistynyt kuningaskunta; www.sph.sc.edu/comd/rorden/mricro.html). Kuvassa 1 esitetään tietojenkäsittelyn ja tilastollisen analyysin vuokaavio. Aivokudoksen erottamisen tarkkuuden parantamiseksi kuvamääriin sovellettiin automaattista skull-stripping-toimintoa MRIcro-ohjelmiston aivojen erottamistyökalun avulla (kuva 1B). Seuraavat prosessit suoritettiin DiffeoMap-ohjelmalla (Li, X.; Jiang, H.; ja Mori, S.; Johns Hopkins University, www.MriStudio.org). Tässä menettelyssä käytettiin 12-parametristä affiinimuunnosta (23) kunkin T1-painotetun kuvan normalisoimiseksi kohti JHU_MNI_SS_T_ss T1-mallia.
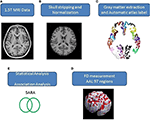
Kuva 1. (A-E) Kuvaprosessin ja tilastollisen analyysin kulku.
Atlaksen louhinta
Kuvatietojen prosessit suoritettiin käyttämällä SPM8-työkaluryhmää (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, Lontoo, Iso-Britannia, http://www.fil.ion.ucl.ac.uk/spm/) ja IBASPM-työkaluryhmää (Individual Brain Atlakses using Statistical Parametrical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), joita molempia ajettiin MATLAB 2010 -ohjelmistolla (Mathworks, Natick, MA, USA).
Menettely sisältää kolme vaihetta normalisoinnin jälkeen: (1) normalisoidun kuvan segmentointi harmaaseen aineeseen, valkeaan aineeseen ja aivo-selkäydinnesteeseen natiivissa tilassa, (2) harmaan aineen parkeeraus 116 alueeseen Montrealin neurologisen instituutin (Montreal Neurological Institute, MNI) anatomisen atlaksen (24) anatomisen merkinnän perusteella ja (3) harmaan aineen kuvien muuntaminen MNI-avaruuteen ja kunkin harmaan aineen vokselin anatominen kohdistaminen 116 automaattiseen automaattiseen anatomiseen merkintärakenteeseen IBASPM:llä (24), vasen aivokuori: 45 aluetta, oikeat aivot: 45 aluetta, pikkuaivot: 26 aluetta; (kuva 1C). Pikkuaivojen 26 aluetta yhdistettiin seitsemäksi alueeksi niiden anatomisten rakenteiden mukaan, ja 97 merkityn (45 kummallekin aivopuoliskolle ja seitsemän pikkuaivoille, lisätaulukko 1) aivorakenteen tilavuudet poimittiin kullekin henkilölle (kuva 1C).
FD-menetelmää ehdotti alun perin Mandelbrot objektien muotoon liittyvän monimutkaisuuden kvantifioimiseksi yhdeksi numeeriseksi arvoksi (25). FD-menetelmää käytetään topologisen monimutkaisuuden mittaamiseen; suurempi FD-arvo edustaa tutkittavan kudoksen suurempaa topologista monimutkaisuutta (18, 26). Monet neurologit ovat osoittaneet, että FD-arvo voi toimia kvantitatiivisena mittarina, jolla voidaan kuvata tarkasti aivopoimun morfologista monimutkaisuutta (18, 26, 27). Koska FD-analyysi perustuu logaritmiselle asteikolle, jo pieni lisäys FD-arvossa voi vastata huomattavaa kompleksisuuden lisääntymistä (18). Tässä tutkimuksessa käytettiin 3D-laatikkolaskentamenetelmää mittaamaan kunkin osallistujan 97 harmaan aineen segmentin 3D-FD-arvot koko aivoista (kuva 1D). Aiheeseen liittyvässä tutkimuksessa selvitetään yksityiskohtaisesti laatikkolaskentamenetelmän algoritmi (18).
Statistinen analyysi
Ryhmien välisiä sukupuoleen ja ikään liittyviä eroja mitattiin Pearsonin khiin neliö -testillä (χ2 = 0,384, p = 0,535) ja 2-häntäisellä 2-näytteen t-testillä (p = 0,516), erikseen. Iän ja sukupuolen vaikutusten poistamiseksi käytettiin lineaarista regressiota. Otimme käyttöön 2-häntäisen t-testin määrittääksemme, oliko kontrolli- ja potilasryhmien välillä merkittävää eroa kunkin kortikaalialueen 3D-FD-arvojen osalta. Tulosten merkitsevyys perustui väärän löydöksen määrään (FDR-korjattu p = 0,05) (28). Yksittäisten aivoalueiden 3D-FD-arvon ja kliinisten ominaisuuksien, kuten taudin keston ja SARA:n, välisen yhteyden suuruus määritettiin Pearsonin r-mittauksen avulla (kuva 1E). Nämä analyysit suoritettiin käyttämällä MATLAB 2010:n Statistics Toolbox -työkaluryhmää.
Tulokset
Potilaat, joilla on SCA3, paljastivat merkittäviä vaurioita tyypillisillä infratentoriaalisilla vaurioalueilla
Kokeneet neuroradiologit ilmoittivat magneettikuvauslöydökset potilailla, joilla on SCA3-oireyhtymä (taulukko 1). Kuvassa 2 esitetään 3D-FD-arvojen vertailu kussakin lohkossa terveen ryhmän ja SCA3-ryhmän välillä. Yleisesti ottaen SCA3-potilailla 3D-FD-arvot olivat merkittävästi pienentyneet jokaisessa aivolohkossa, ja pikkuaivoissa 3D-FD-arvo pieneni eniten (kuva 2). SCA3-potilaiden pikkuaivokuoren 3D-FD-arvot korreloivat merkittävästi heidän SARA-pisteidensä kanssa (r = -0,3346; p = 0,023). Jaoimme aivo- ja pikkuaivokuoren edelleen 97 alueeseen ja määrittelimme atrofian kullakin jaetulla alueella. SCA3-potilailla oli tyypillisiä infratentoriaalisia vaurioalueita, mukaan lukien pontin ytimet, pikkuaivokuori ja inferioriset oliivit. Yksityiskohdat atrofia-alueiden merkittävästi pienentyneistä 3D-FD-arvoista terveiden ryhmän ja SCA3-ryhmän välillä on tiivistetty taulukkoon 2.
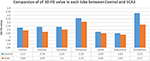
KUVIO 2. Atrofia-alueiden 3D-FD-arvojen merkittävä väheneminen terveiden ja SCA3-ryhmän välillä. 3D-FD-arvojen vertailu kussakin lohkossa terveen ryhmän ja SCA3-ryhmän välillä. SCA3:n 3D-FD-arvo kussakin lohkossa osoitti merkittävästi pienempää kuin kontrolliryhmässä. Pikkuaivojen, otsalohkon, päälaenlohkon ja takaraivolohkon merkitsevän eron p-arvo on pienempi kuin 0,01 ja muiden lohkojen osalta pienempi kuin 0,05.
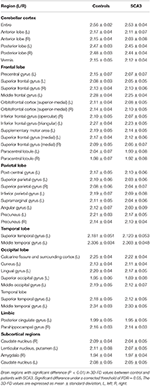
TAULUKKO 2. Merkittävät surkastuneet alueet SCA3-potilailla (p < 0,05).
Potilailla, joilla SCA3 paljasti aivojen lateralisoituneita supratentoriaalisia leesioita
Infratentoriaalisten leesioiden lisäksi kaikilla SCA3-potilailla havaittiin leesioita myös supratentoriaalisilla alueilla. Niissä ilmeni laajalle levinneitä vaurioita 39 aivopuoliskon alueella (p < 0,05), mukaan lukien otsalohko, päälaenlohko, takaraivolohko ja ohimolohko. Ne osoittivat lateralisoitunutta atrofiaa, ja pääasiassa vasemmassa aivopuoliskossa (oikea/vasen: 12/27). Erityisesti takaraivo- ja ohimolohkoissa SCA3-potilailla 3D-FD-arvot laskivat merkittävästi vain vasemmassa aivopuoliskossa. Merkittävästi surkastuneita alueita frontaalialueilla olivat premotorinen aivokuori (vasen precentraalinen gyrus, molemminpuolinen ylempi frontaalinen gyrus ja vasen keskimmäinen frontaalinen gyrus), täydentävä motorinen aivokuori (vasen täydentävä motorinen alue) ja primaarinen motorinen aivokuori (vasen precentraalinen gyrus) (kuva 3).
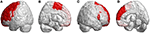
Kuva 3. Otsalohkon alueet, jotka osoittavat alhaisempia 3D-FD-arvoja SCA3-potilailla verrattuna kontrolleihin. (A) Vasen ulompi näkymä, (B) vasen sisempi näkymä, (C) oikea ulompi näkymä ja (D) oikea sisempi näkymä. SCA3-potilailla oli merkittävästi pienemmät 3D-FD-arvot frontaalialueilla, mukaan lukien premotorinen aivokuori (vasen precentraalinen gyrus, molemminpuolinen ylempi frontaalinen gyrus ja vasen keskimmäinen frontaalinen gyrus), täydentävä motorinen aivokuori (vasen täydentävä motorinen alue) ja primaarinen motorinen aivokuori (vasen precentraalinen gyrus). Muita surkastuneita alueita havaittiin SCA3-potilailla vasemmassa alemmassa otsalohkorungossa (operulaarinen), vasemmassa alemmassa otsalohkorungossa (kolmiomainen), molemminpuolisessa orbitofrontaalisessa aivokuoressa (superior-1 mediaalinen), molemminpuolisessa ylemmässä otsalohkorungossa (mediaalinen) ja molemminpuolisessa paracentralis-lohkossa. Kaikki merkittävästi vähentyneet 3D-FD-arvojen alueet on kuvattu punaisella.
Muut surkastuneet alueet olivat vasemmassa alemmassa otsalohkorungossa (operulaarinen), vasemmassa alemmassa otsalohkorungossa (kolmionmuotoinen), molemminpuolisessa orbitofrontaalisessa aivokuoressa (ylempi-mediaalinen), molemminpuolisessa ylemmässä otsalohkorungossa (mediaalinen) ja molemminpuolisessa parasentraalisessa lobuluksessa. Parietaalilohkossa SCA3-potilailla havaittiin alentuneita FD-arvoja vasemmassa postcentraalisessa gyrusissa, vasemmassa supramarginaalisessa gyrusissa, vasemmassa angulaarisessa gyrusissa, bilateraalisessa ylemmässä parietaalisessa gyrusissa ja bilateraalisessa precuneuksessa (kuva 4) (kuva 4).
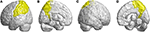
Kuva 4. Parietaalilohkon alueet, jotka osoittavat 3D-FD-arvon pienenemistä SCA3-potilailla verrattuna kontrolleihin. (A) Vasen ulompi näkymä, (B) vasen sisempi näkymä, (C) oikea ulompi näkymä ja (D) oikea sisempi näkymä. Kontrollipotilaisiin verrattuna SCA3-potilailla oli merkittävästi alhaisemmat 3D-FD-arvot vasemmassa postsentraalisessa gyruksessa, vasemmassa supramarginaalisessa gyruksessa, vasemmassa kulmahaarakkeessa, molemminpuolisessa ylemmässä parietaalisessa gyruksessa ja molemminpuolisessa prekuneuksessa parietaalilohkossa. Kaikki merkitsevästi alentuneet 3D-FD-arvojen alueet on kuvattu keltaisella.
Takaraivolohkossa SCA3-potilailla havaittiin merkitsevästi alhaisemmat FD-arvot kalkariinihalkiossa ja sitä ympäröivällä aivokuorella, cuneuksessa, kielekkeellisessä gyrusissa sekä vasemman aivopuoliskon ylemmässä ja keskimmäisessä takaraivon gyrissä (kuva 5A, sininen väri). Ohimolohkossa alueet, joilla FD-arvot olivat pienentyneet, sijaitsivat SCA3-potilaiden vasemmanpuoleisessa ylemmässä ohimolohkossa ja vasemmanpuoleisessa keskimmäisessä ohimolohkossa (kuva 5A, violetti väri). Myös limbisen alueen vasemmanpuoleisen takimmaisen cingulaarisen gyrusin 3D-FD-arvot pienenivät merkittävästi SCA3-potilailla (kuvat 5B, D, vihreä väri). SCA3-potilailla havaittiin merkittäviä atrofisia alueita tyvitumakkeissa, mukaan lukien molemminpuolinen caudate nucleus ja vasen putamen (kuvat 5B,D, akvansininen väri). Oikea-ulkoisessa takaraivolohkossa ei havaittu merkittäviä surkastuneita alueita SCA3-potilailla (kuva 5C) (kuva 5C).
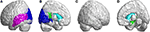
Kuva 5. Takaraivolohkon, ohimolohkon ja subkortikaalisen lohkon alueet, jotka osoittavat merkitsevästi alhaisempia 3D-FD-arvoja SCA3-potilailla verrattuna kontrolleihin. (A) Vasen ulompi näkymä, (B) vasen sisempi näkymä, (C) oikea ulompi näkymä ja (D) oikea sisempi näkymä. Siniset alueet osoittavat merkittävästi alhaisempia 3D-FD-arvoja takaraivolohkossa, mukaan lukien calcarine fissure ja sitä ympäröivä aivokuori, cuneus ja lingual gyrus sekä vasemman aivopuoliskon ylempi ja keskimmäinen takaraivon gyrus. Violetit alueet kuvaavat alhaisempia 3D-FD-arvoja vasemmanpuoleisessa ohimolohkossa ja vasemmanpuoleisessa keskimmäisessä ohimolohkossa. Veden siniset alueet edustavat alhaisempia 3D-FD-arvoja subkortikaalisilla alueilla, mukaan lukien molemminpuolinen caudate ja vasen putamen. Vihreät alueet edustavat merkittävästi alhaisempia 3D-FD-arvoja limbisen järjestelmän vasemmanpuoleisen cingulaarisen gyrusin ja parahippokampuksen gyrusin alueella.
Kuvassa 6 havaitsimme, että monet aivojen surkastuneet alueet sisälsivät pikkuaivoja, pikkuaivo-talamokortikaalisia ja basaaliganglia-talamokortikaalisia linkkipiirejä, jotka merkitsivät, että SCA3-potilaat, joilla oli SCA3, paljastivat näissä reiteissä vaurioituneita pikkuaivo-talamokortikaalisia ja basaaliganglia-talamokortikaalisia alueita.

Kuva 6. SCA3 osallistuu sekä pikkuaivo- talamokortikaalisiin että basaaliganglio- talamokortikaalisiin ratoihin. (A) Vasen ulompi näkymä, (B) vasen sisempi näkymä, (C) oikea ulompi näkymä ja (D) oikea sisempi näkymä. Pikkuaivo- ja talamokortikaalisen silmukan osalta SCA3-potilailla on huomattavasti alhaisemmat 3D-FD-arvot pikkuaivokuoressa, premotorisessa aivokuoressa ja täydentävässä motorisessa aivokuoressa. SCA3-potilaiden pienentyneet 3D-FD-arvot pikkuaivokuorella ja muilla motoriikkaan liittyvillä aivoalueilla tarjoavat selityksen kliinisten oireiden esiintymiselle. Tyvitumakkeiden ja talamokortikaalisen silmukan osalta SCA3-potilailla on huomattavasti alhaisemmat 3D-FD-arvot otsalohkossa, primaarimotorisella aivokuorella, putamenissa ja caudatessa. Nämä tulokset paljastavat morfologisia muutoksia basaaliganglia-talamokortikaalisen silmukan alueella potilailla, joilla on SCA3.
Keskustelu
Kliinisesti SCA3-potilailla esiintyy pikkuaivo-oireyhtymää ja parkinsonismia (3-5). Taulukossa 2 luetellut infratentoriaalisen ja supratentoriaalisen aivokuoren surkastuneet alueet ja osoittivat laajan valikoiman päällekkäisiä alueita, kuten kahdella toiminnallisella alueella, nimittäin pikkuaivoihin liittyvällä (CB-related) aivokuorella (29) ja basaaliganglioihin liittyvällä (BG-related) aivokuorella (30). CB:hen liittyvään aivokuoreen kuuluvat pikkuaivot, prefrontaalinen, sensomotorinen aivokuori, prefrontaalinen aivokuori ja ohimolohko, ja BG:hen liittyvään aivokuoreen kuuluvat primaarinen motorinen aivokuori, täydentävä motorinen alue, premotorinen aivokuori ja basaaligangliot. Tuloksemme paljastivat johdonmukaisesti aiempien perinteisten neurokuvantamistutkimusten kanssa, että pikkuaivot ovat eniten vaurioitunut ja surkastunut alue SCA3-potilailla (4, 31, 32). Lisäksi SCA3-potilaiden pikkuaivokuoren 3D-FD-arvolla oli merkitsevästi negatiivinen korrelaatio SARA-pisteiden kanssa (r = -0,3346; p = 0,023), kuten Rezende et al. olivat joskus raportoineet (33).
Infratentoriaalisilla alueilla potilailla, joilla oli SCA3, 3D-FD-arvot laskivat merkitsevästi putamenissa ja caudaatissa. Neuropatologiset tutkimukset ovat osoittaneet hermosolujen häviämistä putamenissa ja caudaatissa, mikä voi johtaa tyvitumakkeiden atrofiaan yhdessä parkinsonismin kanssa (34). Parkinsonistiset piirteet ovat SCA3-mutaation vallitseva fenotyyppi, ja niihin liittyy yleensä basaaliganglio-oireita (35-37). Ruumiinavaustutkimuksissa tyvitumakkeiden osallistuminen on yleistä SCA3-potilailla. Toiminnallinen kuvantaminen PET-tutkimusten avulla on myös osoittanut SCA3-potilailla caudaatin ja putamenin varhaisen toiminnallisen heikkenemisen. Lisäksi SCA3-potilailla oli huomattavasti pienempi basaaliganglioiden tilavuus (35). Aiheeseen liittyvissä tutkimuksissa on kuitenkin keskitytty vain basaaliganglioihin ja infratentoriaalisiin alueisiin. Kuvassa 6 varmistimme, että SCA3:lla voi olla basaaliganglioiden vaurioiden lisäksi myös pikkuaivo-talamokortikaalisia ja basaaliganglia-talamokortikaalisia reittejä koskevia vaurioita.
Potilailla, joilla on SCA3, on merkitsevästi pienemmät 3D-FD-arvot premotorisella aivokuorella ja täydentävällä motorisella aivokuorella pikkuaivo-talamokortikaalisen silmukan alueella. Premotorinen aivokuori ja täydentävä motorinen alue liittyvät liikkeen hallintaan, kuten lihasvoimaan ja kurotussuuntaan. Näiden alueiden vauriot voivat aiheuttaa liikkeiden hajoamisen lisäksi kävelyn, asennon ja raajojen ataksiaa (38, 39). Pikkuaivokuoren ja muiden motoriikkaan liittyvien aivoalueiden alentuneet 3D-FD-arvot SCA3-potilailla voivat selittää kliinisten oireiden esiintymisen. Lisäksi basaaliganglia-talamokortikaalisen silmukan osalta SCA3-potilailla esiintyy merkittävästi alentuneita 3D-FD-arvoja otsa- ja primaarimotorisella aivokuorella. Primaarinen motorinen aivokuori on myös tärkeä basaaliganglioiden tuoton kohde (40). Basaaliganglia-talamokortikaalisen silmukan häiriöt voivat myös vaikuttaa Parkinsonin motoriseen toimintahäiriöön (41). Tämän tutkimuksen tulokset korostavat SCA3-potilailla esiintyviä morfologisia muutoksia basaaliganglia-talamokortikaalisen silmukan alueella, joita aiemmat neurokuvantamistutkimukset eivät ole käsitelleet.
Viime aikoina käytimme diffuusiotensorikuvantamista (DTI) mittaamaan vesimolekyylidiffuusion valkean aineksen (WM) muutosta SCA3:ssa (15). Havaitsimme, että SCA3:ssa ilmeni laajalle levinneitä valkean aineen vaurioita kahdenvälisessä aivorintaman, -parietaalisen, -temporaalisen ja -okcipitaalisen WM:n; pikkuaivojen WM:n; talamuksen ja aivorungon alueella. Identtisesti tässä tutkimuksessa havaitsimme, että SCA3 osoitti lähes samoja parelloituja alueita näistä WM-vaurioista, jotka paljastivat GM-vaurioita. Nämä nykyiset havainnot vahvistavat supratentoriaalisten alueiden osallistumisen SCA3-potilailla. Braga et al. raportoivat samankaltaisista havainnoista ja osoittivat, että SCA3 aiheuttaa CCAS:n toimeenpanevien toimintojen, verbaalisen sujuvuuden, abstraktin päättelyn ja työmuistin heikkenemisen kautta (8). Neuropatologisissa tutkimuksissa kävi ilmi, että CCAS on seurausta pikkuaivopiirin häiriöstä, joka liittyy prefrontaaliseen, superioriseen parietaaliseen, superioriseen temporaaliseen ja limbiseen aivokuoreen (42, 43). Tutkimukset ovat vahvistaneet pikkuaivojen roolin kognitiivisissa toiminnoissa; kognitiiviset, affektiiviset ja visuospatiaaliset toiminnot liittyvät kuitenkin suoraan aivokuoren rappeutumiseen. SCA3-potilailla supratentoriaalisten alueiden merkitsevästi surkastuneet alueet olivat laajempia kuin CCAS-assosioituneet alueet. Supratentoriaalisen aivokuoren surkastuminen voi olla ensisijainen tekijä, joka liittyy ataksiaan ja parkinsonismiin liittyvien alueiden toimintahäiriöihin. Nämä havainnot viittaavat siihen, että SCA3:aa ei pitäisi enää pitää sairautena, joka rajoittuu pikkuaivoihin ja niiden yhteyksiin, vaan sitä olisi pikemminkin pidettävä koko aivoihin vaikuttavana patologiana.
Tässä tutkimuksessa oli kuitenkin vielä tiettyjä rajoituksia. Tärkeimmät rajoitukset tässä tutkimuksessa ovat erityisten kognitiivisten arviointien ja kliinisten parametrien puuttuminen CCAS:n arvioimiseksi SCA:ssa. Lisätutkimukset ovat perusteltuja tämänhetkisten tulosten ja kliinisten tietojen, kuten toiminnallisen magneettikuvauksen tietojen, välisen korrelaation osalta. Tämä voi auttaa tarjoamaan tarkemman menetelmän kognitiivisen ja motoriikkaan liittyvän osallistumisen ja alueellisen atrofian välisen yhteyden arvioimiseksi potilailla, joilla on SCA3.
Johtopäätökset
Tässä tutkimuksessa käytimme 3D-FD-menetelmää alueellisten morfologisten vaihteluiden kvantifioimiseksi potilailla, joilla on SCA3, ja arvioimme supratentoriaalisen atrofian ja motoriikkaan liittyvän osallistumisen välistä yhteyttä potilailla, joilla SCA3. Tuloksissamme havaittiin merkittävää aivokuoren rappeutumista tietyillä alueilla, jotka saattavat liittyä pikkuaivoihin tai basaaliganglioihin. Tuloksemme saattavat korreloida SCA3:n yleisten oireiden, kuten ataksia, parkinsonismi, dysartria ja dysmetria, kanssa. SCA3:a ei pitäisi enää pitää sairautena, joka rajoittuu pikkuaivoihin ja niiden yhteyksiin, vaan sitä pitäisi pitää patologiana, joka vaikuttaa koko aivoihin.
Data Availability Statement
Kaikki tätä tutkimusta varten tuotetut tietokokonaisuudet sisältyvät artikkeliin/täydentävään aineistoon.
Etiikan lausunto
Tutkimukset, joissa oli mukana ihmisosallistujia, tarkistettiin ja hyväksyttiin Taipein veteraanien yleissairaalan institutionaalisessa arviointilautakunnassa. Potilaat/osallistujat antoivat kirjallisen tietoon perustuvan suostumuksensa osallistua tähän tutkimukseen.
Author Contributions
P-SW ja Y-TW organisoivat tutkimusprojektin, tarkistivat ja kritisoivat käsikirjoituksen. T-YW kirjoitti käsikirjoituksen. H-MW käytti tutkimusaineistoa. B-WS organisoi tutkimuksen ja suoritti tiedonkeruun. C-WJ suoritti tilastollisen analyysin, kirjoitti ja tarkisti käsikirjoituksen.
Rahoitus
Tämän tutkimuksen rahoittivat Taiwanin tiede- ja teknologiaministeriö (MOST108-2634-F-010-002); Taiwanin kansalliset terveystutkimusinstituutit (NHRI-EX106-10526EI); Taiwanin kansallinen Yang-Ming-yliopisto ja Shin-Kong Wu-Ho Su -muistosairaalan tutkimusohjelma (107GB006).
Interintäristiriita
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Tekijät haluavat kiittää kaikkia tähän tutkimukseen osallistuneita henkilöitä ja kiittää Wallace Academic Editingia tämän käsikirjoituksen toimittamisesta.
Lisäaineisto
Tämän artikkelin liiteaineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. CAG-laajentumat Machado-Josephin taudin uudessa geenissä kromosomissa 14q32.1. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Tiivistelmä | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: neurologiset piirteet, patogeneesi ja eläinmallit. Cerebellum. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Kliiniset ja molekulaariset edistysaskeleet autosomaalisissa dominoivissa pikkuaivoverenkiertohäiriötaakseissa: genotyypistä fenotyyppiin ja fysiopatologiaan. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Epäselvyyksien ja epäkeskeisyyksien selvittäminen. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autosomaalisesti dominoivat pikkuaivojen ataksiat: kliiniset piirteet, genetiikka ja patogeneesi. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Fysioterapia. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Progressive cognitive dysfunction in spinocerebellar ataxia type 3. Movement Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Fysioterapia. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Cerebellar cognitive affective syndrome in machado joseph disease: core clinical features. Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Exekutiivinen ja emotionaalinen toimintahäiriö Machado-Josephin taudissa. Movement Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Kognitiivinen toimintahäiriö spinocerebellar ataksia tyyppi 3:ssa: vaihtelevat topografiat ja mallit. Movement Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Mahdolliset oireet. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Widespread neuronal damage and cognitive dysfunction in spinocerebellar ataxia type 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Johtopäätökset. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Reply to: Cognitive dysfunction in spinocerebellar ataxia type 3: variable topographies and patterns. Movement Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Fysioterapeuttinen tutkimus. Barbas H. Kognitiivisen ja emotionaalisen vuorovaikutuksen anatominen perusta kädellisten prefrontaalisella aivokuorella. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Neurosci Biobehav. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neocortical atrophy in machado-joseph disease: a longitudinal neuroimaging study. J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Tuntemattomien ihmisten aivojen ja aivosähkökäyrien aivosähkökäyrä. Soong BW, Liu RS. Positroniemissiotomografia Machado-Josephin taudin oireettomilla geeninkantajilla. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Fysioterapia ja neurologia. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamine transporter positron emission tomography in spinocerebellar ataxias type 1, 2, 3, and 6. Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Minkälainen se on? Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Diffuusiotensorimagneettikuvaus multippelin järjestelmän atrofian pikkuaivotyypin ja spinocerebellar ataksia tyyppi 3:n erottamiseksi. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Brain Sci (2019) 9:354. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. Valkoisen aineen vaurio on yhteydessä ataksian vakavuuteen SCA3:ssa. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Fysioterapia. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. Valkoisen aineen mikrorakenteellisten vaurioiden multimodaalinen arviointi spinocerebellar ataksia tyyppi 3:ssa. Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Fractal dimension analysis for quantifying cerebellar morphological change of multiple system atrophy of the cerebellar type (MSA-C). NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ks. esim. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Scale for the assessment and rating of ataxia. Uuden kliinisen asteikon kehittäminen. Neurologia. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Vertaisarviointi. Hoehn MM, Yahr MD. Parkinsonismi: alkaminen, eteneminen ja kuolleisuus. Neurologia. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. CPD. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Neurologiset löydökset Machado-Josephin taudissa: suhde taudin kestoon, alatyyppeihin ja (CAG)n. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Autosomaalisesti dominoivien pikkuaivojen ataksioiden frekvenssianalyysi taiwanilaisilla potilailla sekä spinocerebellar ataxia type 6:n kliininen ja molekulaarinen karakterisointi. Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Verkkoselkäydinvammaisten aivosairaudet. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Automaattinen kuvien rekisteröinti: I. General methods and intrasubject, intramodalitym validation. J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. TUTKIMUKSEN TULOKSET (1998) 22:139-52. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Fraktaalit: Form, Chance and Dimension. San Francisco, CA: Freeman (1977). s. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Fractal dimension and white matter changes in multiple sclerosis. NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. MS-tauti. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Aivokuoren pinnan fraktaalinen ulottuvuus skitsofreniassa ja pakko-oireisessa häiriössä. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Väärän löytymisasteen hallinta: käytännöllinen ja tehokas lähestymistapa monitestaukseen. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Anatominen tutkimus projisoinneista peruspontisiin posteriorisista parietaalisista assosiaatiokorteksista rhesusapinoissa. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Ristiintaulukot ja -merkinnät (1989). Girard B, Tabareau N, Berthoz A, Slotine JJ. Selektiivinen vahvistaminen käyttämällä basaaliganglion supistuvaa mallia. Pont A Mousson: NeuroComp (2006). s. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomaalinen dominoiva pikkuaivoaksia tyyppi I kliiniset piirteet ja magneettikuvaus SCA1-, SCA2- ja SCA3-perheissä. Brain. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Aivotutkimus. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Magneettikuvaus spinocerebellarisissa ataksioissa. Cerebellum. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Cerebral cortex involvement in Machado-Joseph disease. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Johtopäätökset. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. The parkinsonian phenotype of spinocerebellar ataxia type 3 in a Taiwanese family. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Parkinsonism Relat. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomaalinen dominoiva pikkuaivojen ataksia tyyppi I. MRI-pohjainen posterior fossa -rakenteiden ja basaaliganglioiden volumetria spinocerebellar ataksia tyyppeissä 1, 2 ja 3. Brain. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. Parkinson-fenotyypin intrafamiliaalinen vaihtelu SCA:ssa: SCA2- ja SCA3-laajentumista johtuvat uudet tapaukset. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Parkinsonism Relat. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Parkinsonilainen fenotyyppi Machado-Josephin taudissa (MJD/SCA3): kahden tapauksen raportti. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Neuraalitieteen periaatteet. New York, NY: McGraw-Hill (1991). s. 626-46.
Google Scholar
39. Google Scholar
. Asbury AK, McKhann GM. Hermoston sairaudet: Clinical Neurobiology. Philadelphia, PA: W.B. Saunders (1992). s. 319-341.
40. Hoover JE, Strick PL. Useita ulostulokanavia basaaliganglioissa. Science. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Ristiintaulukoinnin tulokset. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Dopaminergisen menetyksen kvantitatiivinen analyysi suhteessa toiminnallisiin alueisiin MPTP-käsitellyillä apinoilla. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Spinocerebellar ataxia type 3 (SCA3): talamuksen neurodegeneraatio tapahtuu riippumatta talamuksen ataksiini-3-immunopositiivisista hermosolujen intranukleaarisista sulkeumista. Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Consistent affection of the central somatosensory system in spinocerebellar ataxia type 2 and type 3 and its significance for clinical symptoms and rehabilitative therapy. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar