- Introduction
- Materiaalit ja menetelmät
- ICH:n indusoiminen
- Western Blotting
- Immunohistokemia
- Enzyme Linked Immunosorbent Assay
- Genetic Knockdown of Galectin-3
- Statistinen analyysi
- Tulokset
- Galektiini-1:n ja Galektiini-3:n ajallinen ilmentymiskuvio ICH:n jälkeen
- Galektiini-1:n ja Galektiini-3:n solulokalisoituminen ICH:n jälkeen
- Galektiini-1:n ja Galektiini-3:n välityksellä tapahtuva tulehdusvasteen säätely
- Keskustelu
- Johtopäätös
- Eettiset lausunnot
- Tekijän kontribuutiot
- Rahoitus
- Erittely eturistiriidoista
- Täydentävä aineisto
- Lyhenteet
Introduction
Aivoverenvuoto on kuolemaan johtava aivohalvauksen alatyyppi (Qureshi ym..), 2001a), jonka sairaalakuolleisuus on 40 % ja vammautumisaste 80 % (van Asch ym., 2010). ICH aiheuttaa 10-15 prosenttia kaikista aivohalvauksista, ja maailmanlaajuisesti ICH:n ilmaantuvuus on 2 miljoonaa tapausta vuodessa (van Asch ym., 2010), ja Yhdysvalloissa noin 120 000 tapausta vuodessa (Ribo ja Grotta, 2006; Broderick ym., 2007; Aguilar ja Freeman, 2010). Esiintyvyyden odotetaan kuitenkin kaksinkertaistuvan vuoteen 2050 mennessä (Qureshi ym., 2001b) ikääntymisen ja antikoagulanttien käytön yleistymisen vuoksi (Wang, 2010). Huomattavaa on, että ICH:hen ei ole olemassa tehokasta hoitoa, ja taudin patofysiologia on huonosti määritelty.
Neuroinflammaatio, jolle on ominaista keskushermoston neuroimmuunisolujen mikroglian aktivoituminen, on keskeinen tekijä ICH:n aiheuttamassa sekundaarisessa aivovauriossa ja neurologisten toimintojen menetyksessä (Wang ja Dore, 2007; Carmichael ym., 2008; Wang, 2010). Veren komponenttien, kuten trombiinin, Hb:n ja Hb:n aineenvaihduntatuotteiden, kuten hemiinin, kulkeutuminen aivoihin luo pohjan neuroinflammatorisille reaktioille ICH:n jälkeen (Wang ja Dore, 2007; Carmichael ym., 2008; Robinson ym., 2009; Wang, 2010; Cai ym., 2011; Dang ym., 2011; Babu ym., 2012; Lin ym., 2012; Weng ym., 2015; Min ym., 2017). Erityisesti mikroglian proinflammatorinen aktivaatio ICH:n jälkeen korreloi veri-aivoesteen vaurion, aivojen turvotuksen/ödeeman, hematooman laajenemisen, neurologisen heikkenemisen ja huonon toiminnallisen palautumisen kanssa (Platt ym., 1998; Hickenbottom ym., 1999; Leira ym., 2004; Zhao ym., 2007). Lisäksi ICH:n jälkeinen tulehdusreaktio säätelee myös verestä peräisin olevien monosyyttien/makrofagien rekrytointia aivoihin, joiden tiedetään säätelevän ICH:n aiheuttamaa aivovauriota ja sitä kautta toiminnallista toipumista (Tessier ym., 1997; Shiratori ym., 2010; Starossom ym., 2012).
Galektiinit ovat evolutiivisesti konservoituneiden hiilihydraatteja sitovien proteiinien perhe (Barondes ym., 1994a,b; Kasai ja Hirabayashi, 1996), jotka osallistuvat solujen aktivoitumiseen, erilaistumiseen, proliferaatioon, migraatioon ja apoptoosiin (Perillo ym., 1995; Yang ym., 1996; Perillo ym., 1998; Moiseeva ym., 1999; Vespa ym., 1999; Yamaoka ym., 2000; Goldring ym., 2002). Galektiiniperheen eri jäsenistä nousevat todisteet viittaavat Galektiini-1:n ja Galektiini-3:n keskeisiin rooleihin neuroimmuunivasteissa useissa neuropatologisissa tiloissa (Jeon ym., 2010; Starossom ym., 2012; Parikh ym., 2015). Niiden soluvälitteisen ilmentymisen ja toiminnan ymmärtämisessä ICH:n jälkeen on kuitenkin kriittinen tietovaje. Tämän käsikirjoituksen tavoitteena on selvittää hemorragisen vamman aiheuttamaa Galektiini-1- ja Galektiini-3-ekspression modulaatiota ja soluvälitteistä ilmentymistä aivoissa prekliinisessä ICH-mallissa.
Materiaalit ja menetelmät
ICH:n indusoiminen
Intraserebraalinen verenvuoto indusoitiin aikuisilla urospuolisilla CD-1-hiirillä (8-12 viikkoa; n = 43), kuten aiemmin raportoitiin (Sukumari-Ramesh ym, 2012a,b, 2016; Bonsack et al., 2016; Sukumari-Ramesh ja Alleyne, 2016; Ahmad et al., 2017; Chen-Roetling et al., 2017). Lyhyesti hiiri nukutettiin (ketamiini ja ksylatsiini) ja tehtiin pieni viilto kallon paljastamiseksi. Kalloon tehtiin suurnopeusporalla porareikä (0,5 mm) noin 2,2 mm lateraalisesti bregmasta. Sitten hiiri asetettiin stereotaksiseen pääkehikkoon ja 26-G Hamiltonin ruiskulla ruiskutettiin 0,04U bakteerityyppistä IV-kollagenaasia (Sigma, St. Louis, MO, Yhdysvallat) 0,5 μL fosfaattipuskurisuolaliuoksessa (pH 7,4; PBS) vasempaan striatumiin (3,0 mm) stereotaksisessa ohjauksessa. Kun neula poistettiin, reikä suljettiin luuvahalla. Hiiret pidettiin 37 ± 0,5 °C:ssa pieneläinlämpötilan säätimellä koko toimenpiteen ajan. ICH:n jälkeinen hematooman ajallinen kuvio on esitetty (lisäkuva S1).
Western Blotting
Hiiret nukutettiin ja perfusoitiin transkardiaalisesti PBS:llä. Ipsilateraalinen aivokudos (sekä hematomaaliset että perihematomaaliset aivoalueet) kerättiin RIPA-puskuriin, joka sisälsi proteaasi- ja fosfataasi-inhibiittoreita, ja sille tehtiin sonikointi. Tämän jälkeen näytteet sentrifugoitiin 14 000 rpm 5 minuutin ajan 4 °C:ssa supernatantin keräämiseksi. Proteiinipitoisuudet arvioitiin BCA-proteiinimäärityssarjalla (Pierce, Rockford, IL, Yhdysvallat), ja 30-50 mikrogrammaa näytteitä ajettiin 4-20-prosenttisella natriumdodekyylisulfaatti-polyakryyliamidigeelillä ja siirrettiin polyvinyylideenidifluoridikalvolle (PVDF). Blotteja inkuboitiin vastaavalla primaarivasta-aineella yön yli 4 °C:ssa. Tämän jälkeen inkuboitiin 2 tuntia vastaavan Alexa Fluor -merkityn sekundäärisen vasta-aineen kanssa. Blotit luettiin Li-Cor Odyssey -lähi-infrapunakuvantamisjärjestelmällä ja kvantifiointi tehtiin Quantity One -ohjelmistolla (Bio-Rad, Foster City, CA, Yhdysvallat).
Immunohistokemia
Hiiret nukutettiin ja perfusoitiin transkardiaalisesti PBS:llä. Aivot kerättiin ja sijoitettiin 4-prosenttiseen paraformaldehydiin yön yli 4 °C:ssa, minkä jälkeen ne pakastettiin. Aivot leikattiin sitten 25 mm:n koronaalileikkauksiksi kryostaatilla ja kiinnitettiin lasilevyille. Leikkeitä inkuboitiin 2 tuntia 10 %:n normaalissa aasin seerumissa huoneenlämmössä. Tätä seurasi yön yli kestävä inkubaatio vastaavan primaarivasta-aineen kanssa 4 °C:ssa. Pesun jälkeen leikkeitä inkuboitiin vastaavalla Alexa Fluor-merkityllä sekundäärisellä vasta-aineella 1 tunnin ajan huoneenlämmössä. Immunofluoresenssi määritettiin Zeiss LSM510 Meta konfokaalisella lasermikroskoopilla ja solujen yhteislokalisaatio määritettiin aiemmin kuvatulla tavalla (Laird ym., 2010). Analysoimme kolme ei-peräkkäistä leikkausta eläintä kohti ja vähintään kolme satunnaista kenttää hematooman ympärillä.
Enzyme Linked Immunosorbent Assay
RAW 264.7, hiiren makrofagisolulinja, istutettiin 24-kuoppalevylle ja sen annettiin inkuboitua 48 tuntia DMEM:ssä (DMEM, Dulbecco’s Modified Eagle Medium), joka sisälsi 5 % nautaeläinten fetaalista seerumia, 5 % nautaeläinten kasvusiementä ja 1 % penisilliiniä/streptomysiiniä. Tämän jälkeen soluja inkuboitiin hiiren rekombinantilla Galektiini-1:llä (6,25 tai 12,5 μg/ml; R&D Systems, Minneapolis, MN, Yhdysvallat) 1 tunnin ajan, minkä jälkeen soluja käsiteltiin 18 tuntia LPS:llä (100 ng/ml) tai heminillä (30 μg/ml). Supernatantti kerättiin ja sitä käytettiin IL-6:n osoittamiseen ELISA:lla valmistajan ohjeiden mukaisesti (Biolegend, San Diego, CA, Yhdysvallat). Lyhyesti sanottuna 96 kuoppalevy päällystettiin yön yli 4 °C:ssa spesifisellä sieppausvasta-aineella. Soluviljelmän supernatantti lisättiin kuoppiin 1 tunnin blokkauksen jälkeen ja inkuboitiin 2 tuntia huoneenlämmössä. Sitoutumattomat aineet poistettiin pesemällä, ja kuoppiin lisättiin detektiovasta-aineliuos, jonka annettiin inkuboitua 1 h huoneenlämmössä. Lisähuuhtelun jälkeen kuhunkin kuoppaan lisättiin 100 μl Avidin- Horse Radish Peroxidase (HRP) -liuosta 30 minuutiksi huoneenlämmössä. Substraattiliuos lisättiin kuoppiin pesun jälkeen värin kehittymistä varten. Käytettiin stop-liuosta ja levy luettiin 450 nm:ssä mikrotiterilevyjen lukulaitteella (Bio-Tek, Epoch).
Genetic Knockdown of Galectin-3
RAW 264.7-solut transfektoitiin joko kontrolli-siRNA:lla (ON-TARGET plus Non-targeting Pool; GE Dharmacon) tai Galektiini-3-siRNA:lla (ON-TARGET plus Mouse Lgals3 siRNA; GE Dharmacon) käyttäen HiPerFect transfektioreagenssia (QIAGEN) valmistajan ohjeiden mukaisesti. Galektiini-3:n knockdown varmistettiin 48 tuntia transfektion jälkeen western blottingilla, kuten aiemmin on kuvattu.
Statistinen analyysi
Tiedot analysoitiin t-testillä tai yksisuuntaisella varianssianalyysillä, jota seurasi Student-Newman-Keulsin post hoc -testi, ja ne ilmaistiin keskiarvona ± keskivirhe (SE). P-arvoa < 0,05 pidettiin merkitsevänä.
Tulokset
Galektiini-1:n ja Galektiini-3:n ajallinen ilmentymiskuvio ICH:n jälkeen
Mutta sen arvioimiseksi, johtaako verenvuotovamma Galektiini-1:n ja Galektiini-3:n ilmentymisen modulaatioon aivoissamme, hiirille indusoitiin ICH:ta tai Sham-menetelmää kollagenaasi-injektiolla. Ottaen huomioon Galektiini-1:n ja Galektiini-3:n nousevan roolin neuroimmuunivasteissa, ipsilateraaliset aivoleikkeet sham- tai ICH-hiiristä arvioitiin käyttämällä sekä western blotting- että immunohistokemian analyysejä eri aikapisteissä, jotka vaihtelivat leikkauksen jälkeisestä 1. päivästä 7. päivään asti, joka on vamman jälkeinen ajanjakso, joka osoitti huomattavaa mikroglian/makrofagien ja astrosyyttien pro- sekä anti-inflammatorisen aktivaation induktiota ICH:n jälkeen (Sukumari-Ramesh ym, 2012b, 2016; Bonsack ym., 2016).
Huomionarvoista on, että ICH:n jälkeisten shameitaivojen tai kontralateraalisten aivoalueiden aivoleikkeissä Galektiini-1:n ja Galektiini-3:n ilmentyminen oli hyvin marginaalista tai havaitsematonta, kun taas Galektiini-1:n ja Galektiini-3:n ilmentymisen lisääntymistä havaittiin 3., 5. ja 7. päivänä ICH:n jälkeen (Kuvat 1, 2). Samansuuntaisesti Galektiini-1-immunopositiivisten solujen määrä lisääntyi merkittävästi noin 4-, 6- ja 4-kertaiseksi 3. päivänä, 5. päivänä ja 7. päivänä ICH:n jälkeen verrattuna näennäiseen (kuva 1B). Tämä havainto vahvistettiin edelleen western blotting -analyysillä, joka paljasti Galektiini-1:n huomattavan ja merkittävän induktioasteen 3. päivästä alkaen ICH:n jälkeen verrattuna shamiin (kuvat 1C, D). Lisäksi Galektiini-3:n induktio (kuva 2) heijasti Galektiini-1:n ilmentymistä ICH:n jälkeen, ja Galektiini-3:n immunopositiiviset solut olivat noin 15-, 28- ja 24-kertaisesti suuremmat 3., 5. ja 7. päivänä ICH:n jälkeen (kuva 2B) verrattuna näennäisnäytteenottoon, ja Western blotting -analyysi ja sitä seurannut densitometria-analyysi vahvistivat loukkaantumisen aiheuttaman Galektiini-3:n lisääntyneen ilmentymisen ICH:n jälkeen (kuvat 2C,D).
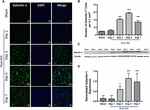
Kuvio 1. Galektiini-1:n lisääntynyt ilmentyminen ICH:n jälkeen. (A) Konfokaalikuvat, jotka kuvaavat Galektiini-1:n ajallista ilmentymismallia ICH:n jälkeen (mittakaavapalkki = 20 μm; n = 3-5 per ryhmä). (B) Galektiini-1-positiivisten solujen keskimääräinen lukumäärä 0,1 mm2 kohti ipsilateraalisessa striatumissa. (C) Galektiini-1:n lisääntynyt ilmentyminen vahvistettiin ipsilateraalisen striatumin aivokudoksen western blotting -menetelmällä. (D) Densitometrinen analyysi (n = 3-5 per ryhmä) western blotting -tiedoista. ∗p < 0.05, ∗∗∗p < 0.001 vs. sham.
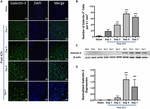
KUVIO 2. Vertailun tulokset. Galektiini-3:n lisääntynyt ilmentyminen ICH:n jälkeen. (A) Galektiini-3:n ajallinen ilmentymismalli perihematomaalisella alueella ICH:n jälkeen. Edustavat konfokaalikuvat osoittavat Galektiini-3:n ilmentymisen huomattavaa lisääntymistä ICH:n jälkeen verrattuna Shamiin (mittakaavapalkki = 20 μm; n = 3-5 per ryhmä). (B) Galektiini-3-positiivisten solujen keskimääräinen lukumäärä 0,1 mm2 kohti ipsilateraalisessa striatumissa. (C) Galektiini-3:n ajallinen ilmentyminen vahvistettiin edelleen käyttämällä western blottingia. (D) Densitometrinen analyysi (n = 3-5 per ryhmä) western blotting -tiedoista. ∗∗p < 0.01, ∗∗∗p < 0.001 vs. sham.
Galektiini-1:n ja Galektiini-3:n solulokalisoituminen ICH:n jälkeen
Galektiini-1:n ja Galektiini-3:n solulokalisoitumisen määrittämiseksi ICH:n jälkeen aivoleikkeille tehtiin kaksoisleimausimmunovärjäys. Galektiini-1:n ilmentymistä havaittiin enimmäkseen GFAP-positiivisissa astrosyyteissä (kuva 3A), ja stereotaktinen solujen laskenta osoitti, että 85 % Galektiini-1-positiivisista soluista ilmaisi GFAP:ta samanaikaisesti ICH:n jälkeen. Lisäksi Galektiini-1:n ilmentymistä havaittiin myös Iba1-positiivisissa mikroglioissa/makrofageissa ICH:n jälkeen (kuva 3B), mutta vain 12 % Galektiini-1-positiivisista soluista ilmaisi Iba1:tä samanaikaisesti.
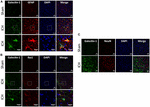
KUVA 3. Galektiini-1:n ilmentyminen. Galektiini-1:n ilmentymistä havaitaan eniten gliasoluissa ICH:n jälkeen. Aivoleikkeet immunovärjättiin kahdesti (A) Galektiini-1:n ja GFAP:n, (B) Galektiini-1:n ja Iba1:n (alimmainen paneeli kuvaa suurennettuja kuvia) ja (C) Galektiini-1:n ja NeuN:n suhteen (Mittakaavapalkki = 20 μm; n = 3 per ryhmä). Galektiini-1:n ilmentymistä havaittiin lähinnä GFAP-positiivisissa soluissa ja Iba1-positiivisten solujen osajoukossa. NeuN-positiiviset solut eivät ilmentäneet Galektiini-1:tä (n = 3 per ryhmä).
Sen sijaan Galektiini-3:n ilmentyminen rajoittui enimmäkseen Iba1-positiivisiin soluihin (kuva 4A) ja Galektiini-3:n ilmentyminen puuttui GFAP-positiivisista soluista (kuva 5A), mikä osoittaa Galektiini-1:n ja Galektiini-3:n erilaista soluvälitteistä ilmentymistä ICH:n jälkeen. Lisäksi Galektiini-3:n ilmentymistä havaittiin proinflammatorisissa, M1-mikroglia- tai makrofagimerkkiaineita sisältävissä CD16/32-positiivisissa soluissa (kuva 4B), mikä viittaa Galektiini-3:n uuteen rooliin neuroinflammatorisissa vasteissa ICH:n jälkeen. Huomionarvoista on, että 88 ja 92 prosenttia Galektiini-3-positiivisista soluista ilmaisi samanaikaisesti Iba1- ja CD16/32-positiivisia soluja. Huomionarvoista on, että Galektiini-3:a ilmentävät mikrogliat tai makrofagit osoittivat fagosytoivaa fenotyyppiä (kuvat 4A,B), mikä viittaa sen tutkimattomaan rooliin mikroglia- tai makrofagivälitteisessä fagosytoosissa ICH:n jälkeen. Lisäksi NeuN-positiiviset solut eivät ilmentäneet Galektiini-1:tä tai Galektiini-3:a (kuvat 3C, 5B).
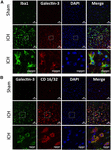
Kuva 4. Galektiini-3:n ilmentyminen mikrogliassa/makrofageissa ICH:n jälkeen. Aivoleikkeet immunovärjättiin (A) Galektiini-3:n ja Iba1:n sekä (B) Galektiini-3:n ja CD 16/32:n suhteen. Sekä Iba1 (mikroglian/makrofagien merkkiaine) että CD16/32 (proinflammatorisen M1-mikroglian tai makrofagien merkkiaine) -positiiviset solut ekspressoivat yhdessä Galektiini-3:a (n = 3 per ryhmä).
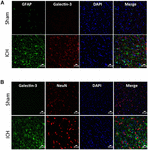
KUVA 5. Galektiini-3:n solulokalisoituminen ICH:n jälkeen. Aivoleikkeet immunovärjättiin kahdesti (A) Galektiini-3:lla ja GFAP:lla sekä (B) Galektiini-3:lla ja NeuN:llä. Galektiini-3:n ilmentyminen puuttui GFAP-positiivisista tai NeuN-positiivisista soluista. Mittakaavapalkki = 20 μm; n = 3 per ryhmä.
Galektiini-1:n ja Galektiini-3:n välityksellä tapahtuva tulehdusvasteen säätely
Toteuttaaksemme Galektiini-1:n ja Galektiini-3:n mahdollisen funktionaalisen roolin ICH:n jälkeen, teimme in vitro -tutkimuksia. Rekombinantti Galektiini-1 (6,25 ja 12,5 μg/ml) vaimensi merkittävästi LPS:n aiheuttamaa proinflammatorisen sytokiinin, interleukiini -6:n (IL-6), vapautumista RAW 264.7 -soluista ELISA-menetelmällä arvioituna verrattuna kontrolleihin (kuva 6), mikä viittaa Galektiini-1:n negatiiviseen säätelevään rooliin tulehduksessa.

Kuva 6. Rekombinantti Galektiini-1 ja tulehdusreaktio. Ennen LPS-stimulaatiota (100 ng/ml) Raw 264.7 -soluja käsiteltiin rekombinantilla Galektiini-1:llä, ja IL-6:n vapautuminen mitattiin ELISA:lla, kuten menetelmissä on tarkemmin esitetty. Rekombinantti Galektiini-1 vähensi merkittävästi LPS:n indusoimaa IL-6:n vapautumista RAW 246.7 -soluista (n = 4 per ryhmä). ∗∗∗p < 0,001 vs. LPS.
Testaamaan Galektiini-3:n toiminnallista roolia suoritimme siRNA-välitteisen Galektiini-3:n geneettisen knockdownin RAW 264.7 soluja ja tutkittiin tulehdusreaktiota. Geenin vaimentaminen siRNA:lla vähensi merkittävästi Galektiini-3:n ilmentymistä RAW 264.7 -soluissa 52,95 prosentilla, kuten Western blotting osoitti (kuvat 7A, B). Erityisesti Galektiini-3:n siRNA:lla lääkitty geneettinen tyrmäys ei moduloinut LPS:n indusoimaa IL-6:n vapautumista (kuva 7C), kun taas Galektiini-3:n geneettinen tyrmäys lisäsi merkittävästi heminin (hemoglobiinimetaboliitti, joka kerääntyy suurina pitoisuuksina kallonsisäisiin hematoomaattisiin verenpurkaumiin) indusoimaa IL-6:n vapautumista (kuva 7D), mikä osoittaa Galektiini-3:n vielä tutkimatonta roolia tulehdusreaktion modulaattorina ICH:n jälkeen.
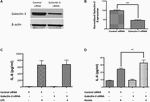
Kuva 7. Galektiini-3 ja tulehdusreaktio (A) RAW 246.7 -soluja käsiteltiin joko kontrolli-siRNA:lla tai Galektiini-3-siRNA:lla menetelmissä esitetyllä tavalla, ja Galektiini-3:n geneettinen tyrmäys todennettiin käyttämällä (A) western blottingia, jota seurasi (B) densitometrinen analyysi. ∗∗∗p < 0,001 vs. kontrolli-siRNA. (C) Galektiini-3:n knockdown ei moduloinut LPS:n indusoimaa IL-6:n vapautumista (D), kun taas heminin indusoima IL-6:n vapautuminen RAW 246.7 -soluista ei säätynyt merkittävästi kontrolliin verrattuna (n = 3 per ryhmä). ∗∗p < 0.01 vs. hemin.
Keskustelu
Galektiinit ovat endogeenisten hiilihydraatteja sitovien proteiinien perhe, joilla on kriittisiä rooleja sekä fysiologisissa että patologisissa olosuhteissa olemalla vuorovaikutuksessa solujen pinnalla olevien glykosyloidun reseptorien kanssa ja moduloimalla solunsisäisiä signalointireittejä (Perillo ym, 1995, 1998; Yang et al., 1996; Moiseeva et al., 1999; Vespa et al., 1999; Yamaoka et al., 2000; Goldring et al., 2002; Laaf et al., 2019). Galektiinien hiilihydraatteja tunnistava domeeni (CRD) on sekvenssiltään huomattavan samankaltainen, ja niillä on kohonnut affiniteetti β-galaktosideja kohtaan, ja ne on alun perin määritelty sen perusteella, että ne kykenevät tunnistamaan disakkaridia N-asetyylilaktosamiinia (Barondes et al., 1994a,b; Kasai ja Hirabayashi, 1996). Viimeaikaiset tutkimukset osoittavat kuitenkin huomattavia eroja niiden hiilihydraatteja sitovissa ominaisuuksissa (Hirabayashi ym., 2002; Leffler ym., 2002; Carlsson ym., 2007).
Galektiini-1:n, joka on galektiini-perheen ubikvitaalisimmin ekspressoituva jäsen (Stillman ym., 2006), on todettu osallistuvan synnynnäisen ja adaptiivisen immuniteetin säätelyyn, ja sitä esiintyy sekä solunsisäisissä että solunulkoisissa paikoissa (Verschuere ym., 2014). Galektiini-1:n solunulkoiset toiminnot perustuvat suurelta osin hiilihydraatteja sitoviin ominaisuuksiin, kun taas solunsisäiset toiminnot liittyvät pääasiassa hiilihydraateista riippumattomiin vuorovaikutuksiin (Verschuere ym., 2014). Johdonmukaisesti Galektiini-1:n roolin kanssa immuunivasteessa periferiassa Galektiini-1:n tiedetään tukahduttavan makrofagien aktivaatiota (Barrionuevo ym., 2007), edistävän T-solujen selektiivistä apoptoosia (Toscano ym., 2007), indusoivan anti-inflammatorisen sytokiinin, IL-10:n eritystä (van der Leij ym, 2004; Cedeno-Laurent ym., 2012) ja heikentää makrofagien typpioksidin (NO) tuotantoa (Correa ym., 2003).
Galektiini-1 ilmentyy laajalti hermokudoksissa alkionvaiheessa, mutta rajoittuu pääasiassa perifeerisiin kudoksiin kypsymisen myötä (Horie ja Kadoya, 2002). Johdonmukaisesti vahingoittumattomassa aivojen striatumissa Galektiini-1:n ilmentyminen oli marginaalista. Hemorragisen aivovamman yhteydessä GFAP-positiivisissa astrosyyteissä havaittiin kuitenkin hyvin huomattavaa Galektiini-1:n ilmentymistä. Galektiini-1 on mukana astrosyyttien erilaistumisessa ja sen jälkeisessä BDNF:n (Brain Derived Neurotrophic Factor) vapautumisessa aivovamman jälkeen, mikä viittaa Galektiini-1:n rooliin neuroprotektiossa (Sasaki et al., 2004; Qu et al., 2010). Lisäksi galektiini-1 on yksi aikuisten neurogeneesin keskeisistä säätelijöistä hiilihydraatteja sitovan kykynsä ansiosta ja edistää toiminnallista elpymistä aivohalvauksen jälkeen (Ishibashi ym., 2007). Galektiini-1:n antaminen vähensi neuronien apoptoosia, pienensi aivoinfarktin määrää ja paransi aivojen iskemiasta johtuvaa neurologista toimintaa (Qu ym., 2011). Myös natiivi ja rekombinantti galektiini-1 suojasi hiiren ja rotan pikkuaivoneuroneja glutamaatin neurotoksisilta vaikutuksilta (Lekishvili et al., 2006). Huomionarvoista on, että galektiini-1 deaktivoi tulehduksellista mikrogliaa ja suojaa tulehduksen aiheuttamalta neurodegeneraatiolta (Starossom ym., 2012). Lisäksi tutkimuksemme osoittivat, että rekombinantti Galektiini-1 heikentää proinflammatorisen sytokiinin, IL-6:n vapautumista LPS-stimuloiduista hiiren makrofageista RAW 264.7 verrattuna kontrolleihin, mikä viittaa Galektiini-1:n negatiiviseen säätelyrooliin tulehduksessa.
Galektiini-1 on yksi mikroglian/makrofagien aktivaatiota säätelevän CD45:n endogeenisistä ligandeista (Walzel et al., 1999). Lisäksi galektiini-1:n vuorovaikutus CD45:n kanssa johtaa tämän glykoproteiinin pysymiseen plasmakalvolla ja lisää sen fosfataasiaktiivisuutta. Viimeaikaiset tutkimukset osoittivat, että CD45 säätelee negatiivisesti proinflammatorista M1-mikroglian aktivaatiota mutta edistää anti-inflammatorista, M2-fenotyyppiä moduloimalla mitogeeniaktivoitua proteiinikinaasi p38:a (p38MAPK), cAMP-vaste-elementtiä sitovaa CREB:tä (cAMP response element binding) ja aktivoitujen B-solujen ydintekijä kappa-valoketjujen vahvistajaa (NF kappa-light-chain-enhancer of activated B cells, NF kappa-light-chain-enhancer of activated B-s cells) -solunsiirtoväyliä (Starossom ym., 2012). Tähän vaikutukseen liittyi Galektiini-1:n sitoutuminen CD45:n ydin 2 O-glykaaneihin, mikä viittaa siihen, että aktivoituneiden mikroglialien/makrofagien glykaaniosuuksien ilmentyminen edellyttää Galektiini-1:n sitoutumista ja toimintaa (Starossom ym., 2012). Lisäksi Galektiini-1 tukahdutti metamfetamiinin aiheuttamaa neuroinflammaatiota ihmisen aivojen mikrovaskulaarisissa endoteelisoluissa (Parikh et al., 2015), ja Galektiini-1:n on ehdotettu osallistuvan neuriitin uloskasvuun ja synaptiseen liitettävyyteen. Kaiken kaikkiaan tiedot viittaavat siihen, että Galektiini-1:n induktio reaktiivisissa astrosyyteissä ICH:n jälkeen voisi olla solujen välinen viestintämekanismi, joka helpottaa astrosyyttien välittämää neuroprotektioiden säätelyä ICH:n jälkeen, mikä oikeuttaa lisätutkimuksiin.
Galektiini-3 on 25-35 kDa:n kimeerinen tyyppinen valkuaisaine, jonka toiminnot riippuvat tiukasti lokalisaatiosta (Thomas ja Pasquini, 2018). Galektiini-3:n ilmentymistä on havaittu tuman ja sytoplasman alueella (Liu ym., 2002). Lisäksi makrofagit ja aktivoitunut mikroglia voivat vapauttaa Galektiini-3:a solunulkoiseen tilaan, mikä johtaa solunulkoisen matriksin uudelleenmuotoiluun ja vastaavasti muuttuneeseen tulehdusvasteeseen (Li ym., 2008; Jeon ym., 2010). Klassisen endoplasmisen retikulumin/Golgin erittymisreitin sijasta galektiini-3 noudattaa erittymisessä ja viennissä vaihtoehtoista eritysreittiä (Mehul ja Hughes, 1997), ja vapautuessaan galektiini-3 on vuorovaikutuksessa useiden solunulkoisten reseptorien kanssa. Vaikka galektiini-3 liittyy läheisesti tulehdusreaktioiden kaskadiin, galektiini-3:n tarkka toiminnallinen rooli neuroinflammaatiossa on suurelta osin kiistanalainen. On kuitenkin raportoitu, että mikroglian vapauttama galektiini-3 toimi endogeenisena TLR-4 (Toll Like Receptor-4) -ligandina (Burguillos ym., 2015). Lisäksi galektiini-3:n geneettinen poisto vähensi neuronaalista menetystä ja galektiini-3-vasta-aineen antamisella oli neuroprotektiivisia vaikutuksia traumaattisen aivovamman prekliinisessä mallissa (Yip et al., 2017), mikä yhdessä viittaa galektiini-3:n haitalliseen rooliin aivovamman jälkeen. Sitä vastoin Galektiini-3:n kohdennettu deletointi pahensi iskeemistä aivovammaa ja neurodegeneraatiota aivoinfarktin jälkeen (Lalancette-Hebert et al., 2012), mikä viittaa Gelectin-3:n neuroprotektiiviseen rooliin aivovaurion jälkeen. Lisäksi Gelektiini-3 edistää angiogeneesiä ja neurogeneesiä, mikä viittaa sen mahdolliseen rooliin aivojen iskemian jälkeisessä korjauksessa (Yan et al., 2009). Galektiini-3 edisti myös oligodendroglian erilaistumista, mikä edistää toiminnallista elpymistä demyelinoivien häiriöiden jälkeen (Pasquini et al., 2011). Nämä Galektiini-3:n ristiriitaiset toiminnalliset roolit neuropatologian jälkeen voivat johtua Galektiini-3:n erilaisesta subcellulaarisesta ilmentymisestä tai aivosairauksien patofysiologian eroista, jotka vaativat lisätutkimuksia.
Yhtäpitävästi muiden neuropatologisten tilojen kanssa havaitsimme Galektiini-3:n kohonneen ilmentymisen ICH:n jälkeen, ja ilmentymistä havaittiin pääasiassa Iba1-positiivisissa soluissa, jotka ovat keskushermostokudoksen tulehdussoluja. Iba1-positiiviset solut ICH:n jälkeen voivat olla joko mikroglioita tai infiltroivia makrofageja, joilla on rooli synnynnäisessä immuunivasteessa. Viimeaikaiset tutkimukset osoittavat, että mikroglioilla ja makrofageilla voi olla erilainen rooli aivopatologian jälkeen (Gao ym., 2017). Näiden linjojen mukaisesti primaarisilla mikrogliaviljelmillä tehdyt tutkimukset dokumentoivat Galectin-3:n proinflammatorisen roolin (Burguillos ym., 2015), kun taas makrofageilla tehdyt tutkimukset osoittavat anti-inflammatorisen roolin (MacKinnon ym., 2008), mikä edellyttää lisätutkimuksia. Lisäksi Galektiini-3:n geneettinen knockdown RAW 246.7 -soluissa lisäsi heminin indusoimaa IL-6:n, proinflammatorisen sytokiinin, vapautumista, mikä viittaa Galektiini-3:n rooliin tulehdusvasteissa ICH:n jälkeen. Lisäksi Galektiini-3:a ilmentävät mikrogliat tai makrofagit osoittivat fagosytoivaa fenotyyppiä, mikä viittaa sen tutkimattomaan rooliin mikroglia- tai makrofagivälitteisessä fagosytoosissa, jolla on keskeinen rooli hematooman purkautumisessa ja sitä seuraavassa aivojen toipumisessa ICH:n jälkeen. Johdonmukaisesti viimeaikaiset raportit viittaavat siihen, että makrofagit, jotka kerääntyvät keskushermostoon loisinfektion aikana, ilmentävät runsaasti Galektiini-3:a (Quenum Zangbede et al., 2018) ja aktivoitunut mikroglia fagosytoi soluja Galektiini-3:n kautta (Nomura et al., 2017). Lisäksi kohonneet plasman Galektiini-3-pitoisuudet liittyivät vahvasti tulehdukseen, vakavuuteen ja huonoihin lopputuloksiin potilailla, joilla oli akuutti ICH (Yan ym., 2016). Siksi tarvitaan lisätutkimuksia, joissa selvitetään Galektiini-3:n toiminnallisia rooleja ICH:n jälkeen.
Johtopäätös
Galektiini-1:llä ja Galektiini-3:lla oli erittäin syvä ja lisääntynyt ilmentyminen 3. päivästä 7. päivään loukkaantumisen jälkeen ICH:n jälkeisellä perihematomaalisella aivoalueella verrattuna Shamiin. Lisäksi Galektiini-1:n ilmentymistä havaittiin enimmäkseen GFAP-positiivisissa astrosyyteissä, kun taas Galektiini-3:n ilmentymistä havaittiin enimmäkseen Iba1- ja CD16/32-positiivisissa soluissa, jotka ovat CNS:n tulehdussoluja. Lisäksi geneettiset tutkimukset paljastivat sekä Galektiini-1:n että Galektiini-3:n negatiivisen säätelyroolin proinflammatorisen sytokiinin, IL-6:n, vapautumisessa ärsykkeestä riippuen. Kaiken kaikkiaan tiedot viittaavat siihen, että Galektiini-1 ja Galektiini-3 voisivat olla kohteena gliavasteiden ja siten aivovaurion moduloinnissa ICH:n jälkeen, mikä edellyttää lisätutkimuksia.
Eettiset lausunnot
Elkotutkimukset tarkistettiin ja hyväksyttiin Augustan yliopiston tutkimus- ja opetuskäytön eläinkomiteassa NIH:n ja USDA:n ohjeiden mukaisesti.
Tekijän kontribuutiot
FB suoritti immunohistokemialliset ja soluviljelytutkimukset sekä western blottingin ja osallistui tietojen analysointiin. SS-R ideoi ja suunnitteli kokeet, suoritti eläinleikkaukset, geneettiset tutkimukset ja tietojen analysoinnin sekä laati käsikirjoituksen. Molemmat kirjoittajat lukivat ja hyväksyivät lopullisen käsikirjoituksen.
Rahoitus
Tätä työtä on tuettu National Institutes of Healthin (R01NS107853) ja American Heart Associationin (14SDG18730034) apurahoilla SS-R:lle.
Erittely eturistiriidoista
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Täydentävä aineisto
Tämän artikkelin täydentävä aineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/articles/10.3389/fncel.2019.00157/full#supplementary-material
KUVIO S1 | Hematooman ajallinen kuvio ICH:n jälkeen.
Lyhenteet
CD16/32, Cluster of Differentiation 16/32; CD45: Cluster of Differentiation 45; CNS, keskushermosto; ELISA, entsyymisidonnainen immunosorbenttimääritys; GFAP, glial fibrillary acidic protein; Hb, hemoglobiini; Iba1, ionisoitunutta kalsiumia sitova adaptaattorimolekyyli 1; ICH, intrakerebraalinen verenvuoto; LPS, lipopolysakkaridi; NeuN, hermosolujen ytimet; PBS, fosfaattipuskurisuolaliuos; RIPA, radioimmunoprecipitation.
Aguilar, M.I., ja Freeman, W. D. (2010). Spontaani aivonsisäinen verenvuoto. Semin. Neurol. 30, 555-564.
Google Scholar
Ahmad, A. S., Mendes, M., Hernandez, D., and Dore, S. (2017). Laropiprantin tehokkuus aivovamman minimoimisessa kokeellisen aivoverenvuodon jälkeen. Sci. Rep. 7:9489.
PubMed Abstract | Google Scholar
Babu, R., Bagley, J. H., Di, C., Friedman, A. H., ja Adamson, C. (2012). Trombiini ja hemiini keskeisinä tekijöinä aivoverenvuodon aiheuttaman sekundaarisen aivovamman mekanismeissa ja mahdollisina interventiokohteina. Neurosurg. Focus 32:E8.
PubMed Abstract | Google Scholar
Barondes, S. H., Castronovo, V., Cooper, D. N., Cummings, R. D., Drickamer, K., Feizi, T., et al. (1994a). Galektiinit: eläinten beetagalaktosidia sitovien lektiinien perhe. Cell 76, 597-598. doi: 10.1016/0092-8674(94)90498-7
CrossRef Full Text | Google Scholar
Barondes, S. H., Cooper, D. N., Gitt, M. A., ja Leffler, H. (1994b). Galektiinit. Eläinlektiinien suuren perheen rakenne ja toiminta. J. Biol. Chem. 269, 20807-20810.
Google Scholar
Barrionuevo, P., Beigier-Bompadre, M., Ilarregui, J. M., Toscano, M. A., Bianco, G. A., Isturiz, M. A., et al. (2007). Galektiini-1:n uusi tehtävä synnynnäisen ja adaptiivisen immuniteetin risteyksessä: galektiini-1 säätelee monosyyttien/makrofagien fysiologiaa ei-apoptoottisen ERK-riippuvaisen reitin kautta. J. Immunol. 178, 436-445. doi: 10.4049/jimmunol.178.1.436
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonsack, F. T., Alleyne, C. H. Jr., and Sukumari-Ramesh, S. (2016). TSPO:n lisääntynyt ilmentyminen aivonsisäisen verenvuodon jälkeen: rooli tulehduksessa? J. Neuroinflamm. 13:151.
PubMed Abstract | Google Scholar
Broderick, J., Connolly, S., Feldmann, E., Hanley, D., Kase, C., Krieger, D., et al. (2007). Aikuisten spontaanin aivoverenvuodon hoitosuositukset: vuoden 2007 päivitys: American heart association/american stroke associationin aivohalvausneuvoston, korkean verenpaineen tutkimusneuvoston ja hoidon laadun ja tutkimustulosten monitieteisen työryhmän suuntaviivat. Circulation 116,e391-e413.
Google Scholar
Burguillos, M. A., Svensson, M., Schulte, T., Boza-Serrano, A., Garcia-Quintanilla, A., Kavanagh, E., et al. (2015). Mikroglian erittämä galektiini-3 toimii tollin kaltaisen reseptorin 4 ligandina ja edistää mikroglian aktivaatiota. Cell Rep. 10, 1626-1638. doi: 10.1016/j.celrep.2015.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Cai, Y., Cho, G. S., Ju, C., Wang, S. L., Ryu, J. H., Shin, C. Y., et al. (2011). Aktivoidut mikrogliat ovat vähemmän alttiita hemiinimyrkyllisyydelle, koska typpioksidista riippuvainen JNK:n ja p38 MAPK:n aktivaation esto vaikuttaa. J. Immunol. 187, 1314-1321. doi: 10.4049/jimmunol.1002925
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlsson, S., Oberg, C. T., Carlsson, M. C., Sundin, A., Nilsson, U. J., Smith, D., et al. (2007). Galektiini-8:n ja sen hiilihydraatteja tunnistavien domeenien affiniteetti ligandeille liuoksessa ja solun pinnalla. Glycobiology 17, 663-676. doi: 10.1093/glycob/cwm026
PubMed Abstract | CrossRef Full Text | Google Scholar
Carmichael, S. T., Vespa, P. M., Saver, J. L., Coppola, G., Geschwind, D. H., Starkman, S., et al. (2008). Vaurioiden ja suojautumisen genomiprofiilit ihmisen aivoverenvuodossa. J. Cereb. Blood Flow Metab. 28, 1860-1875. doi: 10.1038/jcbfm.2008.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedeno-Laurent, F., Opperman, M., Barthel, S. R., Kuchroo, V. K. ja Dimitroff, C. J. (2012). Galektiini-1 laukaisee immunoregulatorisen allekirjoituksen Th-soluissa, joka on toiminnallisesti määritelty IL-10-ekspressiolla. J. Immunol. 188, 3127-3137. doi: 10.4049/jimmunol.1103433
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen-Roetling, J., Kamalapathy, P., Cao, Y., Song, W., Schipper, H. M. ja Regan, R. F. (2017). Astrosyyttien hemioksygenaasi-1 vähentää kuolleisuutta ja parantaa lopputulosta kollagenaasin aiheuttaman aivoverenvuodon jälkeen. Neurobiol. Dis. 102, 140-146. doi: 10.1016/j.nbd.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Correa, S. G., Sotomayor, C. E., Aoki, M. P., Maldonado, C. A. ja Rabinovich, G. A. (2003). Galektiini-1:n vastakkaiset vaikutukset L-arginiinin vaihtoehtoisiin aineenvaihduntareitteihin paikallisissa, tulehduksellisissa ja aktivoituneissa makrofageissa. Glycobiology 13, 119-128. doi: 10.1093/glycob/cwg010
PubMed Abstract | CrossRef Full Text | Google Scholar
Dang, T. N., Robinson, S. R., Dringen, R. ja Bishop, G. M. (2011). Hemiinin imeytyminen, metabolia ja toksisuus viljellyissä neuroneissa. Neurochem. Int. 58, 804-811. doi: 10.1016/j.neuint.2011.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, H., Danzi, M. C., Choi, C. S., Taherian, M., Dalby-Hansen, C., Ellman, D. G., ym. et al. (2017). Mikroglian ja makrofagisen TNFR2:n vastakkaiset tehtävät kokeellisen autoimmuunisen enkefalomyeliitin patogeneesissä. Cell Rep. 18, 198-212. doi: 10.1016/j.celrep.2016.11.083
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldring, K., Jones, G. E., Thiagarajah, R. ja Watt, D. J. (2002). Galektiini-1:n vaikutus fibroblastien ja myoblastien erilaistumiseen in vitro. J. Cell Sci. 115(Pt 2), 355-366.
PubMed Abstract | Google Scholar
Hickenbottom, S. L., Grotta, J. C., Strong, R., Denner, L. A. ja Aronowski, J. (1999). Ydintekijä-kappaB ja solukuolema rottien kokeellisen aivoverenvuodon jälkeen. Stroke 30, 2472-2477.
Google Scholar
Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., et al. (2002). Galektiinien oligosakkaridispesifisyys: etsiminen frontaalisen affiniteettikromatografian avulla. Biochim. Biophys. Acta 1572, 232-254. doi: 10.1016/s0304-4165(02)00311-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Horie, H., and Kadoya, T. (2002). Galektiini-1:llä on olennainen rooli aikuisten nisäkkäiden hermokudoksissa. Hapettuneen galektiini-1:n roolit. Glycoconjugate J. 19, 479-489. doi: 10.1023/b:glyc.0000014077.84016.52
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishibashi, S., Kuroiwa, T., Sakaguchi, M., Sun, L., Kadoya, T., Okano, H., ym. al. (2007). Galektiini-1 säätelee neurogeneesiä subventrikulaarisella vyöhykkeellä ja edistää toiminnallista elpymistä aivohalvauksen jälkeen. Exp. Neurol. 207, 302-313. doi: 10.1016/j.expneurol.2007.06.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. B., Yoon, H. J., Chang, C. Y., Koh, H. S., Jeon, S. H., and Park, E. J. (2010). Galektiini-3 harjoittaa sytokiinien kaltaisia säätelytoimia JAK-STAT-reitin kautta. J. Immunol. 185, 7037-7046. doi: 10.4049/jimmunol.1000154
PubMed Abstract | CrossRef Full Text | Google Scholar
Kasai, K., ja Hirabayashi, J. (1996). Galektiinit: eläinten lektiiniperhe, joka purkaa glykokoodeja. J. Biochem. 119, 1-8. doi: 10.1093/oxfordjournals.jbchem.a021192
CrossRef Full Text | Google Scholar
Laaf, P., Elling, L., ja Kren, V. (2019). Galektiinin ja hiilihydraatin vuorovaikutukset biolääketieteessä ja biotekniikassa. Trends Biotechnol. 37, 402-415.
PubMed Abstract | Google Scholar
Laird, M. D., Sukumari-Ramesh, S., Swift, A. E., Meiler, S. E., Vender, J. R. ja Dhandapani, K. M. (2010). Kurkumiini lievittää aivoturvotusta hiirten traumaattisen aivovamman jälkeen: mahdollinen rooli akvaporin-4:lle? J. Neurochem. 113, 637-648. doi: 10.1111/j.1471-4159.2010.06630.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lalancette-Hebert, M., Swarup, V., Beaulieu, J. M., Bohacek, I., Abdelhamid, E., Weng, Y. C., ym. et al (2012). Galektiini-3:a tarvitaan paikallisen mikroglian aktivoitumiseen ja proliferaatioon vasteena iskeemiseen vaurioon. J. Neurosci. 32, 10383-10395. doi: 10.1523/jneurosci.1498-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Leffler, H., Carlsson, S., Hedlund, M., Qian, Y., ja Poirier, F. (2002). Johdatus galektiineihin. Glycoconjugate J. 19, 433-440. doi: 10.1023/b:glyc.0000014072.34840.04
CrossRef Full Text | Google Scholar
Leira, R., Davalos, A., Silva, Y., Gil-Peralta, A., Tejada, J., Garcia, M., et al. (2004). Varhainen neurologinen heikkeneminen aivoverenvuodon yhteydessä: ennusteet ja niihin liittyvät tekijät. Neurology 63, 461-467. doi: 10.1212/01.wnl.0000133204.81153.ac
CrossRef Full Text | Google Scholar
Lekishvili, T., Hesketh, S., Brazier, M. W., and Brown, D. R. (2006). Hiiren galektiini-1 estää glutamaatin toksisuutta muuttamalla NR1 NMDA-reseptorin ilmentymistä. Eur. J. Neurosci. 24, 3017-3025. doi: 10.1111/j.1460-9568.2006.05207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Y., Komai-Koma, M., Gilchrist, D. S., Hsu, D. K., Liu, F. T., Springall, T., ym. et al (2008). Galektiini-3 on lipopolysakkaridivälitteisen tulehduksen negatiivinen säätelijä. J. Immunol. 181, 2781-2789. doi: 10.4049/jimmunol.181.4.2781
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, S., Yin, Q., Zhong, Q., Lv, F. L., Zhou, Y., Li, J. Q., et al. (2012). Heme aktivoi TLR4-välitteisen tulehdusvaurion MyD88 / TRIF-signalointireitin kautta aivoverenvuodossa. J. Neuroinflamm. 9:46.
PubMed Abstract | Google Scholar
Liu, F. T., Patterson, R. J., ja Wang, J. L. (2002). Galektiinien solunsisäiset toiminnot. Biochim. Biophys. Acta 1572, 263-273. doi: 10.1016/s0304-4165(02)00313-6
CrossRef Full Text | Google Scholar
MacKinnon, A. C., Farnworth, S. L., Hodkinson, P. S., Henderson, N. C., Atkinson, K. M., Leffler, H., et al. (2008). Vaihtoehtoisen makrofagien aktivaation säätely galektiini-3:n avulla. J. Immunol. 180, 2650-2658. doi: 10.4049/jimmunol.180.4.2650
CrossRef Full Text | Google Scholar
Mehul, B., ja Hughes, R. C. (1997). Galektiini 3:n plasmakalvon kohdentuminen, vesikulaarinen budding ja vapautuminen nisäkässolujen sytoplasmasta erittymisen aikana. J. Cell Sci. 110( Pt 10), 1169-1178.
PubMed Abstract | Google Scholar
Min, H., Choi, B., Jang, Y. H., Cho, I. H., and Lee, S. J. (2017). Heme-molekyyli toimii astrosyyttien TLR2: n endogeenisena agonistina, joka edistää sekundaarisia aivovaurioita aivojen sisäisen verenvuodon jälkeen. Mol. Brain 10:27.
PubMed Abstract | Google Scholar
Moiseeva, E. P., Spring, E. L., Baron, J. H., ja de Bono, D. P. (1999). Galektiini 1 moduloi viljeltyjen verisuonten sileiden lihassolujen kiinnittymistä, leviämistä ja migraatiota vuorovaikutuksen kautta solureseptorien ja solunulkoisen matriisin komponenttien kanssa. J. Vasc. Res. 36, 47-58. doi: 10.1159/000025625
PubMed Abstract | CrossRef Full Text | Google Scholar
Nomura, K., Vilalta, A., Allendorf, D. H., Hornik, T. C. ja Brown, G. C. (2017). Aktivoitu mikroglia desialyloi ja fagosytoi soluja neuraminidaasin kautta. Galektiini-3:n ja Mer-tyrosiinikinaasin välityksellä. J. Immunol. 198, 4792-4801. doi: 10.4049/jimmunol.1502532
PubMed Abstract | CrossRef Full Text | Google Scholar
Parikh, N. U., Aalinkeel, R., Reynolds, J. L., Nair, B. B., Sykes, D. E., Mammen, M. J., ym. et al. (2015). Galektiini-1 tukahduttaa metamfetamiinin aiheuttamaa neuroinflammatiota ihmisen aivojen mikrovaskulaarisissa endoteelisoluissa: neuroprotektiivinen rooli veriaivoesteen eheyden ylläpitämisessä. Brain Res. 1624, 175-187. doi: 10.1016/j.brainres.2015.07.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasquini, L. A., Millet, V., Hoyos, H. C., Giannoni, J. P., Croci, D. O., Marder, M., ym. al. (2011). Galektiini-3 ohjaa oligodendrosyyttien erilaistumista myeliinin eheyden ja toiminnan hallitsemiseksi. Cell Death. Diff. 18, 1746-1756. doi: 10.1038/cdd.2011.40
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Marcus, M. E., and Baum, L. G. (1998). Galektiinit: solujen adheesion, solujen proliferaation ja solukuoleman monipuoliset modulaattorit. J. Mol. Med. (Berl.) 76, 402-412. doi: 10.1007/s001090050232
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Pace, K. E., Seilhamer, J. J. ja Baum, L. G. (1995). Galektiini-1:n välittämä T-solujen apoptoosi. Nature 378, 736-739. doi: 10.1038/378736a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Platt, N., da Silva, R. P., ja Gordon, S. (1998). Kuoleman tunnistaminen: apoptoottisten solujen fagosytoosi. Trends Cell Biol. 8, 365-372. doi: 10.1016/s0962-8924(98)01329-4
CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Ma, J. F., Tian, D. S., Zhang, Q., Pan, D. J., et al. (2011). Galektiini-1 vaimentaa astroglioosiin liittyviä vammoja ja parantaa rottien toipumista fokaalisen aivo-iskemian jälkeen. J. Neurochem. 116, 217-226. doi: 10.1111/j.1471-4159.2010.07095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Wang, J. H., Wang, J. P., Tang, Y. X., Zhang, Q., Zhang, Q., Tian, D. S., ym. et al. (2010). Galektiini-1 tehostaa astrosyyttistä BDNF-tuotantoa ja parantaa toiminnallista tulosta rotilla iskemian jälkeen. Neurochem. Res. 35, 1716-1724. doi: 10.1007/s11064-010-0234-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Quenum Zangbede, F. O., Chauhan, A., Sharma, J. ja Mishra, B. B. (2018). Galektiini-3:lla M2-makrofageissa on suojaava rooli neuropatologian ratkaisussa aivojen loisinfektiossa säätelemällä neutrofiilien vaihtuvuutta. J. Neurosci. Loukkaantuneiden, nekroottisten ja apoptoottisten solujen kvantitatiivinen analyysi uudessa kokeellisessa aivoverenvuodon mallissa. Crit. Care Med. 29, 152-157. doi: 10.1097/00003246-200101000-00030
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Tuhrim, S., Broderick, J. P., Batjer, H. H., Hondo, H. ja Hanley, D. F. (2001b). Spontaani aivoverenvuoto. N. Engl. J. Med. 344, 1450-1460.
Google Scholar
Ribo, M., ja Grotta, J. C. (2006). Aivoverenvuodon uusimmat edistysaskeleet. Curr. Neurol. Neurosci. Rep. 6, 17-22. doi: 10.1007/s11910-996-0004-0
CrossRef Full Text | Google Scholar
Robinson, S. R., Dang, T. N., Dringen, R. ja Bishop, G. M. (2009). Hemin toksisuus: estettävissä oleva aivovaurion lähde hemorragisen aivohalvauksen jälkeen. Redox Rep. 14, 228-235. doi: 10.1179/135100009×12525712409931
PubMed Abstract | CrossRef Full Text | Google Scholar
Sasaki, T., Hirabayashi, J., Manya, H., Kasai, K. ja Endo, T. (2004). Galektiini-1 indusoi astrosyyttien erilaistumista, mikä johtaa aivoista peräisin olevan neurotrofisen tekijän tuotantoon. Glycobiology 14, 357-363. doi: 10.1093/glycob/cwh043
PubMed Abstract | CrossRef Full Text | Google Scholar
Shiratori, M., Tozaki-Saitoh, H., Yoshitake, M., Tsuda, M. ja Inoue, K. (2010). P2X7-reseptorin aktivaatio indusoi CXCL2-tuotantoa mikrogliassa NFAT- ja PKC/MAPK-reittien kautta. J. Neurochem. 114, 810-819. doi: 10.1111/j.1471-4159.2010.06809.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Starossom, S. C., Mascanfroni, I. D., Imitola, J., Cao, L., Raddassi, K., Hernandez, S. F., ym. et al (2012). Galektiini-1 deaktivoi klassisesti aktivoitunutta mikrogliaa ja suojaa tulehduksen aiheuttamalta neurodegeneraatiolta. Immunity 37,249-263. doi: 10.1016/j.immuni.2012.05.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Stillman, B. N., Hsu, D. K., Pang, M., Brewer, C. F., Johnson, P., Liu, F. T., et al. (2006). Galektiini-3 ja galektiini-1 sitoutuvat erilaisiin solupinnan glykoproteiinireseptoreihin indusoidakseen T-solujen kuoleman. J. Immunol. 176, 778-789. doi: 10.4049/jimmunol.176.2.778
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., ja Alleyne, C. H. Jr. (2016). Vamman jälkeinen tert-butyylihydrokinonin antaminen heikentää akuuttia neurologista vammaa aivonsisäisen verenvuodon jälkeen hiirillä. J. Mol. Neurosci. MN 58, 525-531. doi: 10.1007/s12031-016-0722-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr. ja Dhandapani, K. M. (2012a). Astrosyytti-spesifinen surviviinin ilmentyminen hiirten aivoverenvuodon jälkeen: mahdollinen rooli reaktiivisessa glioosissa? J. Neurotrauma 29, 2798-2804. doi: 10.1089/neu.2011.2243
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2012b). Astroglioosi: interventiokohde aivonsisäisessä verenvuodossa? Transl. Stroke Res. 3(Suppl. 1), 80-87. doi: 10.1007/s12975-012-0165-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., ja Dhandapani, K. M. (2016). Histonideasetylaasin estäjä suberoylanilidihydroksamiinihappo (SAHA) antaa akuuttia neuroprotektiota aivonsisäisen verenvuodon jälkeen hiirillä. Transl. Stroke Res. 7, 141-148. doi: 10.1007/s12975-015-0421-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tessier, P. A., Naccache, P. H., Clark-Lewis, I., Gladue, R. P., Neote, K. S. ja McColl, S. R. (1997). Kemokiiniverkostot in vivo: C-X-C- ja C-C-kemokiinien osallistuminen neutrofiilien ekstravasaatioon in vivo vasteena TNF-alfa:lle. J. Immunol. 159, 3595-3602.
PubMed Abstract | Google Scholar
Thomas, L., and Pasquini, L. A. (2018). Galektiini-3-välitteinen glial crosstalk ajaa oligodendrosyyttien erilaistumista ja (Re)myelinisaatiota. Front. Cell. Neurosci. 12:297. doi: 10.3389/fncel.2018.00297
PubMed Abstract | CrossRef Full Text | Google Scholar
Toscano, M. A., Bianco, G. A., Ilarregui, J. M., Croci, D. O., Correale, J., Hernandez, J. D., ym. et al. (2007). TH1-, TH2- ja TH-17-efektorisolujen erilainen glykosylaatio säätelee selektiivisesti alttiutta solukuolemalle. Nat. Immunol. 8, 825-834. doi: 10.1038/ni1482
PubMed Abstract | CrossRef Full Text | Google Scholar
van Asch, C. J., Luitse, M. J., Rinkel, G. J., van der Tweel, I., Algra, A. ja Klijn, C. J. (2010). Aivoverenvuodon ilmaantuvuus, kuolemaan johtaneet tapaukset ja toiminnalliset tulokset iän, sukupuolen ja etnisen alkuperän mukaan: systemaattinen katsaus ja meta-analyysi. Lancet Neurol. 9, 167-176. doi: 10.1016/s1474-4422(09)70340-0
PubMed Abstract | CrossRef Full Text | Google Scholar
van der Leij, J., van den Berg, A., Blokzijl, T., Harms, G., van Goor, H., Zwiers, P., et al. (2004). Dimerinen galektiini-1 indusoi IL-10-tuotantoa T-lymfosyyteissä: tärkeä väline immuunivasteen säätelyssä. J. Pathol. 204, 511-518. doi: 10.1002/path.1671
PubMed Abstract | CrossRef Full Text | Google Scholar
Verschuere, T., Toelen, J., Maes, W., Poirier, F., Boon, L., Tousseyn, T., ym. et al. (2014). Glioomasta peräisin oleva galektiini-1 säätelee synnynnäistä ja adaptiivista kasvainvastaista immuniteettia. Int. J. Cancer 134, 873-884. doi: 10.1002/ijc.28426
PubMed Abstract | CrossRef Full Text | Google Scholar
Vespa, G. N., Lewis, L. A., Kozak, K. R., Moran, M., Nguyen, J. T., Baum, L. G., et al. (1999). Galektiini-1 moduloi spesifisesti TCR-signaaleja tehostaen TCR-apoptoosia mutta estäen IL-2-tuotantoa ja proliferaatiota. J. Immunol. 162, 799-806.
PubMed Abstract | Google Scholar
Walzel, H., Schulz, U., Neels, P., ja Brock, J. (1999). Galektiini-1, reseptorityyppisen proteiinityrosiinifosfataasi CD45:n luonnollinen ligandi. Immunol. Lett. 67, 193-202. doi: 10.1016/s0165-2478(99)00012-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. (2010). Prekliininen ja kliininen tutkimus tulehduksesta aivoverenvuodon jälkeen. Prog. Neurobiol. 92, 463-477. doi: 10.1016/j.pneurobio.2010.08.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., ja Dore, S. (2007). Tulehdus aivonsisäisen verenvuodon jälkeen. J. Cereb. Blood Flow Metab. 27, 894-908.
Google Scholar
Weng, X., Tan, Y., Chu, X., Chu, X. F., Wu, X. F., Liu, R., Tian, Y., et al. (2015). N-metyyli-D-asparagiinihapporeseptori 1 (NMDAR1) pahentaa hemiini-NLRP3-reitin aiheuttamia sekundaarisia tulehdusvaurioita aivoverenvuodon jälkeen. Chin. J. Traumatol. 18, 254-258. doi: 10.1016/j.cjtee.2015.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaoka, K., Mishima, K., Nagashima, Y., Asai, A., Sanai, Y. ja Kirino, T. (2000). Galektiini-1 mRNA:n ilmentyminen korreloi ihmisen glioomien pahanlaatuisen potentiaalin kanssa ja antisense galektiini-1:n ilmentyminen estää 9 glioomasolun kasvua. J. Neurosci. Res. 59, 722-730. doi: 10.1002/(sici)1097-4547(20000315)59:6<722::aid-jnr4>3.0.co;2-h
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, X. J., Yu, G. F., Jie, Y. Q., Fan, X. F., Huang, Q. ja Dai, W. M. (2016). Galektiini-3:n rooli plasmassa ennustavana biomarkkerina akuutin aivoverenvuodon jälkeen. J. Neurol. Sci. 368, 121-127. doi: 10.1016/j.jns.2016.06.071
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, Y. P., Lang, B. T., Vemuganti, R. ja Dempsey, R. J. (2009). Galektiini-3 välittää post-iskeemisen kudoksen uudelleenmuotoilua. Brain Res. 1288, 116-124. doi: 10.1016/j.brainres.2009.06.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, R. Y., Hsu, D. K., ja Liu, F. T. (1996). Galektiini-3:n ilmentyminen moduloi T-solujen kasvua ja apoptoosia. Proc. Natl. Acad. Sci. U.S.A. 93, 6737-6742. doi: 10.1073/pnas.93.13.6737
PubMed Abstract | Ref Full Text | Google Scholar
Yip, P. K., Carrillo-Jimenez, A., King, P., Vilalta, A., Nomura, K., Chau, C. C., et al. (2017). Traumaattisen aivovamman seurauksena vapautuva galektiini-3 toimii alarminina, joka orkestroi aivojen immuunivastetta ja edistää neurodegeneraatiota. Sci. Rep. 7:41689.
PubMed Abstract | Google Scholar
Zhao, X., Zhang, Y., Strong, R., Zhang, J., Grotta, J. C. ja Aronowski, J. (2007). Aivoverenvuodon aiheuttamien muutosten erilaiset mallit NF-kappaB-alayksikön, iNOS:n ja COX-2:n ilmentymisessä. J. Neurochem. 101, 652-663. doi: 10.1111/j.1471-4159.2006.04414.x
PubMed Abstract | CrossRef Full Text | Google Scholar