- Introduction
- Materiaalit ja menetelmät
- eläimet ja asuminen
- Gaboksadolihoito ja kokeellinen aikataulu
- Avoimen kentän testi (OFT)
- Seuraavien kujien testi (SAT)
- Light-Dark Exploration Test (LDT)
- Sosiaalinen vuorovaikutus (SI), aggressiivinen käyttäytyminen
- Stereotypia
- Self-grooming
- Statistinen analyysi
- Tulokset
- Gaboksadoli normalisoi Fmr1 KO2 -hiirillä havaittua hyperaktiivisuutta
- Fmr1 KO2 -hiirten ahdistuneisuuden kaltainen käyttäytyminen normalisoituu gaboksadolilla
- Irritoituvuus ja aggressiivinen käyttäytyminen Fmr1 KO2 -hiirillä normalisoituvat gaboksadolilla
- Gaboksadoli normalisoi toistuvaa käyttäytymistä Fmr1 KO2 -hiirillä
- Keskustelu
- Eettinen lausunto
- Tekijöiden panos
- Rahoitus
- Erittely eturistiriidoista
Introduction
Fragiilin X:n oireyhtymä (FXS, Fragile X Syndrome) on yleisin perinnöllinen älyllisen kehitysvammaisuuden ja autismin kirjon muoto, jonka arvioitu esiintymisfrekvenssi on 1:4000-5000, ja se koskettaa kaikkia etnisiin ryhmiin kuuluvia ryhmiä kaikkialla maailmassa (Gross et al., 2015). FXS-oireyhtymää sairastavilla henkilöillä on kohonnut riski moniin käyttäytymiseen liittyviin ongelmiin, kuten tarkkaavaisuusongelmiin, hyperaktiivisuuteen, ahdistuneisuuteen ja moniin autismiin liittyviin piirteisiin, kuten motorisiin stereotypioihin, sosiaaliseen välttelyyn, itseään vahingoittavaan käyttäytymiseen ja aggressiivisuuteen (Hagerman ym., 2010). Lisäksi FXS:ää sairastavat henkilöt ovat alttiita liitännäissairauksille, kuten kouristuksille, unihäiriöille, ruoansulatuskanavan ongelmille ja sidekudosongelmille. FXS-oireyhtymää sairastaville tarjotaan käyttäytymisinterventioita ja yksittäisten oireiden farmakologista hoitoa, mutta tällä hetkellä ei ole FDA:n hyväksymiä hoitoja oireyhtymän hoitamiseksi kokonaisuutena.
FXS on seurausta FMR1-geenin mutaatioista, jotka estävät hauraan X:n mielenterveysongelmiin liittyvän proteiinin (fragile X mental retardation protein, FMRP) ilmentymisen. FMRP on ubiikkisesti ilmentyvä mRNA:ta sitova proteiini, jota tarvitaan 4-8 % synaptisten proteiinien kuljetukseen ja translaatioon, ja se säätelee siten erilaisia synaptisia toimintoja (Bassell ja Warren, 2008). FMRP:n roolia FXS:ssä ja hoitoehdokkaiden arviointia on tutkittu suurelta osin käyttämällä Fmr1 knockout (KO) -hiirimallia, jonka hollantilais-belgialainen Fragile X -konsortio (Bakker ym., 1994) luonnehti ensimmäisen kerran. Fmr1 KO -malli luotiin lisäämällä kohdennetusti neomysiinikasetti FMR1-geenin eksoniin 5. Tuloksena oli hiiri, jonka FMRP-proteiinipitoisuuksia ei voitu havaita ja jonka Fmr1-mRNA:n jäännöspitoisuudet olivat alhaiset (Bakker ym., 1994). Fmr1 KO2 -hiiri kohdistuu uuteen Fmr1:n nolla-alleeliin, joka on tuotettu poistamalla Fmr1:n promoottori ja ensimmäinen eksoni (Mientjes ym., 2006). Se on sekä proteiini- että mRNA-nolla. Tätä mallia on käytetty laajalti lääketestaukseen (Deacon et al., 2015; Cheng et al., 2017; Gaudissard et al., 2017; Dahlhaus, 2018; Leboucher et al., 2019; Tranfaglia et al., 2019), ja käyttäytymistestien patteristo on keskittynyt suurelta osin hyperaktiivisuuteen, lisääntyneeseen herkkyyteen auditiivisille ärsykkeille, stereotyyppisyyteen sekä oppimisen ja muistin puutoksiin (Olmos-Serrano et al., 2011). Solu- ja piiritasolla FXS-hiiriä koskevat tutkimukset ovat keskittyneet pitkälti yliaktiiviseen metabotrooppisen glutamaattireseptorin 5 (mGluR5) signalointiin (Dölen ym., 2007), lisääntyneeseen proteiinisynteesiin (Osterweil ym, 2010) ja tehostettuun pitkäaikaiseen potentiaatioon (LTP; Auerbach ja Bear, 2010).
FXS:n γ-aminovoihappohypoteesi (GABA)erginen hypoteesi FXS:stä on myös noussut esiin havaintojen perusteella, jotka on tehty yksilöiltä, joilla on FXS-oireyhtymä, ja hiiriltä, joilta puuttuu aktiivinen kopio Fmr1-geenistä. GABA on aivojen ensisijainen inhiboiva välittäjäaine, ja se signaloi postsynaptisesti joko nopeiden ionotrooppisten (GABAA) reseptorien tai hitaiden metabotrooppisten (GABAB) reseptorien kautta. GABAA-reseptoripopulaation sisällä erotetaan edelleen synaptiset ja ekstrasynaptiset reseptorit, jotka välittävät vastaavasti faasista ja toonista inhibitiota (Olmos-Serrano et al., 2010; Meera et al., 2011). GABAergisen hypoteesin tueksi henkilöt, joilla on FXS, osoittavat vähentynyttä GABAA-reseptorien saatavuutta (D’Hulst et ai., 2015). Tämä FXS:ää sairastavilta henkilöiltä saatu tulos on hienosti samansuuntainen kuin taudin hiirimallissa tehdyt havainnot.
Molekyylitutkimukset ovat osoittaneet GABAergisen koneiston vähenemistä, mukaan lukien muutokset GABA-reseptorin alayksiköissä, GABA-transportterissa (Rotschafer ym., 2015) ja glutamiinihappodekarboksylaasissa (GAD; D’Hulst ja Kooy, 2007; Olmos-Serrano ym., 2010). Tarkemmin sanottuna GABAA-reseptorin alayksikön delta-alayksikköä koodaavan geenin mRNA-tasojen – joka on spesifinen reseptorien ekstrasynaptiselle populaatiolle – on raportoitu vähentyneen (Gantois et ai., 2006). GABAergisen toiminnan osalta synaptisen GABA:n vapautuminen väheni ja faasinen ja tooninen inhibitio vähenivät amygdalassa (Olmos-Serrano ym., 2010).
Käyttäytymisen osalta FX-hiirillä havaittu hyperaktiivisuus, auditiivinen säikähdys sekä oppiminen ja muisti ovat korreloituneet pikkuaivoihin ja amygdalaan tulevien GABAergisten tulojen aiheuttaman inhibitorisen tonuksen häviämiseen (Olmos-Serrano ym., 2010), 2010), jotka ovat kaksi aivoaluetta, jotka liittyvät myös ihmisen FXS:ään (Lightbody ja Reiss, 2009; Hall ym., 2009), 2013).
Kriittisempää on, että delta-alayksikköä sisältävien ekstrasynaptisten GABAA-reseptorien (dSEGA:t) selektiivinen potensointi gaboksadolilla, joka tunnetaan myös nimellä OV101 ja 4,5,6,7-tetrahydroisoksatsolo-(5,4-c)pyridiini-3-oli (THIP), normalisoi poikkeavaa hyperaktiivisuutta ja auditiivisia säikähdysreaktioita Fmr1 KO -hiirissä (Olmos-Serrano et al., 2010). Tärkeää on, että nämä tulokset havaittiin altistuksilla, jotka vastasivat altistuksia, joilla gaboksadoli on hyvin siedetty ihmisillä (Meera et al., 2011).
Koska ensimmäiset kliiniset tutkimukset eivät ole vielä osoittaneet mGluR5:n estäjistä saatavaa terapeuttista hyötyä (Scharf et al., 2015), pyysimme tässä tutkimuksessa tutkimaan lähestymistapoja, jotka voisivat suoremmin informoida kliinistä suunnitelmaa, mukaan lukien laajemmat näkökohdat FXS:n fenotyypistä, joita ei ole aiemmin raportoitu. Erityisesti tässä tutkimme gaboksadolin eri annosten vaikutuksia hyperaktiivisuuteen, ahdistuneisuuteen, aggressiivisuuteen ja toistuvaan käyttäytymiseen FXS: n Fmr1 KO2 -mallissa, mikä osoittaa gaboksadolin tehokkuuspotentiaalin näiden FXS-oireiden hoidossa.
Materiaalit ja menetelmät
eläimet ja asuminen
Fmr1 KO2 -hiiret, jotka on aiemmin tuotettu poistamalla Fmr1:n promoottori ja ensimmäinen eksoni, mikä johti mRNA:n ja proteiinien nollahiiriin (Mientjes ym, 2006), käytettiin kaikissa kokeissa. Floxoidut Fmr1-hiiret kasvatettiin hiiriin, jotka ilmentävät varhaista ubikvitaarisesti ilmentyvää Cre-rekombinaasia, mikä johti Fmr1:n eliminoimiseen kaikista soluista. KO-hiiret risteytettiin vähintään kahdeksan sukupolven ajan C57BL/6J-hiiriin, ja kontrolleina käytettiin villityyppisiä pentuetovereita (WT). Kymmenen hiirtä (uroksia, 2 kuukauden ikäisiä) käytettiin kussakin hoitoryhmässä kaikissa käyttäytymiskokeissa. Heterotsygoottisia jalostuspareja käytettiin WT- ja KO-litteraattien tuottamiseen kaikissa tutkimuksissa. Urokset poistettiin kasvatushäkeistä syntymän jälkeen, naaraat poistettiin pentueista ja genotyypitys suoritettiin TransnetXY Automated Genotyping (Transnetyx, Inc., Cordova, TN, USA) -ohjelmalla käyttäen vakiintuneita alukkeita ja protokollaa. Samassa häkissä oleville hiirille ruiskutettiin sama annos gaboksadolia tai kantajaa, ja mutantit ja kontrollit sijoitettiin erikseen. Kaikki hiiret sijoitettiin ryhmiin muovihäkkeihin (35 × 30 × 12 cm), viisi hiirtä häkkiä kohti, ja ne totutettiin eläintiloihin vähintään viikon ajan ennen testausta. Huoneen lämpötilaa (21 ± 2 °C), suhteellista kosteutta (55 ± 5 %), 12 tunnin valo- ja pimeysjaksoa (valot päällä klo 7-7) ja ilmanvaihtoa (16 kertaa tunnissa) säädettiin automaattisesti. Kaikki hiiret saivat vapaasti ruokaa ja vettä. Tutkija, joka oli sokea genotyypille ja lääkehoidolle, suoritti kaikki testit valovaiheessa. Asuminen ja kokeet suoritettiin GeN DDI Limitedissä (Lontoo, Iso-Britannia) Ison-Britannian vuoden 1986 Animals (Scientific Procedures) Actin vaatimusten mukaisesti.
Gaboksadolihoito ja kokeellinen aikataulu
Fmr1 KO2 -hiirille annettiin injektiona Vehikkeli (0.9% steriiliä suolaliuosta) tai gaboksadolia (0.5, 1, 1.5, 2, 3, 4 tai 5 mg / kg, i.p.) 30 min ennen käyttäytymistestejä jokaisena testipäivänä, ja kunkin testin välillä oli kolmen päivän väli, jotta vältettäisiin lääkkeen antamisen kumulatiivinen vaikutus. Kaikkiin kokeisiin otettiin mukaan myös villityypin hiiret, jotka saivat injektiona ajoneuvoa samaan aikaan. Hiirten (n = 10 per ryhmä) käyttäytymiskokeet suoritettiin seuraavassa järjestyksessä 2-3 päivän välein kunkin testin välillä: Avoimen kentän testi (OFT; päivä 1), peräkkäiset kujat (päivä 4), valo/pimeä-laatikko (päivä 7), sosiaaliset testit ja aggressiivisuus (päivä 10) sekä itsehoito ja stereotyyppisyys (päivä 12).
Avoimen kentän testi (OFT)
Testauspäivänä 1 OFT suoritettiin VersaMax-aktiivisuusmonitori-kammiossa (AccuScan Instruments, Columbus, OH, USA). Liikunta-aktiivisuus rekisteröitiin 30 minuutin ajan suuressa pleksikammiossa (40 × 40 cm), joka oli valaistu 40 luksilla. Aktiivisuutta seurattiin infrapunasäteen katkoksilla, jotka yhdistettiin 1 minuutin jaksoihin ja dekoodattiin VersaDat-ohjelmistolla (AccuScan Instruments, Columbus, OH, USA) kuljetun matkan (cm), kuljetun keskipistematkan (cm), myötä- ja vastapäivään tehtyjen kierrosten (vähintään 5.08 cm halkaisijaltaan) ja toistuvat palkkikatkot.
Seuraavien kujien testi (SAT)
Testauspäivänä 4 hiirille suoritettiin peräkkäisten kujien testi (SAT). SAT:lla on etulyöntiasema korotettuun pluslabyrinttiin verrattuna, sillä se sulkee sisäänsä laajemman ahdistuneisuustason (Deacon, 2013). Testauskammio koostui neljästä peräkkäisestä, lineaarisesti järjestetystä, yhä ahdistavammasta (vaaleampi väri, matalammat seinät, kapeammat) kujasta, jotka olivat 25 cm pitkiä ja 50 cm korkealla maasta. Hiiriä tarkkailtiin 5 minuutin ajan laitteen yläpuolelle sijoitetun 60 W:n punaisen valon alla. Kullekin kujalle tulleiden sisäänkäyntien määrä kirjattiin.
Light-Dark Exploration Test (LDT)
Testauspäivänä 7 hiirille suoritettiin valo-/pimeä eksploraatiotesti (LDT). LDT:tä käytetään yleisesti mittaamaan hiirten ahdistuneisuuden kaltaista käyttäytymistä, joka perustuu niiden synnynnäiseen pelkoon kirkkaita, avoimia tiloja kohtaan (Prut ja Belzung, 2003). Polypropeenista valmistettu testikammio (44 × 21 × 21 cm) oli jaettu pienempään, pimeään, katettuun osastoon (14 cm) ja suurempaan, kirkkaasti valaistuun, avoimeen osastoon (28 cm) pimeällä väliseinällä, jossa oli pieni aukko (13 × 5 cm). Osastojen väliset siirtymät rekisteröitiin väliseinän aukkoon sijoitetuilla valokennoilla. Kukin hiiri asetettiin valoisalle puolelle poispäin väliseinästä, sen annettiin tutkia kammiota vapaasti 10 minuutin ajan, ja siirtymät kammioiden välillä kirjattiin.
Sosiaalinen vuorovaikutus (SI), aggressiivinen käyttäytyminen
Testauspäivänä 10 sosiaalinen vuorovaikutus (SI) ja aggressiotestaus suoritettiin häkissä, joka oli kooltaan samankokoinen kuin kotihäkki (40 × 23 × 12 cm) ja jossa oli perspex-kansi hiirten katselun helpottamiseksi. Hiiret totutettiin testaushuoneeseen 25 minuutin ajan. Kaksi koehenkilöä, koehiiri ja villityyppinen ”testihiiri”, asetettiin sen jälkeen samanaikaisesti testaushäkkiin. Sosiaalisten tutkimusten, hännän kolinan, puremien ja kiinnitysten kokonaiskesto ja määrä kirjattiin ylhäältä käsin ja mitattiin 3 minuutin ajan.
Stereotypia
Testauspäivänä 12 spontaanien stereotypioiden (pään liikkeiden) nopeudet arvioitiin muunnetulla automatisoidulla valokennolaitteistolla (Columbus Instruments, Columbus, OH, USA). Testausprotokollaan kuului hiirien poistaminen kotihäkeistään ja niiden sijoittaminen yksittäin pleksilasi-testaushäkkeihin (22 × 25 × 28 cm). Hiiret jätettiin rauhaan 2 minuutiksi tottumaan testauskammioon. Sitten kutakin hiirtä seurattiin 3 minuutin ajan stereotypiapisteiden saamiseksi, jotka vastaavat keskimääräistä stereotypiatiheyttä tunnissa. Ruokaa ja vettä annettiin koko testausjakson ajan. Stereotyyppiluku on kvantifiointi siitä, kuinka monta kertaa hiiri häiritsee samaa infrapunasädettä stereotyyppisen toiminnan jakson aikana testauslaitteella mitattuna.
Self-grooming
Testauspäivänä 12 seurattiin myös self-groomingia. Kukin hiiri asetettiin yksitellen tavalliseen hiirihäkkiin (46 × 23,5 × 20 cm), joka oli valaistu 40 luksilla. Testihäkissä olleen 5 minuutin totuttelujakson jälkeen kumulatiivinen aika, joka käytettiin minkä tahansa kehon alueen groomingiin, kirjattiin 3 minuutin ajan kumulatiivisen ajan (sekunteina) määrittämiseksi minkä tahansa kehon alueen groomingin määrittämiseksi.
Statistinen analyysi
Koska Fmr1 KO2 -hiiriä käsiteltiin gaboksadolilla tai kantaja-aineella, mutta WT-hiiriä käsiteltiin vain kantaja-aineella, parametriset tiedot analysoitiin yksisuuntaisen varianssianalyysin (ANOVA) ja Tukeyn post-hoc -testin avulla. Kaikki tiedot analysoitiin käyttämällä GraphPad Prism v7.0 (GraphPad Software, San Diego, CA, USA). Tilastollinen merkitsevyys asetettiin P < 0.05.
Tulokset
Gaboksadoli normalisoi Fmr1 KO2 -hiirillä havaittua hyperaktiivisuutta
Hyperaktiivisuus on ihmisen FXS:n silmiinpistävä piirre (Bailey et al., 2008; Wheeler ym., 2014; Hagerman ym., 2017), ja se on luotettavasti toistettu aiemmin luonnehditussa hollantilais-belgialaisessa Fmr1 KO -hiiressä (Olmos-Serrano ym., 2010; Kazdoba ym., 2014). Sen testaamiseksi, osoittivatko Fmr1 KO2 -hiiret lokomotorista hyperaktiivisuutta ja voisiko gaboksadoli normalisoida tämän poikkeavan käyttäytymisen, Fmr1 KO2 -hiirille injektoitiin ajoneuvoa tai gaboksadolia (0.5-5 mg / kg, i.p.), ja WT-lajitovereille injektoitiin ajoneuvoa 30 minuuttia ennen testausta OFT: ssä. OFT:ssä kuljettu kokonaismatka (cm) rekisteröitiin 30 minuutin ajan. Tulokset osoittivat, että Fmr1 KO2 -hiirten kulkema etäisyys kasvoi merkittävästi verrattuna WT-litteraattikontrolleihin (Kuva 1, F(8,81) = 21.27, p < 0.0001), mikä on yhdenmukainen muiden FXS-mallien tulosten kanssa. Hoito gaboksadolilla (0,5 mg/kg) normalisoi Fmr1 KO2 -hiirten kulkeman matkan WT-aktiivisuustasolle (Kuva 1). Suuremmilla gaboksadoliannoksilla (1-5 mg/kg, i.p.) ei ollut vaikutusta Fmr1 KO2 -hiirten liikkumisaktiivisuuteen (kuva 1). Nämä tulokset eivät johtuneet gaboksadolin rauhoittavista vaikutuksista, koska WT C57Bl/6- tai BALB/c-hiirillä gaboksadoliannoksilla jopa 2,0 mg/kg, i.p., ei ole vaikutusta liikunta-aktiivisuuteen 60 minuutin OFT:ssä (tietoja ei ole esitetty), mikä on johdonmukaista aikaisempien töiden kanssa, joissa osoitettiin, että gaboksadolilla ei ole vaikutusta WT-hiirten liikunta-aktiivisuuteen (Olmos-Serrano et al., 2011) tai rotilla (Silverman et ai., 2016).
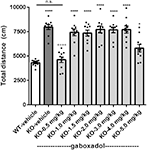
Kuvio 1. Gaboksadoli normalisoi hyperaktiivisuutta Fmr1 KO2 -hiirillä. Kokonaismatka, joka on kuljettu 30 minuutin ajan villityypin pentuetovereille (WT) hiirille, joita on käsitelty ajoneuvolla (valkoinen palkki), Fmr1 KO2 -hiirille, joita on käsitelty ajoneuvolla (knockout, KO tummanharmaa palkki), ja Fmr1 KO2 -hiirille, joita on käsitelty gaboksadolilla (KO-0,5-5,0 mg / kg / kg, vaaleanharmaat palkit). Palkit ovat keskiarvoja ± SEM, pisteet ovat yksittäisten hiirien raakatietoja. *p < 0.05, ****p < 0.0001 vs. WT-ajoneuvoryhmä; ns, ei merkitsevä vs. WT-ajoneuvoryhmä; ++++p < 0.0001 vs. Fmr1 KO2-ajoneuvoryhmä. N = 10 per ryhmä.
Fmr1 KO2 -hiirten ahdistuneisuuden kaltainen käyttäytyminen normalisoituu gaboksadolilla
Gaboksadolin vaikutuksen arvioimiseksi Fmr1 KO2 -hiirten ahdistuneisuuden kaltaiseen käyttäytymiseen käytettiin kolmea erilaista käyttäytymiskoetta: OFT:n, LDT:n ja SAT:n keskipisteen etäisyys. Keskellä kuljetun matkan lisääntyminen tulkitaan vähentyneeksi ahdistuneisuudeksi, ja siinä hyödynnetään hiirten luontaista mieltymystä pysyä kehällä, kun ne tutustuvat uuteen ympäristöön. Fmr1 KO2 -hiirille ruiskutettiin gaboksadolia (0,5-5 mg/kg, i.p.), ja WT-lajitovereille ruiskutettiin ajoneuvoa 30 minuuttia ennen kuin ne sijoitettiin OFT:hen 30 minuutiksi. Fmr1 KO2 -hiirillä keskellä kuljettu kokonaismatka kasvoi merkittävästi verrattuna WT-kontrolliin (kuva 2A, F(8,81) = 21.32, p < 0.0001). Hoito gaboksadolilla (0,5 mg / kg, i.p.) normalisoi Fmr1 KO2: n vaikutuksen keskellä kuljettuun etäisyyteen tasolle, joka oli verrattavissa WT-kontrolleihin (Kuva 2A). Suuremmilla gaboksadoliannoksilla (1-5 mg/kg) ei ollut vaikutusta Fmr1 KO2 -hiiriin tässä testissä (kuva 2A).
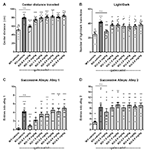
Kuva 2. Gaboksadoli normalisoi ahdistukseen liittyvää käyttäytymistä Fmr1 KO2 -hiirillä. WT-hiirille, joita hoidettiin ajoneuvolla (valkoinen palkki), Fmr1 KO2 -hiirille, joita hoidettiin ajoneuvolla (KO, tummanharmaa palkki), tai Fmr1 KO2 -hiirille, joita hoidettiin gaboksadolilla (KO-0,5-5,0 mg / kg, vaaleanharmaat palkit), tehtiin avoimen kentän koe (OFT), valon/pimeän eksploraatiokoe (LDT) ja peräkkäiset kujatesti (SAT). (A) OFT:n keskellä kuljettu kokonaismatka. (B) Valoisan ja pimeän osaston välisten siirtymien määrä LDT:ssä. (C) Kujan 1 sisäänkäyntien määrä SAT:n aikana. (D) Kujan 2 sisäänkäyntien määrä SAT:n aikana. Palkit ovat keskiarvoja ± SEM, pisteet ovat yksittäisten hiirien raakatietoja. ****p < 0.0001, ***p < 0.001, **p < 0.01, *p < 0.05 vs. WT-ajoneuvoryhmä; ns, ei merkitsevä vs. WT-ajoneuvoryhmä; ++++p < 0.0001, + + + +p < 0.001, + + +p < 0.01 vs. WT-ajoneuvoryhmässä. N = 10 per ryhmä.
Seuraavaksi LDT, joka hyödyntää hiirten luonnollista mieltymystä pimeään, suojattuun ympäristöön, käytettiin toisena käyttäytymismäärityksenä ahdistuneisuudelle. Halukkuus tutkia kammion vaaleaa osastoa, mitattuna osastojen välisten siirtymien lukumäärällä, tulkitaan anksiolyyttiseksi käyttäytymiseksi ja se on herkkä hoidolle anksiolyyttisillä aineilla (Bourin ja Hascoët, 2003). Fmr1 KO2 -hiiret osoittivat merkittävästi lisääntynyttä kammioiden välisten siirtymien määrää LDT: ssä verrattuna WT-hiiriin (kuva 2B, F (8,81) = 5.819, p < 0.0001). Gaboksadoli (0.5 mg / kg, i.p.) normalisoi Fmr1 KO2 -hiirten käyttäytymisfenotyypin WT-tasolle (Kuva 2B). Suuremmilla gaboksadoliannoksilla ei ollut vaikutusta Fmr1 KO2 -hiirten valo/pimeä-siirtymiin (kuva 2B).
Lopuksi SAT: n tulokset vahvistivat, että Fmr1 KO2 -hiirillä havaittu ahdistukseen liittyvä fenotyyppi voidaan normalisoida gaboksadolihoidolla. Tätä testiä käytetään Elevated Plus Labyrintin herkempänä muunnoksena, ja se koostuu neljästä lineaarisesta, peräkkäisestä, yhä anksiogeenisemmasta kujasta (Deacon, 2013). Kujien 2-4 merkintöjen määrä arvioi ahdistuneisuuskäyttäytymistä (Deacon, 2013), kun taas lisääntyneet merkinnät kujalle 1 ovat johdonmukaisia yleisen hyperaktiivisuuden kanssa (Deacon, 2013). Tärkeää on, että aiemmat työt ovat osoittaneet, että lokomotorinen hyperaktiivisuus ei johda vääriin positiivisiin tuloksiin tässä testissä (tarkasteltu Deaconissa, 2013). Fmr1 KO2 -hiiret osoittivat lisääntyneitä merkintöjä kujalle 1 (Kuva 2C, F(8,81) = 11.50, p < 0.0001), mikä on johdonmukaista lisääntyneen liikunta-aktiivisuuden ja kuvassa 1 esitetyn hyperaktiivisuusfenotyypin kanssa. Fmr1 KO2 -hiirillä havaittiin myös merkittävästi enemmän sisäänkäyntejä kujalle 2 verrattuna WT-kontrolleihin (Kuva 2D, F(8,81) = 4.925, p < 0.0001), mikä tukee ahdistukseen liittyvää fenotyyppiä. Gaboksadolin (0.5 mg / kg) injektio Fmr1 KO2 -hiiriin 30 min ennen testausta normalisoi merkinnät kujille 1 ja 2 WT-kontrollien tasolle (kuvat 2C, D). Suuremmilla gaboksadoliannoksilla ei ollut vaikutusta Fmr1 KO2 -hiiriin SAT:ssa (kuvat 2C,D). Kirjautumiset kujille 3 ja 4 lisääntyivät merkittävästi Fmr1 KO2 -hiirillä suhteessa WT-kontrolleihin, mutta gaboksadolista ei havaittu selvää hyötyä millään testatulla annoksella (ei esitetty).
Irritoituvuus ja aggressiivinen käyttäytyminen Fmr1 KO2 -hiirillä normalisoituvat gaboksadolilla
Muuten oireyhtymäkohtaisen autismin muiden muotojen tapaan suurella osalla henkilöistä, joilla on FXS-oireyhtymää, esiintyy ärsyttävyyttä, sosiaalista ahdistuneisuutta ja aggressiota. Näitä poikkeavia käyttäytymismalleja voidaan mallintaa jyrsijöillä karakterisoimalla SI:t testihiiren ja uuden häkkikaverin välillä. Testataksemme hypoteesia, jonka mukaan ärtyneisyys ja aggressiivisuus olisivat lisääntyneet Fmr1 KO2 -mutaatioissa, määrittelimme hännän kolinaa, puremiskäyttäytymistä, kiinnittymiskäyttäytymistä ja hyökkäysviiveen. Hiirille ruiskutettiin ajoneuvoa tai gaboksadolia (0,5-5 mg/kg, i.p.) 30 minuuttia ennen niiden sijoittamista testihäkkiin.
Hännän kolina eli hännän nopeat värähtelyt heijastavat aggressiivisuutta ja taistelutaipumusta. Fmr1 KO2 -hiiret osoittivat merkittävästi lisääntynyttä hännän kolinan taajuutta verrattuna WT-kontrolleihin (kuva 3A, F(8,81) = 16.03, p < 0.0001). Gaboksadoli (0,5, 1,5 ja 5,0 mg/kg) normalisoi vaikutuksen Fmr1 KO2 -hiirillä WT-kontrollin kanssa vertailukelpoiselle tasolle (Kuva 3A).
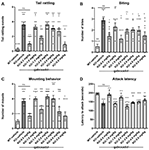
Kuva 3. Gaboksadoli normalisoi ärtyneisyys- ja aggressiivisuuskäyttäytymistä Fmr1 KO2 -hiirillä. Hännän kolina (A), puremiskäyttäytyminen (B), asennuskäyttäytyminen (C) ja latenssi uuden häkkikaverin kimppuun hyökkäämiseen (D) mitattiin WT-hiirillä, joita hoidettiin ajoneuvolla (valkoinen palkki), Fmr1 KO2 -hiirillä, joita hoidettiin ajoneuvolla (KO, tummanharmaa palkki), tai Fmr1 KO2 -hiirillä, joita hoidettiin gaboksadolilla (KO – 0,5 – 5,0 mg / kg, vaaleanharmaat palkit). Palkit ovat keskiarvoja ± SEM, pisteet ovat yksittäisten hiirien raakatietoja. ****p < 0.0001,***p < 0.001,**p < 0.01, *p < 0.05 vs. WT-ajoneuvoryhmä; ns, ei merkitsevä vs. WT-ajoneuvoryhmä; ++++p < 0.0001, +++p < 0.001, ++p < 0.01, +p < 0.05 vs. WT-ajoneuvoryhmä. N = 10 per ryhmä.
Kuten hännän kolina, pureminen on hiirten aggression mittari. Fmr1 KO2 -hiiret osoittivat merkittävästi lisääntynyttä puremien määrää verrattuna WT-kontrolleihin (Kuva 3B, F(8,81) = 5.446, p < 0.0001). Gaboksadoli (0,5, 1,5 ja 5,0 mg/kg) vähensi merkittävästi Fmr1 KO2 -hiirten tekemien puremien määrää (Kuva 3B). Joillakin testatuilla annoksilla (1.0, 3.0 ja 4.0 mg/kg) puremiskäyttäytyminen pysyi kuitenkin merkittävästi lisääntyneenä verrattuna WT-hiiriryhmiin, eikä se muuttunut merkittävästi verrattuna KO-hiirikontrolleihin (Kuva 3B).
Uroshiirillä kiinnittymiskäyttäytyminen on aggressiivinen sosiaalisen dominanssin vakuuttelu. Fmr1 KO2 -hiiret osoittivat merkittävästi lisääntynyttä mounttien määrää verrattuna WT-kontrolleihin (Kuva 3C, F(8,81) = 9.008, p < 0.001). Hoito gaboksadolilla (0.5, 1.5, 4.0 ja 5.0 mg / kg) vähensi merkittävästi asennuskäyttäytymistä Fmr1 KO2 -hiirissä, ja 0.5 ja 5.0 mg / kg -annosten vaikutukset olivat tilastollisesti merkitseviä verrattuna KO-ajoneuvolla käsiteltyihin kontrolleihin (Kuva 3C). Fmr1 KO2 -hiirillä, joita hoidettiin 1,5 ja 4,0 mg/kg gaboksadolilla, kiinnittymiskäyttäytyminen ei eronnut merkittävästi WT-ajoneuvolla käsitellyistä hiiristä, mikä viittaa vaikutuksen suuntaukseen näillä annoksilla, vaikka niiden vertailu KO-ajoneuvolla käsiteltyyn ryhmään ei saavuttanut tilastollista merkitsevyyttä (Kuva 3C).
Viimeiseksi toisena aggressiivisuuden mittarina kirjattiin latenssi hyökätä vastikään kohdattuun hiireen. Fmr1 KO2 -hiirillä havaittiin merkitsevästi alhaisempi latenssi hyökkäykseen verrattuna WT-lajitovereihin (Kuva 3D, F(8,81) = 17.22, p < 0.0001). Alentunut latenssi hyökkäykseen normalisoitui Fmr1 KO2 -hiirillä, joita hoidettiin gaboksadolilla (0,5, 1,5 mg/kg; Kuva 3D).
Gaboksadoli normalisoi toistuvaa käyttäytymistä Fmr1 KO2 -hiirillä
Perseveraatio ja toistuva käyttäytyminen ovat yleisiä henkilöillä, joilla on FXS-oireyhtymä, ja ne ovat erittäin häiritseviä (Arron ym., 2011; Leekam ym., 2011; Hall ym., 2016). Testataksemme hypoteesia, että tällaisia piirteitä voitaisiin havaita Fmr1 KO2 -eläimissä, määrittelimme ympyröintiä, itsehoitoa ja stereotypiaa WT- ja Fmr1 KO2 -mutanttihiirissä. Vastapäivään (CCW) tapahtuvat kierrokset mitattiin testikammiossa sen jälkeen, kun hiirille oli injektoitu Vehikkeliä tai gaboksadolia (0,5-5 mg/kg, i.p.). Fmr1 KO2 -hiiret osoittivat merkittävästi lisääntyneitä CCW-kierroksia 5 minuutin testin aikana verrattuna WT-kontrolleihin (Kuva 4A, F(8,81) = 25.46, p < 0.0001). Gaboksadolin (0.5, 1.0 mg/kg) injektio Fmr1 KO2 -hiiriin palautti CCW-kierrosten määrän WT-tasolle (Kuva 4A). Genotyypillä ei ollut vaikutusta myötäpäivään kiertämiseen (p = 0.386, tietoja ei ole esitetty).

KUVIO 4. Gaboksadoli normalisoi toistuvaa käyttäytymistä Fmr1 KO2 -hiirillä. WT-hiirille, joita hoidettiin ajoneuvolla (valkoinen palkki), Fmr1 KO2 -hiirille, joita hoidettiin ajoneuvolla (KO, tummanharmaa palkki), tai Fmr1 KO2 -hiirille, joita hoidettiin gaboksadolilla (KO-0.5-5.0 mg / kg, vaaleanharmaat palkit), tehtiin neljä testiä, jotka mittaavat toistuvaa käyttäytymistä. (A) Vastapäivään (CCW) tapahtuvat kierrokset mitattiin infrapunasäteen katkoksilla 5-min testin aikana avoimessa kentässä. (B) 5 minuutin testihäkkiin tottumisen jälkeen näytetään 3 minuutin ajan käytetty aika groomingiin. (C) Stereotyyppien lukumäärät (pään heiluttelutapahtumat) 3 minuutin testijakson aikana on esitetty. Palkit ovat keskiarvoja ± SEM, pisteet ovat yksittäisten hiirien raakatietoja. ****p < 0.0001 vs. WT-ajoneuvoryhmä; ns, ei merkitsevä vs. WT-ajoneuvoryhmä; ++++p < 0.0001 vs. Fmr1 KO2-ajoneuvoryhmä. N = 10 per ryhmä.
Fmr1 KO2 -hiirillä groomingiin käytetty aika lisääntyi merkitsevästi verrattuna WT-kontrolliin (Kuva 4B, F(8,81) = 41.99, p < 0.0001). Fmr1 KO2 -hiirissä gaboksadoli-injektio (0.5 mg/kg) normalisoi groomingiin käytetyn ajan WT-tasolle (kuva 4B).
Stereotypia määritellään toistuviksi ja ritualistisiksi liikkeiksi, ja se on yleistä autismissa ja FXS: ssä. Hiirillä stereotyyppisiä toimintoja, kuten pään heiluttelua, voidaan mitata kvantifioimalla infrapunasäteen taukoja testihäkissä. Stereotyyppisten toimintojen lukumäärät lisääntyivät merkittävästi Fmr1 KO2 -hiirillä verrattuna WT-kontrolleihin (kuva 4C, F(8,81) = 19.93, p < 0.0001). Gaboksadolia (0,5 mg/kg) injektoiduilla Fmr1 KO2 -hiirillä stereotyyppinen käyttäytyminen normalisoitui takaisin WT-tasolle (kuva 4C).
Keskustelu
FXS:n kliinisiin oireisiin voivat kuulua hyperaktiivisuus, ahdistuneisuus, muistin ja oppimisen puutteet, sosiaaliset poikkeavuudet, aggressiivisuus ja toistuva käyttäytyminen. Kaikissa tapauksissa hoito 0,5 mg/kg gaboksadolilla palautti Fmr1 KO2 -hiirten käyttäytymisen WT-tasolle (yhteenveto kuvassa 5). Nämä tiedot antavat lisätukea dSEGA-aktiivisuuden ja toonisen eston lisäämiselle gaboksadolilla terapeuttisena strategiana, joka ansaitsee lisätutkimuksia yksilöillä, joilla on FXS.

Kuvio 5. Gaboksadolin yleiset käyttäytymisvaikutukset Fmr1 KO2 -hiirillä. Yhteenveto Fmr1 KO2 -hiirten käyttäytymisen arvioinnin tuloksista, joita on käsitelty ajoneuvolla tai gaboksadolilla (0,5-5,0 mg / kg) verrattuna WT-pittermate-kontrolleihin. Fmr1 KO2 -hiiret osoittivat merkittäviä fenotyyppejä liikkumisaktiivisuudessa, ahdistukseen liittyvässä käyttäytymisessä, ärtyneisyydessä ja aggressiivisuudessa sekä toistuvassa käyttäytymisessä. Kaikki nämä fenotyypit normalisoitiin johdonmukaisesti WT-tasolle gaboksadolihoidolla annoksella 0,5 mg/kg. ”Normaali” käyttäytyminen (vihreät neliöt) vastaa WT-hiiriä, joita on käsitelty ajoneuvolla, ja eroaa tilastollisesti Fmr1 KO2 (KO) -hiiristä, joita on käsitelty ajoneuvolla. ”Epänormaali” käyttäytyminen (punaiset neliöt) vastaa Fmr1 KO2 (KO) -ajoneuvolla käsiteltyjä hiiriä ja eroaa tilastollisesti WT-ajoneuvolla käsitellyistä hiiristä. Keltaiset neliöt merkitsevät eroa, joka ei joko poikkea merkittävästi WT-hiiristä tai eroaa tilastollisesti Fmr1 KO2 (KO) -ajoneuvolla käsitellyistä hiiristä.
Lokomotorinen hyperaktiivisuus on ihmisen FXS:n piirre (Bailey ym., 2008; Wheeler ym., 2014; Hagerman ym., 2017). Tässä tutkimuksessa Fmr1 KO2 -hiiret osoittivat lisääntynyttä lokomotorista aktiivisuutta, joka normalisoitui gaboksadolilla. Aiemmat työt hollantilais-belgialaisilla Fmr1 KO -hiirillä ovat myös osoittaneet johdonmukaista hyperaktiivisuusfenotyyppiä, joka kumoutui gaboksadolihoidolla, kuitenkin suuremmalla annoksella (Olmos-Serrano et ai., 2011). Mahdollisia selityksiä tälle erolle ovat: Gabrd-mRNA:n erilainen säätely (D’Hulst et al., 2006; Curia et al., 2009), ekstrasynaptisten GABA-reseptorien muuttunut pintaekspressio (Zhang et al., 2017), vaikutukset aivojen rakenteeseen (Lai et al., 2016) tai erot mutaation käyttäytymisilmiöissä (Pietropaolo et al., 2011; Spencer et al., 2011). Kumpikin voisi välittyä geneettisen taustan tuloksesta, sillä aiemmat työt tehtiin FVB-hiirillä, kun taas tässä tutkitut eläimet olivat C57BL/6J-hiiriä. Hienovaraiset erot laboratoriolaitteissa, eläinten käsittelyssä ja jopa asumisolosuhteissa, jotka ovat vakiintuneita hiirten käyttäytymisen muokkaajia, voivat myös vaikuttaa (Crabbe et ai., 1999; Wahlsten et ai., 2006).
Tulokset kolmesta ahdistuneisuustestistä, keskipisteen etäisyydestä OFT: ssä, valo-/pimeälaatikossa ja SAT: ssä, osoittavat vankan fenotyypin Fmr1 KO2 -hiiressä, joka kumoutuu gaboksadolihoidolla. On huomattava, että hyperaktiivisuus voi sekoittaa OFT:n ja valo-/pimeälaatikon tulokset. SAT: ssa havaittu ahdistukseen liittyvä käyttäytyminen tapahtuu kuitenkin riippumatta liikunta-aktiivisuuden muutoksista (tarkasteltu Deaconissa, 2013); ja vaikka ahdistuneisuusvaikutus KO: ssa on päinvastainen kuin FXS-potilailla havaittu vaikutus (Bailey et ai., 2008), tuloksemme ovat johdonmukaisia aikaisempien raporttien kanssa, jotka kuvaavat FXS-hiiren fenotyyppiä (tarkasteltu Kazdoba et ai., 2014). On kuitenkin tärkeää, että tulevissa tutkimuksissa pyritään edelleen selvittämään ahdistusvaikutusta näissä hiirissä. Tästä huolimatta ja ennen kaikkea tietomme osoittavat, että gaboksadoli normalisoi FXS-hiirimallissa havaitun poikkeavan ahdistuneisuuskäyttäytymisen sekä kaikki muut analyyseissämme arvioidut käyttäytymismuodot.
Ärsyttävyys ja aggressiivinen käyttäytyminen, jota mallinnettiin mittaamalla SI-arvoja uuden häkkikaverin kanssa, lisääntyivät myös Fmr1 KO2 -hiirissä ja kääntyivät gaboksadolilla. Tuoreessa tutkimuksessa raportoitiin, että lähes kaikki (>90 %) FXS:ää sairastavista miehistä ja naisista, joita oli tutkittu, olivat syyllistyneet johonkin aggressiiviseen käyttäytymiseen edeltävien 12 kuukauden aikana. Heidän joukossaan 33 % miehistä ja 20 % naisista osoitti vakavaa aggressiivisuutta, joka riitti aiheuttamaan vammoja hoitajille (Wheeler ym., 2016). Itsensä vahingoittaminen ja impulsiivinen käyttäytyminen ovat myös yleisempiä henkilöillä, joilla on FXS (Arron ym., 2011).
Repetitiivinen käyttäytyminen ja stereotyyppisyys lisääntyivät johdonmukaisesti Fmr1 KO2 -hiirillä ja lievittyivät gaboksadolihoidolla. Toistuva käyttäytyminen voi aiheuttaa vakavia ongelmia päivittäisessä toiminnassa ja siitä voi tulla este oppimiselle ja SI:lle (Leekam et al., 2011). Stereotyyppistä käyttäytymistä ja sosioemotionaalisia puutteita arvioivat paradigmat saattavat näin ollen olla hyödyllisiä arvioitaessa uusien lääkkeiden tehokkuutta autististen fenotyyppien parantamisessa FXS:ssä.
Gaboksadoli normalisoi kaikki Fmr1 KO2 -hiirten testatut käyttäytymispuutteet annoksella 0,5 mg/kg. Vaikka suuremmat annokset normalisoivat myös ärtyneisyyttä ja aggressiivista käyttäytymistä, tätä ei havaittu muilla arvioiduilla käyttäytymisalueilla. Yksi selitys tässä havaitulle hieman kapealle tehokkuusikkunalle voi johtua aiemmasta työstä, joka osoittaa tiedonkäsittelyn heikentyneen joko riittämättömän tai liiallisen toonisen eston, fysiologisen prosessin, jota gaboksadoli tehostaa. Tämän mallin mukaan lääkkeen käyttäytymiseen liittyvä hyöty suurilla annoksilla kompensoitaisiin farmakologisesti käyttöönotetuilla FXS-riippumattomilla puutteilla (Duguid et ai., 2012).
Tuloksemme tarjoavat vankkaa näyttöä gaboksadolin mahdollisesta hyödystä ASD:hen liittyvän käyttäytymisen, aggression ja sosiaalisuuden kääntämisessä. Kaiken kaikkiaan nämä tulokset tukevat hypoteesia, jonka mukaan ekstrasynaptisten GABAA-reseptorien potensointi gaboksadolilla voi olla hyödyksi henkilöille, joilla on FXS. Yhteenvetona voidaan todeta, että nämä tiedot tukevat gaboksadolin tulevaa arviointia FXS:ää sairastavilla henkilöillä erityisesti hyperaktiivisuuden, ahdistuneisuuden, ASD:hen liittyvän stereotypian, sosiaalisuuden, ärtyneisyyden, aggressiivisuuden ja kognition oireiden osalta.
Eettinen lausunto
Kaikki kokeet suoritettiin Chilen yliopiston ekologian ja biologisen monimuotoisuuden instituutin eettisen komitean (Institute of Ecology and Biodiversity Ethical Committee, University of Chile, Santiago, Chile) suostumuksella.
Tekijöiden panos
BA ja MD aloittivat tämän työn ja työskentelivät yhdessä PC:n ja RD:n kanssa kokeellisen suunnitelman kehittämiseksi. PC ja RD kirjoittivat tulosten yhteenvedon teknisestä raportista, jota JW-S käytti julkaisuvalmiiseen käsikirjoitukseen. MvS osallistui muiden kirjoittajien tavoin tulosten tulkintaan. Kaikki kirjoittajat antoivat palautetta käsikirjoituksesta ennen sen lähettämistä.
Rahoitus
Tämän tutkimuksen sponsoroi ja maksoi kokonaisuudessaan Ovid Therapeutics Inc., New York, NY, USA.
Erittely eturistiriidoista
PC ja RD ovat Gen. DDI Limited -yrityksen perustaja/CEO ja CSO, jonka Ovid Therapeutics palkkasi tässä kuvatun koetyön suorittamisesta. PC ja RD ovat tällä hetkellä FRAXA-DVI:n johtaja ja tiimin jäsen. JW-S sai NeuroJenic Consulting, LLC:n kautta sopimuksen tämän käsikirjoituksen laatimisesta julkaisua varten. MvS, BA ja MD ovat Ovid Therapeuticsin kokopäiväisiä työntekijöitä, ja heillä on myös joko osakkeita tai osakeoptioita.
Arron, K., Oliver, C., Moss, J., Berg, K. ja Burbidge, C. (2011). Itsetuhoisen ja aggressiivisen käyttäytymisen esiintyvyys ja fenomenologia geneettisissä oireyhtymissä. J. Intellect. Disabil. Res. 55, 109-120. doi: 10.1111/j.1365-2788.2010.01337.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Auerbach, B. D., and Bear, M. F. (2010). Hauraan X:n henkisen jälkeenjääneisyyden proteiinin menetys irrottaa metabotrooppisen glutamaattireseptorista riippuvaisen pitkäaikaisen potentiaation primingin proteiinisynteesistä. J. Neurophysiol. 104, 1047-1051. doi: 10.1152/jn.00449.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Bailey, D. B. Jr., Raspa, M., Olmsted, M. ja Holiday, D. B. (2008). FMR1-geenin variaatioihin liittyvät samanaikaiset tilat: valtakunnallisen vanhempien tutkimuksen tulokset. Am. J. Med. Genet. A 146A, 2060-2069. doi: 10.1002/ajmg.a.32439
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassell, G. J., and Warren, S. T. (2008). Fragiili X-oireyhtymä: paikallisen mRNA-säätelyn menetys muuttaa synaptista kehitystä ja toimintaa. Neuron 60, 201-214. doi: 10.1016/j.neuron.2008.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourin, M., ja Hascoët, M. (2003). Hiiren valo/pimeä laatikkotesti. Eur. J. Pharmacol. 463, 55-65. doi: 10.1016/s0014-2999(03)01274-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, G. R., Li, X. Y., Xiang, Y. D., Liu, D., McClintock, S. M., and Zeng, Y. (2017). AMPA-reseptorin vaikutus synaptisen plastisuuden heikkenemiseen ja älylliseen vammaisuuteen hauraassa X-oireyhtymässä. Physiol. Res. 66, 715-727.
PubMed Abstract | Google Scholar
Crabbe, J. C., Wahlsten, D., ja Dudek, B. C. (1999). Hiirten käyttäytymisen genetiikka: vuorovaikutukset laboratorioympäristön kanssa. Science 284, 1670-1672. doi: 10.1126/science.284.5420.1670
PubMed Abstract | CrossRef Full Text | Google Scholar
Curia, G., Papouin, T., Séguéla, P. ja Avoli, M. (2009). Tonisen GABAergisen inhibition alaregulaatio hauraan X-oireyhtymän hiirimallissa. Cereb. Cortex 19, 1515-1520. doi: 10.1093/cercor/bhn159
PubMed Abstract | CrossRef Full Text | Google Scholar
Dahlhaus, R. (2018). Ihmisistä ja hiiristä: hauraan X-oireyhtymän mallintaminen. Front. Mol. Neurosci. 11:41. doi: 10.3389/fnmol.2018.00041
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M. (2013). Peräkkäisten kujien ahdistuneisuustesti hiirillä ja rotilla. J. Vis. Exp. 76:e2705. doi: 10.3791/2705
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M., Glass, L., Snape, M., Hurley, M. J., Altimiras, F. J., Biekofsky, R. R., et al. (2015). NNZ-2566, (1-3) IGF-1:n uusi analogi, mahdollinen terapeuttinen aine hauraan X-oireyhtymän hoitoon. Neuromolecular Med. 17, 71-82. doi: 10.1007/s12017-015-8341-2
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., De Geest, N., Reeve, S. P., Van Dam, D., De De Deyn, P. P., Hassan, B. A., et al. (2006). GABAA-reseptorin vähentynyt ilmentyminen hauraassa X-oireyhtymässä. Brain Res. 1121, 238-245. doi: 10.1016/j.brainres.2006.08.115
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., Heulens, I., Van der Aa, N., Goffin, K., Koole, M., Porke, K., et al. (2015). Positroniemissiotomografia (PET) GABAA-reseptorien kvantifiointi hauraiden X-potilaiden aivoissa. PLoS One 10:e0131486. doi: 10.1371/journal.pone.0131486
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., ja Kooy, R. F. (2007). GABAA-reseptori: uusi kohde hauraan X:n hoidossa? Trends Neurosci. 30, 425-431. doi: 10.1016/j.tins.2007.06.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Dölen, G., Osterweil, E., Rao, B. S., Smith, G. B., Auerbach, B. D., Chattarji, S., et al. (2007). Hauraan X-oireyhtymän korjaaminen hiirillä. Neuron 56, 955-962. doi: 10.1016/j.neuron.2007.12.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Duguid, I., Branco, T., London, M., Chadderton, P. ja Hausser, M. (2012). Tonic inhibition parantaa aistitiedon siirron uskollisuutta pikkuaivokuoressa. J. Neurosci. 32, 11132-11143. doi: 10.1523/jneurosci.0460-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Gantois, I., Vandesompele, J., Speleman, F., Reyniers, E., D’Hooge, R., Severijnen, L. A. ym. et al. (2006). Ekspressioprofilointi viittaa GABAA-reseptorin delta-alayksikön aliekspressioon fragiili X knockout -hiirimallissa. Neurobiol. Dis. 21, 346-357. doi: 10.1016/j.nbd.2005.07.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Gaudissard, J., Ginger, M., Premoli, M., Memo, M., Frick, A. ja Pietropaolo, S. (2017). Käyttäytymispoikkeavuudet hauraan X-oireyhtymän Fmr1-KO2-hiirimallissa: varhaisten elämänvaiheiden merkitys. Autism Res. 10, 1584-1596. doi: 10.1002/aur.1814
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, C., Hoffmann, A., Bassell, G. J. ja Berry-Kravis, E. M. (2015). Terapeuttiset strategiat hauraan X-oireyhtymässä: penkistä vuodeosastolle ja takaisin. Neurotherapeutics 12, 584-608. doi: 10.1007/s13311-015-0355-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R. J., Berry-Kravis, E., Hazlett, H. C., Bailey, D. B. Jr., Moine, H., Kooy, R. F., et al. (2017). Fragiili X-oireyhtymä. Nat. Rev. Dis. Primers 3:17065. doi: 10.1038/nrdp.2017.65
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R., Hoem, G., and Hagerman, P. (2010). Fragiili X ja autismi: molekyylitason kietoutuminen toisiinsa johtaa kohdennettuihin hoitoihin. Mol. Autism 1:12. doi: 10.1186/2040-2392-1-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Barnett, R. P., and Hustyi, K. M. (2016). Ongelmakäyttäytyminen murrosikäisillä pojilla, joilla on hauras X-oireyhtymä: suhteellinen esiintyvyys, taajuus ja vakavuus. J. Intellect. Disabil. Res. 60, 1189-1199. doi: 10.1111/jir.12341
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Jiang, H., Reiss, A. L., and Greicius, M. D. (2013). Suurten aivoverkkojen tunnistaminen hauraassa X-oireyhtymässä. JAMA Psychiatry 70, 1215-1223. doi: 10.1001/jamapsychiatry.2013.247
PubMed Abstract | CrossRef Full Text | Google Scholar
Kazdoba, T. M., Leach, P. T., Silverman, J. L. ja Crawley, J. N. (2014). Hauraan X-oireyhtymän mallintaminen Fmr1 knockout -hiirellä. Intractable Rare Dis. Res. 3, 118-133. doi: 10.5582/irdr.2014.01024
PubMed Abstract | CrossRef Full Text | Google Scholar
Lai, J. K., Lerch, J. P., Doering, L. C., Foster, J. A., and Ellegood, J. (2016). Aivojen alueellisten tilavuuksien muutokset aikuisilla urospuolisilla FMR1-KO-hiirillä FVB-kannalla. Neuroscience 318, 12-21. doi: 10.1016/j.neuroscience.2016.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Leboucher, A., Pisani, D. F., Martinez-Gili, L., Chilloux, J., Bermudez-Martin, P., Van Dijck, A., ym. et al (2019). Translaation säätelijä FMRP kontrolloi rasva- ja glukoosiaineenvaihduntaa hiirillä ja ihmisillä. Mol. Metab. 21, 22-35. doi: 10.1016/j.molmet.2019.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leekam, S. R., Prior, M. R., and Uljarevic, M. (2011). Rajoitettu ja toistuva käyttäytyminen autismin kirjon häiriöissä: katsaus viime vuosikymmenen tutkimukseen. Psychol. Bull. 137, 562-593. doi: 10.1037/a0023341
PubMed Abstract | CrossRef Full Text | Google Scholar
Lightbody, A. A., and Reiss, A. L. (2009). Geenien, aivojen ja käyttäytymisen suhteet hauraassa X-oireyhtymässä: näyttöä neurokuvantamistutkimuksista. Dev. Disabil. Res. Rev. 15, 343-352. doi: 10.1002/ddrr.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Meera, P., Wallner, M., ja Otis, T. S. (2011). Molekulaarinen perusta ekstrasynaptisten GABAA-reseptorien korkealle THIP / gaboksadoliherkkyydelle. J. Neurophysiol. 106, 2057-2064. doi: 10.1152/jn.00450.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Mientjes, E. J., Nieuwenhuizen, I., Kirkpatrick, L., Zu, T., Hoogeveen-Westerveld, M., Severijnen, L., ym. mukaan lukien (2006). Ehdollisen Fmr1 knock out -hiirimallin luominen Fmrp:n toiminnan tutkimiseksi in vivo. Neurobiol. Dis. 21, 549-555. doi: 10.1016/j.nbd.2005.08.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Corbin, J. G., ja Burns, M. P. (2011). GABAA-reseptoriagonisti THIP parantaa spesifisiä käyttäytymishäiriöitä hauraan X-oireyhtymän hiirimallissa. Dev. Neurosci. 33, 395-403. doi: 10.1159/000332884
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Paluszkiewicz, S. M., Martin, B. S., Kaufmann, W. E., Corbin, J. G. ja Huntsman, M. M. (2010). Viallinen GABAerginen neurotransmissio ja hermosolujen yliherkistettävyyden farmakologinen pelastaminen amygdalassa hauraan X-oireyhtymän hiirimallissa. J. Neurosci. 30, 9929-9938. doi: 10.1523/JNEUROSCI.1714-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Osterweil, E. K., Krueger, D. D., Reinhold, K. ja Bear, M. F. (2010). Yliherkkyys mGluR5: lle ja ERK1/2: lle johtaa liialliseen proteiinisynteesiin hauraan X-oireyhtymän hiirimallin hippokampuksessa. J. Neurosci. 30, 15616-15627. doi: 10.1523/JNEUROSCI.3888-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pietropaolo, S., Guilleminot, A., Martin, B., D’Amato, F. R. ja Crusio, W. E. (2011). Ydin- ja vaihtelevien autismin kaltaisten oireiden geneettisen taustan modulointi Fmr1 knock-out-hiirillä. PLoS One 6:e17073. doi: 10.1371/journal.pone.0017073
PubMed Abstract | CrossRef Full Text | Google Scholar
Prut, L., and Belzung, C. (2003). Avoin kenttä paradigmana, jolla mitataan lääkkeiden vaikutuksia ahdistuksen kaltaiseen käyttäytymiseen: katsaus. Eur. J. Pharmacol. 463, 3-33. doi: 10.1016/s0014-2999(03)01272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rotschafer, S. E., Marshak, S., ja Cramer, K. S. (2015). Fmr1:n poisto muuttaa toimintaa ja synaptisia tuloja kuuloaivorungossa. PLoS One 10:e0117266. doi: 10.1371/journal.pone.0117266
PubMed Abstract | CrossRef Full Text | Google Scholar
Scharf, S. H., Jaeschke, G., Wettstein, J. G., ja Lindemann, L. (2015). Metabotrooppinen glutamaattireseptori 5 lääkekohteena Fragile X -oireyhtymässä. Curr. Opin. Pharmacol. 20, 124-134. doi: 10.1016/j.coph.2014.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N. S., Popp, S., Vialou, V., Astafurov, K., Nestler, E. J. ja Dow-Edwards, D. (2016). Gaboksadolin vaikutukset kokaiinin herkistymisen ilmentymiseen rotilla. Exp. Clin. Psychopharmacol. 24, 131-141. doi: 10.1037/pha0000069
PubMed Abstract | CrossRef Full Text | Google Scholar
Spencer, C. M., Alekseyenko, O., Hamilton, S. M., Thomas, A. M., A. M., Serysheva, E., Yuva-Paylor, L. A., ym. et al. (2011). Käyttäytymisfenotyyppien muuttaminen Fmr1KO-hiirillä: geneettiset taustaerot paljastavat autismin kaltaisia vasteita. Autism Res. 4, 40-56. doi: 10.1002/aur.168
PubMed Abstract | CrossRef Full Text | Google Scholar
The Dutch-Belgian Fragile X Consortium, Bakker, C. E., Verheij, C., Willemsen, R., van der Helm, R., Oerlemans, F., et al. (1994). Fmr1 knockout -hiiret: malli hauraan X:n kehitysvammaisuuden tutkimiseen. Cell 78, 23-33. doi: 10.1016/0092-8674(94)90569-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tranfaglia, M. R., Thibodeaux, C., Mason, D. J., Brown, D., Roberts, I., Smith, R., et al. (2019). Käytettävissä olevien lääkkeiden uudelleenkäyttö neurologisiin kehityshäiriöihin: Fragile X -kokemus. Neuropharmacology 147, 74-86. doi: 10.1016/j.neuropharm.2018.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahlsten, D., Bachmanov, A., Finn, D. A., ja Crabbe, J. C. (2006). Käyttäytymisen ja aivojen koon sisäsiittoisten hiirikantojen erojen pysyvyys laboratorioiden välillä ja vuosikymmenten välillä. Proc. Natl. Acad. Sci. U S A 103, 16364-16369. doi: 10.1073/pnas.0605342103
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A., Raspa, M., Bann, C., Bishop, E., Hessl, D., Sacco, P., et al. (2014). Ahdistuneisuus, tarkkaavaisuusongelmat, hyperaktiivisuus ja poikkeavan käyttäytymisen tarkistuslista hauraan X:n oireyhtymässä. Am. J. Med. Genet. A 164A, 141-155. doi: 10.1002/ajmg.a.36232
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A. C., Raspa, M., Bishop, E., and Bailey, D. B. Jr. (2016). Aggressio hauraan X-oireyhtymässä. J. Intellect. Disabil. Res. 60, 113-125. doi: 10.1111/jir.12238
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, N., Peng, Z., Tong, X., Lindemeyer, A. K., Cetina, Y., Huang, C. S., et al. (2017). GABAA-reseptorin delta-alayksikön vähentynyt pintaekspressio vaikuttaa vähentyneeseen tooniseen inhibitioon dentate granulussoluissa hauraan X-oireyhtymän hiirimallissa. Exp. Neurol. 297, 168-178. doi: 10.1016/j.expneurol.2017.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar