- Introduction
- Epidemiologia
- C. difficile -ripulin eli C. difficile -organismi ja patofysiologia
- Kliiniset ilmenemismuodot
- Diagnoosi
- Käytännön ohjeet C. difficile -ripulioireyhtymän diagnosoimiseksi
- C. difficile-ripulin ja -koliitin endoskooppinen diagnostiikka
- Hoito
- Uusiutuvan C. difficile -ripulin hoito
- Vaikea C. difficile -koliitti
- Johtopäätös
Introduction
Clostridium difficileen liittyvä ripuli (Clostridium difficile-associated diarrhea, CDAD) on tunnustettu yhä useammin nosokomiaalisten sairauksien syyksi. CDAD:n esiintymistiheys ja -tiheys vaihtelee suuresti, ja siihen vaikuttavat monet tekijät, kuten sairaalainfektiot, mikrobilääkkeiden käyttötavat ja yksilöllinen herkkyys. Sairaaloiden tekemistä prospektiivisista tutkimuksista, joissa seurattaisiin positiivista toksiini A:ta tai A/B:tä ja CDAD:n ja sen komplikaatioiden tuloksia, ei ole raportoitu.
Tautienvalvonta- ja ehkäisykeskukset (CDC) ovat analysoineet CDAD:n ilmaantuvuuden sekulaarisia kehityssuuntia ja raportoineet, että CDAD:n ilmaantuvuus on kasvanut tasaisesti vuodesta 1987 vuoteen 2001 (1). Tässä raportissa 30 prosenttia 440:stä verkkokyselyyn osallistuneesta infektiolääkäristä ilmoitti, että he näkevät aiempaa enemmän CDAD:tä, vakavampaa CDAD:tä ja uusiutuvaa CDAD:tä. Yleinen käsitys on, että vakaviin ja kuolemaan johtaviin komplikaatioihin johtavien tapausten osuus on kasvanut ja että sairastuneiden potilaiden uusiutumisaste on noussut.
Sairastuvuuden ja kuolleisuuden lisäksi C. difficile -infektiosta aiheutuva taloudellinen taakka viivästyneiden kotiutumisten ja muiden sairaalakustannusten muodossa on huomattava.
Epidemiologia
Cdadiabeteksen esiintymistiheys ja -tiheys vaihtelee sairaaloiden välillä ja tietyn laitoksen sisällä ajan myötä. Sairastumisriski kasvaa potilailla, jotka ovat altistuneet antibiooteille, joille on tehty ruoansulatuskanavan leikkauksia, joiden oleskelu terveydenhuollon laitoksissa pitenee, joilla on vakava perussairaus, joilla on heikentynyt immuunijärjestelmä ja jotka ovat iäkkäitä.
C. difficile erittyy ulosteessa. Kaikki pinnat, laitteet tai materiaalit (esim. kommodit, kylpyammeet ja elektroniset rektaalilämpömittarit), jotka saastuvat ulosteilla, voivat toimia C. difficile -itiöiden varastona. Itiöt siirtyvät potilaisiin pääasiassa niiden terveydenhuoltohenkilöstön käsien välityksellä, jotka ovat koskeneet kontaminoituneeseen pintaan tai esineeseen (2-6).
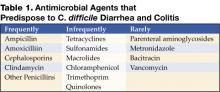 klikkaa isoa versiota varten
klikkaa isoa versiota varten
Kuva 1 . Digitaalinen röntgenkuva tietokonetomografiasta osoittaa nodulaarisen haustopaksuuntuman poikittaisessa paksusuolessa.
C. difficile -ripulin eli C. difficile -organismi ja patofysiologia
C. difficile on grampositiivinen, anaerobinen, itiöitä muodostava bakteeri, joka aiheuttaa antibiootteihin liittyvää ripulia ja paksusuolen tulehdusta. C. difficile kuvattiin ensimmäisen kerran vuonna 1935 terveiden vastasyntyneiden ulosteflooran osana, eikä sitä aluksi pidetty patogeenisenä (7). Bakteeri nimettiin difficileksi, koska se kasvaa hitaasti ja sitä on vaikea viljellä. C. difficile on nykyisin vastuussa lähes kaikista pseudomembranoottisen koliitin syistä ja jopa 20 prosentissa tapauksista, joissa antibioottien aiheuttama ripuli ei aiheuta koliittia. Vaikka vain 5 %:lla väestöstä esiintyy ulosteessa, jopa 21 % aikuisista kolonisoituu tähän organismiin sairaalahoidon aikana (2,6).
Paksusuolen normaalin mikroflooran muuttuminen, joka johtuu yleensä antibioottihoidosta, on tärkein tekijä, joka altistaa C. difficile -infektiolle. Lähes kaikki antibiootit on yhdistetty C. difficile -ripuliin ja koliittiin. Yleisimmin liitettyjä antibiootteja ovat klindamysiini, kefalosporiinit, ampisilliini ja amoksisilliini (taulukko 1) (8).
Antibioottihoidon lisäksi myös vanhempi ikä ja perussairauden vaikeusaste ovat tärkeitä C. difficile -infektion riskitekijöitä. Muita riskitekijöitä ovat muun muassa nenä-mahaletkun olemassaolo, ruoansulatuskanavan toimenpiteet, happamuutta ehkäisevät lääkkeet, teho-osastolla oleskelu ja sairaalahoidon kesto (9).
C. difficile -ripuli aiheutuu ensisijaisesti bakteerien lisääntyessä suolen luumenissa syntyneiden toksiinien A ja B kehittämisestä. Nämä toksiinit sitoutuvat paksusuolen limakalvoon ja vaikuttavat siihen haitallisesti. Organismi vahingoittaa harvoin paksusuolta suoralla hyökkäyksellä, ja ripuli johtuu suolen luumenissa tuotettujen, limakalvon pintaan tarttuvien toksiinien vaikutuksesta. Useimmat toksigeeniset isolaatit tuottavat molempia toksiineja, ja noin 5-25 % isolaateista ei tuota kumpaakaan toksiini A:ta eikä B:tä, eivätkä ne aiheuta paksusuolitulehdusta tai ripulia (3-5).
Kliiniset ilmenemismuodot
Infektio C. difficile -bakteeriin voi saada aikaan monenlaisia kliinisiä ilmenemismuotoja, mukaan lukien oireetonta kulkeutumista, lievää ja keskivaikeaa läpilyöntiripulia sekä fulminantti tauti, johon liittyy pseudomembranoottinen koliitti (10). Potilailla, joille kehittyy CDAD, oireet alkavat yleensä pian kolonisaation jälkeen. Kolonisaatio voi tapahtua antibioottihoidon aikana tai jopa useita viikkoja antibioottikuurin jälkeen. CDAD:hen liittyy tyypillisesti usein toistuvia, löysiä suolenliikkeitä, jotka sopivat proktokoliittiin. Limaa tai okkultoitunutta verta voi esiintyä, mutta näkyvä veri on harvinaista.
Diagnoosi
Diagnoosi CDAD:stä perustuu viimeaikaiseen tai meneillään olevaan antibioottihoitoon, ripulin kehittymiseen tai muuhun näyttöön akuutista paksusuolentulehduksesta ja toksigeenisen C. difficilen aiheuttaman infektion osoittamiseen, tavallisesti toksiini A:n tai toksiini B:n osoittamisella ulostenäytteestä. Ulostetestit C. difficile -infektion diagnosoimiseksi klikkaa isoa versiota varten
Kuva 1 . Digitaalinen röntgenkuva tietokonetomografiasta osoittaa nodulaarisen haustopaksuuntuman poikittaisessa paksusuolessa.
Käytännön ohjeet C. difficile -ripulioireyhtymän diagnosoimiseksi
- Diagnoosia on epäiltävä jokaisella, jolla on ripuli ja joka on saanut antibiootteja kahden edellisen kuukauden aikana ja/tai jonka ripuli alkaa vähintään 72 tuntia sairaalahoidon jälkeen.
- Kun diagnoosia epäillään, yksi ulostenäyte on lähetettävä laboratorioon testattavaksi C. difficilen ja/tai sen toksiinien esiintymisen varalta.
- Jos ripuli jatkuu negatiivisesta ulostetoksiinituloksesta huolimatta, yksi tai kaksi lisänäytettä voidaan lähettää testattavaksi samoilla tai eri testeillä (4). Endoskopia varataan erityistilanteisiin, kuten silloin, kun tarvitaan nopeaa diagnoosia ja testitulokset viivästyvät tai testi ei ole erittäin herkkä, kun potilaalla on ileus eikä ulostetta ole saatavilla tai kun myös muut paksusuolen sairaudet tulevat kysymykseen.
Ei ole vielä olemassa yksinkertaista, edullista, nopeaa, herkkää ja spesifistä testiä, jolla voitaisiin diagnosoida C. difficile-ripulin ja -koliitin diagnosoimiseksi, eivätkä kaikki saatavilla olevat testit sovellu kaikkien laboratorioiden käyttöön (taulukko 2) (11).
C. difficile-ripulin ja -koliitin endoskooppinen diagnostiikka
Sigmoidoskopia ja paksusuolen tähystysleikkaus eivät ole indikoituja useimmille potilaille, joilla on C. difficile-ripuli ja -koliitti (10,12). Endoskopiasta on kuitenkin apua erityistilanteissa, kuten silloin, kun diagnoosi on epävarma tai kun kliininen tilanne vaatii nopeaa diagnoosia. Endoskooppisen tutkimuksen tulokset voivat olla normaalit potilailla, joilla on lievä ripuli, tai ne voivat osoittaa epäspesifistä koliittia keskivaikeissa tapauksissa. Paksusuolen pseudokalvojen löytyminen potilaalta, jolla on antibioottien aiheuttama ripuli, on käytännössä C. difficile -koliitin patognomoninen merkki. Muutamilla potilailla, joilla ei ole mitään diagnostisia piirteitä rectosigmoidissa, on pseudokalvoja paksusuolen proksimaalisemmilla alueilla (13). Muita endoskooppisia löydöksiä ovat eryteema, turvotus, murenevuus ja epäspesifinen koliitti, johon liittyy pieniä haavaumia tai eroosioita.
Hoito
C. difficile -ripulin ja -koliitin hoidossa ensimmäinen askel on lopettaa saostavat antibiootit, jos se on mahdollista (10,12). Ripuli häviää noin 15-25 prosentilla potilaista ilman erityistä C. difficile -vastaista hoitoa (14,15). Pelkkä konservatiivinen hoito ei kuitenkaan välttämättä ole aiheellista potilaille, jotka ovat systeemisesti sairaita tai joilla on useita lääketieteellisiä ongelmia, koska on vaikea ennustaa, mitkä potilaat paranevat spontaanisti. Jos aiheuttavan antibiootin käytön lopettaminen ei ole mahdollista muiden aktiivisten infektioiden vuoksi, potilaan antibioottihoitoa on mahdollisuuksien mukaan muutettava siten, että käytetään aineita, jotka aiheuttavat vähemmän todennäköisesti CDAD:tä (esim, aminoglykosidit, trimetopriimi, rifampiini tai kinoloni).
Antiperistalttisia aineita, kuten difenoksylaattia ja atropiinia (Lomotil) tai loperamidia (Imodium), ja narkoottisia kipulääkkeitä on vältettävä, koska ne voivat viivästyttää toksiinien poistumista paksusuolesta ja siten pahentaa toksiinin aiheuttamaa paksusuolivauriota tai saostaa ileuksen ja toksisen laajentuman (12,16). Erityistä hoitoa C. difficilen hävittämiseksi olisi käytettävä potilailla, joilla on aluksi vaikeita oireita, ja potilailla, joiden oireet jatkuvat antibioottihoidon lopettamisesta huolimatta. Vaikka C. difficile -koliitin diagnoosi olisi mieluiten vahvistettava ennen mikrobilääkehoidon aloittamista, nykyisissä ACG:n ohjeissa suositellaan, että empiirinen hoito aloitetaan erittäin viitteellisissä tapauksissa vakavasti sairastuneilla potilailla (taulukko 3 sivulla 54) (12).
Nykyaikana useimpien kirjoittajien ja nykyisten ohjeiden mukaan ensilinjan hoitona pidetään suun kautta annettavaa vankomysiiniä tai metronidatsolia, joita käytetään 7-10 päivän ajan. Metronidatsolia annoksella 250 mg 4 kertaa vuorokaudessa suositellaan useimpien kirjoittajien ja ACG:n ohjeiden mukaan ensisijaiseksi lääkkeeksi C. difficile -koliitin alkuhoitoon (12). Nämä suositukset perustuvat suurelta osin tehoon, alhaisempiin kustannuksiin ja huoleen vankomysiinille resistenttien kantojen kehittymisestä. Metronidatsolin suurimpiin haittoihin kuuluvat vähemmän toivottava lääkeaineprofiili ja vasta-aiheet lapsilla ja raskaana olevilla naisilla.
Vankomysiini sen sijaan on annoksella 125 mg neljä kertaa vuorokaudessa turvallinen ja hyvin siedetty, ja sillä saavutetaan ulostepitoisuudet, jotka ovat 20 kertaa suuremmat kuin C. difficilen hoidossa vaadittava minimaalinen inhiboiva pitoisuus. Vankomysiinin käytön haittapuolina ovat kustannukset ja vankomysiinille resistenttien kantojen mahdollinen kehittyminen. ACG:n nykyisissä ohjeissa vankomysiiniä pidetään ensisijaisena lääkkeenä vaikeasti sairaille potilaille ja tapauksissa, joissa metronidatsolin käyttö ei ole mahdollista.
Kontrolloidut kliiniset tutkimukset puuttuvat sellaisten potilaiden osalta, joilla on fulminantti koliitti ja jotka eivät välttämättä siedä suun kautta annettavaa hoitoa. Metronidatsolin antamista laskimoon tai vankomysiinin antamista nenämahaletkun tai peräruiskeen kautta on kuvattu pienissä tapaussarjoissa (17-20). Vankomysiinin laskimonsisäistä antoa ei suositella, koska lääke ei erittynyt paksusuolessa (17).
Uusiutuvan C. difficile -ripulin hoito
C. difficile -diabeteksen menestyksekkäästä alkuhoidosta huolimatta 15-20 %:lla potilaista ripuli uusiutuu yhdessä positiivisen C. difficile -myrkkyä osoittavan ulostetestin kanssa. Oireiden uusiutuminen johtuu harvoin hoidon epäonnistumisesta tai mikrobilääkeresistenssistä metronidatsolille tai vankomysiinille. Hoitokeinoja ovat konservatiivinen hoito (monet potilaat ovat kuitenkin iäkkäitä ja heikkokuntoisia eivätkä pysty sietämään ripulia), hoito spesifisillä C. difficile -antibiooteilla, anioneja sitovien hartsien käyttö, hoito mikro-organismeilla (probiootit) ja immunoglobuliinihoito.
Yleisin C. difficile -ripulin uusiutuvan ripulin hoitomuoto on toinen hoitojakso samalla antibiootilla, jota käytettiin alkuperäisen jakson hoidossa (12). Yhdysvalloissa tehdyssä laajassa havainnointitutkimuksessa 92 % potilaista, joilla oli toistuva CDAD, reagoi menestyksekkäästi yhteen toistuvaan hoitojaksoon, yleensä metronidatsolilla tai vankomysiinillä (14). On näyttöä siitä, että potilailla, joilla on ollut uusiutuva CDAD, on suuri riski saada uusia CDAD-episodeja sen jälkeen, kun antibioottihoito on lopetettu. Ei ole tietoja, jotka viittaisivat siihen, että peräkkäiset jaksot muuttuisivat asteittain vaikeammiksi tai monimutkaisemmiksi (21). Potilaille, joilla C. difficile -ripuli toistuu useaan otteeseen, on ehdotettu erilaisia hoitosuunnitelmia. Yksi lähestymistapa on antaa pitkäkestoinen vankomysiinikuuri (tai metronidatsoli), jossa käytetään pienenevää annostusta ja sen jälkeen pulssihoitoa (taulukko 4).
Kolestyramiini, anioninvaihtohartsi, jota annetaan 4 grammaa 3-4 kertaa päivässä 1-2 viikon ajan, sitoo C. difficile -toksiineja, ja sitä voidaan käyttää antibioottien kanssa toistuvien relapsien hoitoon. Koska kolestyramiini voi sitoa vankomysiinin lisäksi myös toksiineja, se on otettava vähintään 2 3 tunnin välein vankomysiinin kanssa.
Vaikea C. difficile -koliitti
Fulminantin C. difficile -koliitin esiintyvyydeksi on raportoitu 1,6-3,2 % (22). Vaikka tuoreet tarkat luvut muista keskuksista puuttuvat, se on tunnustettu kasvavaksi komplikaatioiden ja kuolemien aiheuttajaksi. Fulminantin C. difficile -koliitin kliininen oireyhtymä voidaan tunnistaa, kun tunnetaan asianmukaisesti taudin esiintymispektri.
A. Ripuli: Vaikka ripuli on C. difficile -koliitin tunnusmerkki, sitä ei esiinny poikkeuksetta, ja sen puuttuminen voi johtaa diagnostiseen sekaannukseen. Kun ripulia ei esiinny, se näyttää olevan seurausta paksusuolen vaikeasta dysmotiliteetista. Vaikka ripulia esiintyisikin, sitä saatetaan pitää epäspesifisen septisen kuvan vähäisenä osatekijänä.
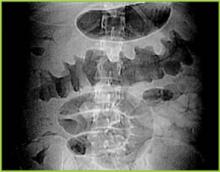 Uudelleen painettu luvalla BUMC Proceedings 1999; 12:249-250
Uudelleen painettu luvalla BUMC Proceedings 1999; 12:249-250
Kuva 1 . Digitaalinen röntgenkuva tietokonetomografiasta osoittaa nodulaarisen haustan paksuuntumisen poikittaisessa paksusuolessa.
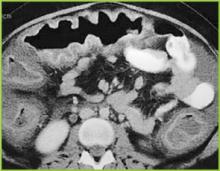 Jäljennetty luvalla BUMC Proceedings 1999; 12:249-250
Jäljennetty luvalla BUMC Proceedings 1999; 12:249-250
Kuva 2 . Ylävatsan tietokonetomografiakuva vahvistaa selvän haustralisen paksuuntumisen poikittaisessa paksusuolessa.
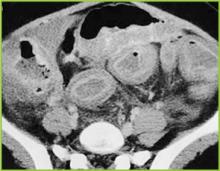 Jäljennetty luvalla BUMC Proceedings 1999; 12:249-250
Jäljennetty luvalla BUMC Proceedings 1999; 12:249-250
Kuva 3 . Keskivatsan TT-kuva osoittaa koko paksusuolen merkittävää paksuuntumista. Perikolonin rasvassa on lieviä tulehduksellisia muutoksia.
B. Vaikea sairaus: Fulminantti koliitti on epätavallinen C. difficile -infektion muoto, jota esiintyy vain 3 %:lla potilaista, mutta joka aiheuttaa lähes kaikki vakavat komplikaatiot. Vakavampia tautimuotoja sairastavilla potilailla voi esiintyä ripulia tai ei. Kun potilaille kehittyy paksusuolentulehdus, joka on paikallistettu paksusuolen paksusuolelle ja oikealle puolelle, ripuli voi olla vähäistä tai puuttua kokonaan. Jos ripulia ei esiinny, ainoat vihjeet diagnoosiin voivat olla systeemiset toksisuuden merkit (kuume, takykardia, leukosytoosi ja/tai tilavuuden väheneminen).
Korostunut valkosolujen määrä voi olla tärkeä vihje lähestyvästä C. difficile -koliitista. Perifeeristen valkosolujen määrän nopea nousu (yleensä jopa 30 000-50 000), jossa on huomattava määrä bändejä ja joskus epäkypsempiä muotoja, edeltää usein hemodynaamista epävakautta ja elinten toimintahäiriöiden kehittymistä. Jopa potilailla, joiden oireet ovat lieviä pitkään, voi tapahtua äkillinen ja odottamaton siirtyminen sokkiin. On vaikea ennustaa niitä potilaita, jotka eivät ehkä reagoi lääkehoitoon. Siksi varhaiset varoitusmerkit, kuten leukemoidireaktio, voivat olla korvaamattomia.
Hypotensio on myöhäinen löydös, ja se voi olla vastustuskykyinen vasopressorituelle. Vatsan oireet vaihtelevat turvotuksesta yleiseen arkuuteen, johon liittyy varovaisuutta. Paksusuolen perforaatioon liittyy yleensä vatsan jäykkyys, tahaton vartiointi, rebound-arkuus ja suoliäänten puuttuminen. Vatsan röntgenkuvissa voi näkyä vapaata ilmaa. Jos tässä tilanteessa epäillään perforaatiota, on välittömästi konsultoitava kirurgia. Kuolema tapahtuu yleensä ennen kuin vapaata ilmaa ja perforaatiota voi esiintyä. Yhdessä tutkimuksessa perforaatio todettiin useimmista muista kirjallisuustutkimuksista poiketen harvinaiseksi (22).
Vatsan röntgenkuvauksessa voi paljastua laajentunut paksusuoli (>7 cm suurimmassa läpimitassaan), joka on sopusoinnussa myrkyllisen megakoolonin kanssa. Potilailla, joilla on megakoloni, voi olla siihen liittyvä ohutsuolen ileus, johon liittyy laajentunut ohutsuoli tavallisissa vatsan röntgenkuvissa, ja ilma-nestepitoisuudet jäljittelevät ohutsuolen tukosta tai iskemiaa. Kontrastia sisältämättömällä tietokonetomografialla ja endoskopialla voidaan nopeasti diagnosoida tai ainakin vahvasti viitata fulminanttiin C.difficile-koliittiin. TT-kuvauslöydöksiin kuuluvat todisteet askitesista, paksusuolen seinämän paksuuntumisesta ja/tai laajentumisesta. Näistä löydöksistä voi olla apua koliitin vaikeusasteen luokittelussa.
Agressiivisempi toiminta lääkkeisiin reagoimattomilla potilailla, mukaan lukien sellaisten potilaiden nopea tunnistaminen, jotka eivät reagoi lääkehoitoon, on ratkaisevaa positiivisen lopputuloksen kannalta, ja tässä ryhmässä olisi tehtävä varhainen kirurginen toimenpide (kuvat 1-3).
On tärkeää, että kaikki, jotka osallistuvat potilaiden hoitoon sairaaloissa, vanhainkodeissa ja ammattitaitoisissa hoitoyksiköissä, ovat perehdytettyinä kyseiseen mikrobiin ja sen epidemiologiaan, rationaalisiin toimintatapoihin hoidossa ja potilaan hoidossa, joka sairastaa potilaita, joilla on C..difficile -virus. difficile-ripulia sairastavaa potilasta hoidettaessa, käsienpesun tärkeydestä potilaskontaktien välillä, käsineiden käytöstä ja mikrobilääkkeiden tarpeettoman käytön välttämisestä.
Johtopäätös
Viime vuosina on herättänyt huolta CDAD:n lisääntyvästä esiintyvyydestä ja vakavien komplikaatioiden määrästä pohjoisamerikkalaisissa sairaaloissa (22,23). Canadian Medical Association -lehdessä julkaistiin vuonna 2004 raportti, jossa kerrottiin yksityiskohtaisesti CDAD-taudinpurkauksesta, joka koski useita sairaaloita Montrealissa. Uusien hypervirulenttien ja hyvin tarttuvien C. difficile -kantojen käyttöönottoa on pidetty mahdollisena syynä taudinpurkaukseen (24). Infrastruktuurin heikkenemisen, puutteellisten infektioiden torjuntakäytäntöjen, heikkokuntoisten potilaiden määrän lisääntymisen, väestön ikääntymisen ja hypervirulenttien kantojen katsottiin todennäköisesti vaikuttaneen viimeaikaisiin taudinpurkauksiin Kanadassa (25).
Kahdessa Yhdysvalloissa ja Kanadassa tehdyssä epidemiologisessa tutkimuksessa (24,26) tutkittiin toisistaan riippumattomasti C. difficile -bakteerista otettuja näytteitä, ja niissä kävi ilmi, että ”luonnonvaraisen” kannan mutatoitunut muunnos oli syypää taudinpurkauksiin Quebecissä ja lisääntyneeseen CDAD:n esiintyvyyteen viime aikoina yhdysvaltalaisten sairaaloiden sairaalääketieteellisissä yksiköissä (22,23). CDC:n kliiniset epidemiologit tutkivat C. difficile -isolaatteja yhdysvaltalaisista sairaaloista, joissa oli viimeaikaisia (eli vuosina 2001-2004) CDAD-epidemioita (22,23). Raportti osoittaa, että on ilmaantunut uusi epidemiakanta, ”BI” (joka eroaa vuosien 1989-1992 ”J”-kannasta), joka saattaa olla vastuussa CDAD:n viimeaikaisesta lisääntymisestä ja CDAD:n ilmeisestä vakavuudesta (26).
CDAD ja koliitti voidaan useimmissa tapauksissa hoitaa antamalla metronidatsolia tai vankomysiiniä. Joillekin potilaille kehittyy vakavaa hengenvaarallista toksisuutta asianmukaisesta ja oikea-aikaisesta lääkehoidosta huolimatta, ja kirurginen toimenpide on tarpeen. C. difficile -infektion systeemisten oireiden ei ole raportoitu johtuvan bakteremiasta, paksusuolen perforaatiosta tai iskemiasta vaan toksiinin aiheuttamista tulehduksen välittäjäaineista, joita vapautuu paksusuolesta (27-29). Varhaista kirurgista toimenpidettä olisi käytettävä vaikeassa tautitilanteessa, jossa tautia on vaikea torjua. Kirurginen toimenpide on kuitenkin kaukana ihanteellisesta, ja siihen liittyy erittäin suuri komplikaatioiden määrä ja merkittävä kuolleisuusriski (22). Tulevaisuuden kliininen lähestymistapa nosokomiaalisen C. difficile -koliitin hoitoon saattaa lopulta sisältää spesifisiä antitoksiinihyperimmunoglobuliineja ja tulehduskaskadin estäjiä (28,30,31) (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Secular trend in hospital-acquired Clostridium difficile disease in the United States; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis. In: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Pathogenesis, epidemiology, and treatment. Gastroenterologi. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Historiaa sen roolista suolistopatogeenina ja nykytietämys organismista. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Clostridium difficilen nosokomiaalinen hankinta. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: With a description of a new pathogenic anaerobe, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Clostridium difficile -ripulin ja -koliitin hoito. In: Wolfe MM, ed. Gastrointestinal Pharmacotherapy. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Clostridium difficile -infektion riskitekijät. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile -koliitti. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile -koliitti. In: Lamont JT, ed. Gastrointestinal Infections: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Peräsuolen säästäminen antibioottien aiheuttamassa pseudomembranoottisessa koliitissa: A prospective study. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Kymmenen vuotta prospektiivista Clostridium difficileen liittyvän taudin seurantaa ja hoitoa Minneapolisin VA Medical Centerissä 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospektiivinen satunnaistettu tutkimus metronidatsolin ja vankomysiinin käytöstä Clostridium-difficileen liittyvän ripulin ja koliitin hoidossa. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamidiin liittyvä toksinen megakoloni Clostridium difficile -koliitissa. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile -tauti. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Vakavan Clostridium difficile -koliitin liitännäishoitona annettu vankomysiini: Tapaussarja ja kirjallisuuskatsaus. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Suonensisäinen metronidatsoli Clostridium difficile -koliitin hoidossa. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Toistuva Clostridium difficile -ripuli: prospektiiviseen, satunnaistettuun, kaksoissokkotutkimukseen osallistuneiden potilaiden ominaisuudet ja riskitekijät. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: aliarvostettu ja lisääntyvä kuoleman ja komplikaatioiden syy. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile -koliitti: yhä aggressiivisempi iatrogeeninen sairaus? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile -infektio sairaaloissa: Myrskyn puhkeaminen. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4: Virulenssitekijöiden ja mikrobilääkeresistenssipiirteiden mahdollinen merkitys. Infectious Diseases Society of America 42. vuosikokous. Boston, MA, 30. syyskuuta – 3. lokakuuta 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Increased substance P responses in dorsal root ganglia, intestinal macrophages during Clostridium difficile toxin A enteritis in rot. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimuloi makrofagi-inflammaatioproteiini-2:n tuotantoa rotan suoliston epiteelisoluissa. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Anti-Clostridium difficile naudan immunoglobuliinikonsentraatin selviytyminen ihmisen ruoansulatuskanavassa. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis. Gut. 1997;41:366-70.